中和热的测定实验方案
- 格式:pdf
- 大小:53.31 KB
- 文档页数:3

测定中和反应热【实验目的】1.理解中和热的概念2.能以中和热的测定为例掌握反应热的测定方法3.能进行误差分析,采取措施减少实验误差。
【实验探究】中和反应反应热的测定(1)实验原理:根据中和热的概念,通过简单实验测量一定量的强酸、强碱溶液在反应前后的温度变化,计算反应放出的热量,依据Q=cm△t计算Q(反应放出的热量),从而测定反应热(中和热)计算公式:即通过测定一定量的酸、碱溶液在反应前后温度的变化,计算反应放出的热量,由此求得反应热。
①c:比热容,近似认为4.18J/(g·℃);②m:盐酸和氢氧化钠的总质量(密度近似为1g/cm3);③Δt:前后两次的温度差Δt=t2-t1。
(2)实验用品(3)实验装置:①装置名称:(简易)量热计。
②各部分仪器的作用ⅰ.玻璃搅拌器的作用是使反应物混合均匀充分接触。
ⅱ.隔热层的作用是减少热量的散失。
ⅲ.温度计的作用是测定反应前后反应体系的温度(4)实验步骤①反应物温度(t1)的测量:用一个量筒量取50mL0.50 mol·L-1盐酸,打开杯盖,倒入量热计的内筒,盖上杯盖,插入温度计,测量并记录盐酸的温度。
用水把温度计上的酸冲洗干净,擦干备用;用另一个量筒量取50mL0.55 mol·L-1 NaOH溶液,用温度计测量并记录NaOH溶液的温度,取两温度平均值为t1。
②反应后体系温度(t2)的测量打开杯盖,将量筒中的NaOH溶液迅速倒入量热计的内筒,立即盖上杯盖,插入温度计,用搅拌器匀速搅拌。
并准确读取混合溶液的最高温度,并记录为t2。
③重复实验操作三次,记录每次的实验数据,取其平均值作为计算依据。
(5)实验数据处理:①计算实验中盐酸与NaOH溶液完全反应放出的热量(保留三位有效数字,下同) 。
Q=cmΔt=100g×4.18 J·g-1·℃-1×(t2—t1) ℃=0.418(t2—t1) kJ≈ 1.42kJ;②计算生成1 mol H2O时的放出的热量。

测定中和热的实验报告测定中和热的实验报告引言:中和反应是化学中一种常见的反应类型,它涉及酸和碱之间的化学反应。
在实验中,我们通过测定中和反应的热变化来研究反应的热力学性质。
本实验旨在通过测定一系列酸碱溶液的中和热,了解中和反应的特性,并通过实验数据分析来推断反应的热力学参数。
实验方法:1. 实验仪器与试剂:本实验所需的仪器有:热量计、量筒、酸碱溶液、温度计等。
试剂:稀硫酸、稀盐酸、稀氢氧化钠溶液、稀氢氧化钾溶液。
2. 实验步骤:(1)将热量计放在稳定的支架上,并将其与温度计连接。
(2)用量筒分别量取一定体积的稀硫酸和稀氢氧化钠溶液。
(3)将稀硫酸缓慢地加入热量计中,记录下初始温度。
(4)将稀氢氧化钠溶液缓慢地加入热量计中,记录下反应后的最高温度。
(5)重复以上步骤,分别使用稀盐酸和稀氢氧化钾溶液进行实验。
实验结果与讨论:通过实验测得的数据,我们可以计算出每个中和反应的热变化。
根据热力学原理,中和反应的热变化可以通过以下公式计算:ΔH = q/n其中,ΔH代表中和反应的热变化,q表示测得的热量,n表示摩尔数。
在实验中,我们可以通过热量计测得的热量来计算热变化。
通过实验数据的分析,我们可以观察到以下几个现象:1. 不同酸碱溶液的中和热不同,这是由于不同酸碱的反应热力学性质不同所导致的。
例如,稀硫酸和稀盐酸的中和热较大,而稀氢氧化钠和稀氢氧化钾的中和热较小。
2. 中和反应的热变化与摩尔数成正比,这是由于热变化是一个宏观性质,与反应物的量有关。
当反应物的摩尔数增加时,热变化也相应增加。
3. 中和反应是一个放热反应,这是由于酸和碱之间的化学反应通常会释放出能量。
因此,中和反应的热变化为负值。
根据实验数据的分析,我们可以进一步推断反应的热力学参数,如反应焓变(ΔH)和反应熵变(ΔS)。
通过计算反应焓变,我们可以了解反应的放热性质;而通过计算反应熵变,我们可以了解反应的混乱程度。
结论:通过本实验,我们成功测定了一系列酸碱溶液的中和热,并通过实验数据的分析推断了反应的热力学参数。

中和热的测定实验报告中和热的测定实验报告引言:中和热是指在一定条件下,酸和碱反应生成盐和水时所释放或吸收的热量。
中和热的测定可以帮助我们了解酸碱反应的热力学性质,并在实际应用中起到重要的作用。
本实验旨在通过测定酸碱反应的中和热,探究酸碱反应的热力学特性。
实验过程:1. 实验器材准备:- 酸和碱的溶液,如盐酸和氢氧化钠溶液;- 热量计;- 量热器;- 温度计;- 火柴;- 搅拌棒;- 塑料容器。
2. 实验步骤:a. 将量热器放在塑料容器中,并将其固定;b. 在量热器中加入一定量的酸溶液,并记录初始温度;c. 在另一个容器中加入一定量的碱溶液,并记录初始温度;d. 将碱溶液缓慢地倒入量热器中的酸溶液中,同时用搅拌棒搅拌;e. 观察反应过程中的温度变化,并记录最终温度;f. 根据温度变化计算出反应的中和热。
实验结果与分析:在实验过程中,我们测得了酸和碱反应的初始温度、最终温度以及反应的中和热。
通过对实验数据的分析,我们可以得出以下结论:1. 反应过程中的温度变化:在反应开始时,酸和碱溶液混合,反应初期会伴随一定的温度变化。
随着反应的进行,温度逐渐升高或降低,直到达到最终温度。
这一温度变化的过程反映了反应过程中的热量变化。
2. 反应的中和热:反应的中和热通过温度变化计算得出。
根据热量计的原理,我们可以利用反应过程中释放或吸收的热量来计算反应的中和热。
中和热的单位通常是焦耳/摩尔或千焦/摩尔。
3. 实验误差的影响:在实际实验中,由于各种因素的影响,如热量的散失、温度计的误差等,实验结果可能存在一定的误差。
为了减小误差,我们可以采取一些措施,如在实验过程中加盖量热器,使用精确的温度计等。
实验应用:中和热的测定在实际应用中有着广泛的用途。
以下是一些中和热测定的应用领域:1. 化学反应热力学研究:中和热的测定可以帮助我们了解酸碱反应的热力学性质,如反应的放热或吸热特性。
这对于研究化学反应的热力学过程、探究反应机理等都具有重要意义。

中和热的测定一、实验目的1.了解中和热测定原理;2.掌握中和热的测定方法。
二、实验原理在一定的温度,压力和浓度下,1mol酸和1mol碱中和所放出的热量叫做中和热。
对于强酸和强碱在水溶液中几乎完全电离,中和反应的实质是溶液中氢离子和氢氧根离子反应生成水。
这类中和反应的中和热与酸的阴离子的碱的阳离子无关。
当在足够稀释的情况下中和热不随酸和碱的种类而改变的,中和热几乎是相同的。
20℃,△H中和=-57.11KJ/mol25℃,△H中和=-57.30KJ/mol当溶液相当浓时,中和热数值常较高,因为离子间相互作用力及其因素影响。
电热标定法:对量热计及一定量的水在一定的电流,电压下通电一定时间,使量热计升高一定温度,根据供给的电能及量热计温度升高值,计算量热计的热容K。
K=IUt/△T (K的物理意义是热量计升高1K时所需的热量)△rHm=-1000K△T/CV上式中C为酸或碱的初始浓度(mol/L),V为酸或碱的休积(ml),负号代表放热反应。
三、实验主要仪器与试剂热量计(包括杜瓦瓶,电热丝,储液管,磁力搅拌器)1套精密直流稳压电流1台精密数字温度温差仪1台量筒1 mol/LNaOH溶液1 mol/LHCl溶液四、实验步骤1.热量计常数K的测定①.在杜瓦瓶中放入500mL蒸馏水,打开磁力搅拌器,搅拌。
②.开启精密直流稳压电流,调节输出电压和电流(电压为5V左右),电压稳定后将其中一根接线断开。
③.按下精密数字温度温差仪开关,片刻后按一下“采零”键,再设定“定时”1分钟,此后每分钟记录一次温差,当记下第十个读数时,立即将接线接上(此时即为加热的开始时刻),并连续记录温差。
④.待温度升高0.8-1.0时,关闭稳压电源开关,并记录通电时间t。
继续搅拌,每间隔一分钟记录一次温差,断电后测定10个点为止。
用作图法确定由通电而引起的温度变化△T1。
2.中和热的测定①将杜瓦瓶中的水倒掉,用干布擦干,重新用量筒取400mL蒸馏水注入其中,然后加入50mL1 mol/LHCl溶液,再取50mL1 mol/LNaOH溶液注入储液管中。



大学中和热的测定实验报告1、仪器:大烧杯,小烧杯,隔热材料碎纸,盖板,温度计,环形搅棒,量筒。
2、药品:1mol/LHCI 1.1mol/L NaOH。
3、大烧杯放碎纸,放上小烧杯,周围隔热材料碎纸。
4、量取50毫升HCI于小烧杯中,测温,记录。
5、量取50毫升NaOH,测温,记录。
6、在小烧杯中,小心注入氢氧化钠溶液,盖板,温度计,环形搅棒搅动,读取最高温度。
7、平行实验三次,计算均值。
注意事项:1、选择合适浓度的酸溶液和碱溶液进行反应,一般是一种反应物稍过量,通常用0.50mo l/L的HCl溶液和0.55mol/L的NaOH溶液,等体积混合,使酸完全反应。
2、测定要准确,记录温度要及时,中和热是通过测定温度的变化来计算的,要知道每一阶段溶液的准确温度,需做好温度数据的记录。
3、注意仪器使用,在测定盐酸溶液的温度后,要用水洗净温度计上的少量酸液,带入到碱溶液中会由于反应放热而影响到碱溶液温度的变化,还应选用两支不同的吸量管分别量取盐酸与氢氧化钠溶液。
4、注意保温,温度的变化对实验结果会造成较大的误差,测量必须在相对隔热的装置中进行,保证装置的隔热效果,在测量温度时,应该选取混合液的最高温度作为测定值。
要点:1、必须是酸和碱的稀溶液,因为浓酸溶液和浓碱溶液在相互稀释时会放热。
2、强酸和强碱的稀溶液反应才能保证H+(aq)+OH-(aq)=H2O(l)中和热均为57.3 kJ·mol-1,而弱酸或弱碱在中和反应中由于电离吸收热量,其中和热小于57.3 kJ·mol-1;3、以生成1mol水为基准。
4、反应不可以生成沉淀(如Ba(OH)2+H2SO4=BaSO4+2H2O)。

10-4-中和热(焓)的测定中和热是指在一定条件下,酸和碱溶液配制成盐的过程中,放出或吸收的热量。
中和反应是化学反应中重要的一种,常常用于将酸、碱中和成盐,这种反应在生活中也有很多应用,在化学实验中常常需测定中和热的大小,以便掌握化学反应情况和控制反应过程。
中和热的测定方法有多种,本文主要介绍几种比较常用的方法。
一、稀酸稀碱溶液中和法稀酸稀碱溶液中和法是一种简单易行的测定中和热的方法,只需将酸、碱溶液分别加到两个容量相等的烧杯中,通过热浸方法来测定中和反应释放或吸收的热量。
具体步骤如下:1、分别取两个容量相等的烧杯,分别称出一定质量的稀酸和稀碱溶液。
2、将酸溶液倒入一个烧杯中,再将等量的碱溶液倒入另一个烧杯中。
3、用温度计测量两个烧杯中溶液的初温,并记录下来。
5、根据混合前溶液的温度、混合后溶液的最高温度和酸、碱溶液的质量计算出中和反应的热量。
二、热量计法热量计法比较准确地测定中和热,常用仪器为热量计,热量计以上称量、计时、测温为基础,通过等定压、等兑换等方法来测定中和反应释放或吸收的热量。
具体步骤如下:1、将热量计的内胆充满水,测定水的初始温度,并记录下来。
3、将酸溶液倒入热量计中,并迅速加入过量的碱溶液,通过搅拌将酸、碱彻底混合。
4、观察水温的变化,并测定混合后溶液达到最高温度的时间。
1、取一定量的酸溶液和碱溶液,在恒温水槽中将两种试液浸泡至相同温度。
2、在实验室桌子上,将两个容器分别置于恒流量热计的两侧。
3、开启热量计和流量计,并在一段时间后稳定读取制冷器功率输出和恒流量值。
4、将酸溶液从制冷器侧加入一侧容器,然后将碱溶液从恒流量热计一侧加入另一侧容器,同时打开相应的阀门。
5、记录实验过程中的各个参数,并计算中和反应的热量。
以上就是几种测定中和热的方法,每种方法都有其优缺点,具体选择方法应考虑实验条件、仪器设备以及实验要求等因素。

实验七十三 中和热的测定【实验目的】1.掌握酸碱中和反应热效应的测定方法。
2.学会用雷诺图解法校正温差。
【实验原理】在一定的温度和压力下,1mol 酸和1mol 碱发生中和反应时所放出的热量叫做中和热。
本实验利用盐酸与氢氧化钠反应,测定其中和热。
离子方程式如下:图4-18为量热计装置图,反应在绝热容器杜瓦瓶中进行,温度传感器为热电偶,温度时间曲线由计算机采样自动绘出。
根据反应后量热计温度升高的值以及量热计的热容K ,就可以算出该反应的热效应。
在实验过程中,让氢氧化钠过量,故反应的量可准确地用盐酸的量来进行计算。
设HC1溶液浓度为c mol.L -1,体积为V 升,反应后温度升高ΔT 中,则中和热为:中中和=-T CVK H ∆⋅∆ (4-29) 量热计的热容K 可用电热标定法标定。
当中和反应结束后,系统中溶液的量是一定的,此时在恒定的电压V 下向系统中的电加热器提供一恒定的电流I ,加热一段时间t 后,系统的温度会升高,若升高的温度为ΔT 电,则可用(4-30)式计算出量热计的热容K 。
本实验加热过程中向系统提供的电功由计算机对电流、电压和时间进行采样后自动计算出来,不需要人工计算。
电电电功T VIt T K ∆∆== (4-30)图4-18 量热计装置图【仪器和试剂】1.仪器:计算机 1台、打印机 1台、杜瓦瓶 1个、中和热测量数据采集接口装置 1台、恒流源 1台、容量瓶(100mL 1个)。
2.试剂: 标准HC1溶液(约0.1mol ·L -1,准确浓度要标定)、NaOH 溶液(约0.11mol ·L -1)【实验步骤】1.用100mL 容量瓶量取100mLNaOH 溶液(约1.1mol·L -1)注入杜瓦瓶中,再加入800mLH 2O 。
并放入磁力搅拌子,开启磁力搅拌器,缓慢搅拌。
用100mL 容量瓶精确量取100mLHC1溶液,放置一旁备用。
2.用滤纸将温度传感器擦干净后插入杜瓦瓶中。

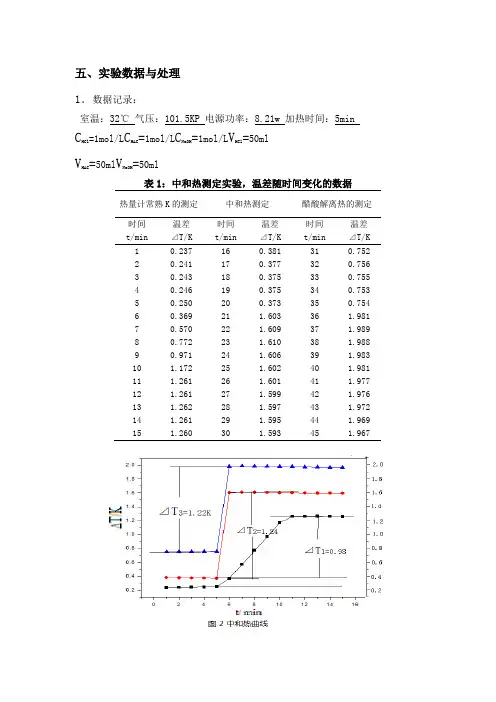
五、实验数据与处理1.数据记录:室温:32℃气压:101.5KP 电源功率:8.21w 加热时间:5min C HCl=1mol/L C HAC=1mol/L C NaOH=1mol/L V HCl=50mlV HAC=50ml V NaOH=50ml表1:中和热测定实验,温差随时间变化的数据热量计常熟K的测定中和热测定醋酸解离热的测定时间t/min温差⊿T/K时间t/min温差⊿T/K时间t/min温差⊿T/K1 0.237 16 0.381 31 0.7522 0.241 17 0.377 32 0.7563 0.243 18 0.375 33 0.7554 0.246 19 0.375 34 0.7535 0.250 20 0.373 35 0.7546 0.369 21 1.603 36 1.9817 0.570 22 1.609 37 1.9898 0.772 23 1.610 38 1.9889 0.971 24 1.606 39 1.98310 1.172 25 1.602 40 1.98111 1.261 26 1.601 41 1.97712 1.261 27 1.599 42 1.97613 1.262 28 1.597 43 1.97214 1.261 29 1.595 44 1.96915 1.260 30 1.593 45 1.9672.数据处理由图2可求的:K=qt/⊿T1=2442.421J/K⊿r Hm,中和=-k⊿T2*1000/C1V1=-60.57KJ/mol⊿r Hm=-k⊿T3*1000/C2V2=-59.60KJ/mol⊿r Hm,解离=⊿r Hm-⊿r Hm,中和=-59.60KJ/mol-(-60.57KJ/mol)=0.97KJ/mol六、注意事项1.本实验是用同一热量计在相同条件下分别测定电加热温差⊿T1及中和反应温差⊿T2、⊿T3。
在三次测量过程中,应尽量保持测定条件一致,例如水和酸碱溶液的体积量取,搅拌速率控制,出示状态水温等。
中和反应反应热的测定实验实验原理:稀溶液中,酸跟碱发生中和反应而生成1molH 2O ,这时的反应能量变化叫做中和热。
实验中通过测定酸碱中和反应过程中所放出的热量来计算中和热。
实验用品:大烧杯(500mL )、小烧杯(100mL )、温度计、量筒(50mL )两个、泡沫塑料或纸条、泡沫塑料板或硬纸板(中心有两个小孔)、环形玻璃搅拌器。
0.50,ol/L 盐酸、0.55mol/L NaOH 溶液。
实验步骤:⑴在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯扣与大烧杯口相平。
然后再在大、小烧杯之间填满碎泡沫塑料,大烧杯上用泡沫塑料板作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌器通过,以达到保温隔热、减少实验过程中热量损失的目的,如图所示。
该实验也可在保温杯中进行。
⑵用一个量筒量取50mL 0.05mol/L 的盐酸,倒入小烧杯中,并用温度计测量盐酸的温度,记入下表。
然后把温度计上的酸用水冲洗干净。
⑶用另一个量筒量取50mL0.55mol/L 的NaOH 溶液,并用温度计测量NaOH 溶液的温度,记入下表。
⑷把套有盖板的温度计和环形玻璃搅拌器放入小烧杯的盐酸中,并把量筒中的NaOH 溶液一次倒入小烧杯(注意不要洒在外面),盖好盖板。
用环形玻璃搅拌器轻轻搅动溶液,并准确读取混合溶液的最高温度,记为终止温度,记入下表。
⑸重复实验两次,取测量所得数据的平均值作为计算依据。
为了使计算更简便一些,我们近似地认为0.5mol/L 的盐酸和0.55mol/L 的NaOH 溶液的密度都是1g/cm 3,所以50mL0.5mol/L 的盐酸的质量m 1=50g ,50mL0.55mol/L 的NaOH 溶液的质量m 2=50g 。
中和后生成溶液的比热容c=4.18J ·(g ·℃)-1,由此可以计算出,50mL0.55mol/L 的盐酸与50mL0.55mol/L 的NaOH 溶液发生中和反应时放出的热量为(m 1+ m 2)·c ·(t 2- t 1)=0.418(t 2- t 1)kJ 又因50mL0.55mol/L 的盐酸中含有0.025mol HCl ,0.025mol HCl 与0.025mol NaOH 发生中和反应,生成0.025molH 2O ,放出热量是0.418(t 2- t 1)kJ所以,生成1 mol H 2O 时放出的热量即为中和热为025.0)(418.012t t kJ/mol实验思考:1、反应热的测定实验中酸碱溶液为什么一定用稀溶液?答:在稀溶液中强酸与强碱已经完全电离,不会影响H ++OH -==H 2O 反应所产生的热量的测定。
中和热测定的实验报告中和热测定的实验报告一、引言中和反应是化学实验中常见的一类反应,它涉及酸和碱之间的反应,产生盐和水。
中和热测定实验是通过测量中和反应的热变化来研究反应的热力学性质。
本实验旨在通过测定强酸和强碱的中和热,了解酸碱中和反应的热力学特性。
二、实验方法1. 实验仪器和试剂准备本实验所需仪器包括热量计、电磁搅拌器和量热器。
试剂包括硫酸和氢氧化钠。
2. 实验步骤(1)将热量计的两个热量计罐清洗干净,并用纸巾擦干。
(2)向一个热量计罐中加入一定量的硫酸,称为试样。
(3)向另一个热量计罐中加入一定量的氢氧化钠溶液,称为试剂。
(4)将试样和试剂放入量热器中,用电磁搅拌器搅拌均匀。
(5)记录试样和试剂的初始温度,并将试样和试剂倒入热量计中,迅速盖上热量计盖子。
(6)观察反应过程中温度的变化,并记录下最终温度。
三、实验结果与分析根据实验数据,可以计算出中和反应的热变化。
设试样的质量为m1,试剂的质量为m2,试样和试剂的初始温度分别为T1和T2,最终温度为T3,则可得中和反应的热变化ΔH为:ΔH = (m1 × C1 + m2 × C2) × (T3 - T1)其中,C1和C2分别为试样和试剂的比热容。
通过实验测得的数据,我们可以计算出中和反应的热变化,从而了解反应的热力学特性。
如果ΔH为正值,表示反应为吸热反应;如果ΔH为负值,表示反应为放热反应。
四、实验误差分析在实验过程中,可能存在一些误差,例如:1. 温度的测量误差:由于温度计的精度限制或操作不当,测量到的温度值可能存在误差。
2. 试剂的浓度误差:试剂的浓度可能存在一定的误差,从而影响到实验结果的准确性。
3. 热量计的热容误差:热量计的热容可能存在一定的误差,从而影响到实验结果的准确性。
为了减小误差,我们可以采取一些措施,例如:1. 使用精确的温度计,并在测量温度时注意操作的准确性。
2. 仔细配制试剂,尽量减小试剂浓度的误差。
中和热的测定实验报告实验目的,通过实验测定酸碱溶液的中和热,掌握中和反应的热力学知识,加深对热化学的理解。
实验仪器和试剂,量热仪、酸碱溶液(盐酸、氢氧化钠)、热绝缘杯、温度计、计时器。
实验原理,中和反应是指酸和碱在一定条件下发生化学反应,生成盐和水的过程。
中和反应的热量称为中和热,可以通过量热仪测定。
实验步骤:1. 将盐酸和氢氧化钠分别装入两个热绝缘杯中。
2. 将盐酸倒入量热仪中,记录溶液的起始温度。
3. 快速将氢氧化钠溶液倒入盐酸中,开始计时。
4. 观察溶液的温度变化,记录中和反应达到平衡时的最高温度。
5. 根据实验数据计算中和热。
实验数据:盐酸溶液的起始温度,25℃。
中和反应达到平衡时的最高温度,35℃。
盐酸的质量,50g。
氢氧化钠的质量,40g。
实验结果:根据实验数据计算得出中和反应的中和热为Q=mcΔT=(50g+40g)4.18J/g℃(35℃-25℃)=834J。
实验分析:通过实验测定得出中和反应的中和热为834J,表明该中和反应是放热反应。
中和热的大小与反应物的种类、浓度、温度等因素有关,可以通过中和热的测定来研究酸碱溶液的性质和反应特点。
实验总结:本实验通过量热仪测定了酸碱溶液的中和热,掌握了中和反应的热力学知识。
在实验过程中,需要注意操作的精确性和实验数据的准确性,以确保实验结果的可靠性。
通过实验,加深了对中和反应和热化学的理解,为进一步学习相关知识奠定了基础。
实验中遇到的问题和改进建议:在实验过程中,需要注意量热仪的使用方法和操作步骤,以确保实验数据的准确性。
在下次实验中,可以加强对量热仪的操作培训,提高实验操作的熟练度,以提高实验的准确性和可靠性。
结语:通过本次实验,我对中和热的测定有了更深入的了解,实验结果也验证了相关理论知识。
在今后的学习和实验中,我将继续努力,不断提升实验操作技能和科学素养,为更深入地探索热化学领域打下坚实的基础。
实验:中和热(焓)测定在一定温度和浓度下,酸和碱进行中和反应时产生的热效应称为中和热。
对于强酸和强碱,由于它们在水中完全解离,中和反应实质上是H +和OH -的反应。
因此在浓度足够低的条件下,不同的强酸强碱的中和热几乎是相同的。
对于弱酸和强碱进行的中和反应,情况有所不同。
以醋酸的中和反应为例,因为醋酸的解离度很小,故可以认为是HAc 与OH -进行的中和反应。
一 实验目的:1.通过实验了解中和热的概念;2.了解用热量计来直接测定反应热效应的实验方法与操作技能;3.学习用图解法进行数据处理,以求得正确ΔT 的方法;二 实验原理:在25℃时,强酸和强碱进行一个单位中和反应的热化学方程式为:H + + OH - → H 2O ΔγHm0= -57.36KJ·mol -1 (1)在弱酸和强碱进行的反应中,因为中和热ΔγHm 只决定于始终态,而与过程无关,所以将其设计为HAc 的解离反应和H +和OH - 生成H 2O 两步进行:根据盖斯定律,有 △rHm =△rH 解离 + △rH 中和 (2)则 △rH 解离=△rHm —△rH 中和 (3)本实验利用热量计分别测定盐酸和氢氧化钠中和反应的ΔγH 中和以及醋酸和氢氧化钠中和反应的ΔγH 中和,利用(3)式即可求得醋酸的解离热ΔγH 解离。
为此首先利用电热法标定热量计常数K ,对热量计施以电压U (伏)、电流强度I (安培),并通过t (秒)后,使热量计温度升高ΔT (K )。
根据焦尔-楞次定律可知,热量计常数K 为:K = IUT/ ΔT (4) K 的物理意义是热量计升高1K 时所需要的热量。
它是热量计中的水及各部分的热容之和。
等量酸碱的中和热ΔγH 中和及ΔγHm 均由下式计算:ΔγHm = - (K ΔT/cV)×1000 (5)式中c - 酸(或碱)溶液的初始浓度,mol·dm -3;V - 酸(或碱)溶液的体积,ml 。
实验二中和热的测定一目的1 掌握中和热的测定方法2 通过中和热的测定计算弱酸的解离热3 学习贝克曼温度计的使用方法二原理1 一元强酸强碱的中和反应,中和热不随酸碱种类而改变。
热化学方程式可用离子方程式表示(体系中各组分全部电离):H++OH-=H2O △H=-57.36kj/mol2 强碱中和弱酸(HAC)时,HAC解离出H+,进一步与OH-反应,反应式为:CH3COOH=H++CH3COO- △H解离H++OH-=H2O △H中和总反应为:CH3COOH+OH-=H2O △H根据盖斯定律:△H=△H中和+△H解离3弱酸的解离热:△H解离=△H-△H中和三仪器及药品量筒500ml(一只) 50ml(一只)中和热测量装置一套分析天平纯水机浓度各为1mol/l的NaOH,HCl,HAC溶液四操作1 量热计常数的测定(1)准备①量热杯中加入500ml水, 放入磁珠,调整适当的转速。
②传感器插入量热杯中,接通电热丝和夹子,“测试状态”调节“加热功率”为2.5“待机状态”,取下电热丝上的任意夹子③温度稳定后,切换到“测试状态”,仪器队温差自动采零,设定“定时”60s 记录一次温差,蜂鸣(2)加热①记录第十次时,接通电热丝和夹子。
加热开始,记录温度和时间②待温度升高0.8-1℃时,取下电热丝上的夹子。
记录通电时间t③继续搅拌,一次/分,记录十次温度(3)求△T1,作图法求出通电引起的△T1(雷诺校正法确定)2 中和热的测定(1)量热杯中注入400ml水,再加入50ml1mol/l的HCl,取50ml1mol/l的NaOH 溶液注入碱储液管中(2)调节磁珠转速,放入碱管,盖好瓶盖。
记温度(1次/分),10次(3)加入碱液,连续记录温度1次/分(4)温度上升后,温度维持一段时间不变,即可停止(5)作图法求△T23 醋酸解离热的测定用1mol/l的醋酸代替盐酸溶液重复2操作求△T3五数据记录和处理记录P=2.5W △T1△T2△T31 量热计常数的计算K=Pt/△T1量热计每升高1℃时所需的热量J/K 2 中和热的计算△H中和=-K△T2*1000/CV C:mol/l V:ml3 解离热的计算△H=-K△T3*1000/CV△H解离=△H-△H中和六注意事项1 电热丝不能干烧,杯中加水后才能接上电源夹子。
实验三 中和热(焓)的测定一 实验目的1. 通过实验了解中和热的概念;2. 了解用热量计来直接测定反应热效应的实验方法与操作技能;3. 学习用图解法进行数据处理,以求得正确ΔT 的方法;4. 学习使用精密直流稳压电源和精密数字温度温差仪。
二 实验原理在一定温度和浓度下,酸和碱进行中和反应时产生的热效应称为中和热。
对于强酸和强碱,由于它们在水中完全解离,中和反应实质上是1+H和1−OH的反应。
因此在浓度足够低的条件下,不同的强酸强碱的中和热几乎是相同的,例如在25℃时,进行一个单位反应的热化学方程式为: 1−H+ 1−OH→ O H 2 0m r H ∆ = -57.36KJ·mol -1对于弱酸和强碱进行的中和反应,情况有所不同。
以醋酸的中和反应为例,因为醋酸的解离度很小,故可以认为是HAc 与 (3-1)1−OH进行的中和反应。
因为中和热m r H ∆只决定于始终态,而与过程无关,所以将其设计为HAc 的解离反应和1+H 和1−OH生成H 2 O 两步进行:OH mr H 1→ +∆−解离H r ∆中和H r ∆111−−−++OH Ac H根据盖斯定律,有中和解离H H H r r m r ∆+∆=∆ (3-2) 则中和解离H H H r m r r ∆−∆=∆ (3-3)本实验利用热量计分别测定盐酸和氢氧化钠中和反应的中和H r ∆以及醋酸和氢氧化钠中和反应的中和H r ∆,利用(3-3)式即可求得醋酸的解离热解离H r ∆。
为此首先利用电热法标定热量计常数K ,对热量计施以电压U (伏)、电流强度I (安培),并通过t (秒)后,使热量计温度升高ΔT (K )。
根据焦尔-楞次定律可知,热量计常数K 为:TIUTK ∆=(3-4) K 的物理意义是热量计升高1K 时所需要的热量。
它是热量计中的水及各部分的热容之和。
等量酸碱的中和热中和H r ∆及m r H ∆均由下式计算:1000×∆−=∆cVTK H m r (3-5) 式中c - 酸(或碱)溶液的初始浓度,mol·dm -3; V - 酸(或碱)溶液的体积,ml 。
学生实验中和热的测定
实验目的
测定强酸与强碱反应的中和热,加深理解中和反应是放热反应。
实验用品
大烧杯(500 mL)、小烧杯(100 mL)、温度计、量筒(50mL)两个、泡沫塑料或纸条、
泡沫塑料板或硬纸板(中心有两个小孔)、环形玻璃搅拌棒。
mol/L 盐酸、mol/L NaOH溶液①。
实验步骤
1.在大烧杯底垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。
然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬
纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过,以
达到保温、隔热、减少实验过程中热量损失的目的,如图所示。该实验也可在保
温杯中进行。
2.用一个量筒量取L盐酸,倒入小烧杯中,并用温度计测量盐酸的温度,记入
下表。然后把温度计上的酸用水冲洗干净。
3.用另一个量筒量取50mL mol/L NaOH溶液,并用温度计测量NaOH溶液的
温度,记入下表。
4.把温度计和环形玻璃搅拌棒放入小烧杯的盐酸中,并把量筒中的NaOH溶液
一次倒入小烧杯(注意不要洒到外面)。用环形玻璃搅拌棒轻轻搅动溶液,并准确
读取混合溶液的最高温度,记为终止温度,记入下表。
5.重复实验两次,取测量所得数据的平均值作为计算依据。
6.根据实验数据计算中和热。
为了使计算简便一些,我们近似地认为:
(1) mol/L盐酸和LNaOH溶液的密度都是1g/cm3,所以50mL L盐酸的质量
m1=50g,50mL mol/L NaOH溶液的质量m2=50 g。
(2)中和后生成的溶液的比热容c= J/(g·℃),由此可以计算出,50mL mol/L盐
酸与50mL mol/L NaOH溶液发生中和反应时放出的热量为:
(m1+m2)·c·(t2-t1)=(t2-t1) kJ
又因50 mol/L盐酸中含有mol的HCl,mol的HCl与mol NaOH发生中和
反应,生成molH2O,放出的热量是(t2-t1) kJ,所以,生成1molH2O时放出的
热量即中和热为:
问题和讨论
要想提高中和热测定的准确性,实验时应注意什么?
实验说明:
1.作为量热器的仪器装置,其保温隔热的效果一定要好。因此,可以用保温杯
来做,也可用块状聚苯乙烯泡沫塑料制成与小烧杯外径相近的绝热外套来做,以
保证实验时的保温隔热效果。如果按教材中的方法做,一定要使小烧杯杯口与大
烧杯杯口相平,这样可以减少热量损失。
2.盐酸和NaOH溶液浓度的配制须准确,且NaOH溶液的浓度须稍大于盐酸的
浓度。为使测得的中和热更准确,所用盐酸和NaOH溶液的浓度宜小不宜大,
如果浓度偏大,则溶液中阴、阳离子间的相互牵制作用就大,表观电离度就会减
小,这样酸碱中和时产生的热量势必要用去一部分来补偿未电离分子的离解热,
造成较大误差(偏低)。
3.宜用有分刻度的温度计,且测量时应尽可能读准,并估读到小数点后第二位。
温度计的水银球部分要完全浸没在溶液中,而且要稳定一段时间后再读数,以提
高所测温度的精度。
4.实验操作时动作要快,以尽量减少热量的散失。
问题和讨论提示:
可参考上面的“实验说明”,因该“实验说明”谈的都是为提高中和热测定的准
确性而应主意的一些事项。