严重不良事件报告表
- 格式:doc
- 大小:39.54 KB
- 文档页数:2
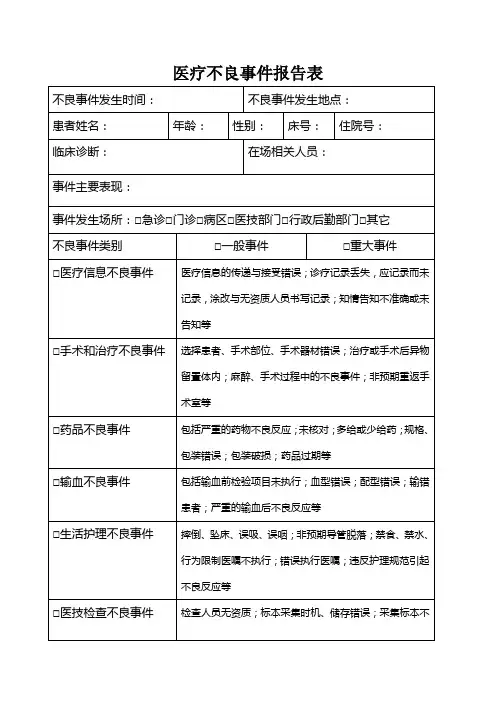
医疗不良事件报告表
1、医疗不良事件(medical adverse event)是指因诊疗活动而非疾病本身造成的损害。
包括诊断治疗的失误及其相关的设施、设备引起的损害等。
不良事件包括可预防的和不可预防的两种。
2、潜在不良事件(potential adverse event)是指由于不经意或是及时的介入行为,而使其原本可能导致的不良事件或情况并未真正发生在病人身上。
3、无伤害:事件发生在病人身上,但是没有造成任何的伤害。
4、轻度伤害:事件虽然造成伤害,但不需或仅需稍微的处理或观察;如捏伤、擦伤、皮肤小撕裂伤。
5、中度伤害:需额外的探视、评估或观察,但仅需要简单的处理;如缝合、夹板固定、冰敷、抽血检查、包扎或止血治疗。
6、重度伤害:除需要额外的探视、评估或观察外,还需住院、延长住院时间或会诊等特别处理。
7、极重度伤害:造成病人永久残障或永久功能障碍。



医疗不良事件报告表医疗不良事件报告表事件编号:XXXXX 报告日期:XXXX年XX月XX日报告人:XXX 职务:XXX事件概述:本次事件发生在我院XX科室,在进行XX手术过程中,患者出现了不良反应。
患者信息:姓名:XXX 性别:XX 年龄:XX岁住院号:XXX 病区:XXX诊断:XXX 手术日期:XXX事件描述:在手术过程中,患者出现了XX症状,表现为XX。
当时医护人员立即停止手术并采取相应的紧急处理措施,包括XX。
经过一段时间的抢救治疗,患者的症状逐渐缓解,并最终稳定。
事件分析:经过初步调查和分析,初步判断本次不良事件是由于XX原因导致的。
可能的原因包括:不良反应,药物过敏等等。
详细分析如下:1. 不良反应经过查阅患者的病历和手术记录,以及相关的医学资料,发现XX手术存在一定的风险和并发症。
患者可能对手术过程中使用的麻醉药物或手术器械等产生不良反应,从而出现了不适症状。
2. 药物过敏患者有过XX过敏史,可能针对某些药物具有过敏反应。
由于手术过程中会使用一些药物(如麻醉药物、镇痛药物等),存在一定的过敏风险。
这可能导致了本次不良事件的发生。
措施及建议:针对本次不良事件,我院将采取以下措施并提出建议:1. 加强医务人员培训和交流通过组织相关的培训和学术交流活动,提高医务人员对于药物过敏和不良反应的认识和识别能力,增强其应对不良事件的处置能力。
2. 完善药物治疗方案和流程在制定手术方案和药物治疗方案时,要充分考虑患者的过敏史和特殊情况,并在手术前进行充分的评估和准备工作。
同时,建立起严格的药物使用流程和记录制度,确保患者用药安全。
3. 加强医患沟通与交流在手术前对患者进行详细询问和检查,了解其过敏史和特殊情况,并耐心解答患者的疑问和顾虑,消除患者的紧张和恐惧情绪,促进医患关系的良好发展。
4. 强化质量管理和监督检查加强对医务人员的质量管理和监督检查,发现和纠正医疗不良事件,追究相关责任人的责任。
同时,加强对医疗设备和耗材的管理,确保其安全可靠。



附:医疗安全(不良)事件报告表报告人:医师 技师 护士 其他报告人签名:联系地址: 联系电话:备注:1.不良事件定义(medical adverse event)是指在临床诊疗活动中以及医院运行过程中,任何可能影响病人的诊疗结果、增加病人的痛苦和负担并可能引发医疗纠纷或医疗事故,以及影响医疗工作的正常运行和医务人员人身安全的因素和事件。
不良事件包括可预防的和不可预防的两种。
2.报告范围:凡在医院内发生的或在院外转运病人时发生的不良事件均属主动报告的范围。
3.Ⅰ级事件(警告事件):非预期的死亡,或是非疾病自然进展过程中造成永久性功能丧失。
4.Ⅱ级事件(不良后果事件):在疾病医疗过程中是因诊疗活动而非疾病本身造成的病人机体与功能损害。
5.Ⅲ级事件(未造成后果事件):虽然发生的错误事实,但未给病人机体与功能造成任何损害,或有轻微后果而不需任何处理可完全康复。
6.Ⅳ级事件(隐患事件):由于及时发现错误,但未形成事实。
医疗安全(不良)事件报告流程立即通知科主任或护士长书面报告 I 、II 级事件紧急电话上报,节假日夜间报总值班书面补报48小时内报负责部门 各分管部门进行相关不良事件的核实每月对部门不良事件进行汇总分析报医疗质量与安全管理委员会I 级事件立即报医务科医疗质量与安全管理委员会每半年分析总结提交院办公会妥善保存相关物品(药品、器械等),实施相应工作流程、预案、程序,积极采取相关补救措施对相关科室提出整改措施督导整改上报国家有关部门 重大事件上报分管领导发生医疗安全(不良)事件医疗质量安全事件报告制度为提高医疗质量安全事件信息报告的质量和效率,妥善处置医疗质量安全事件,推动医疗质量持续改进,切实保障医疗安全,根据《中华人民共和国执业医师法》、《医疗机构管理条例》和《医疗事故处理条例》等法律、法规和“卫生部关于印发《医疗质量安全事件报告暂行规定》的通知”(卫医管发〔2011〕4号)的要求,制定本制度。

严重不良事件报告表
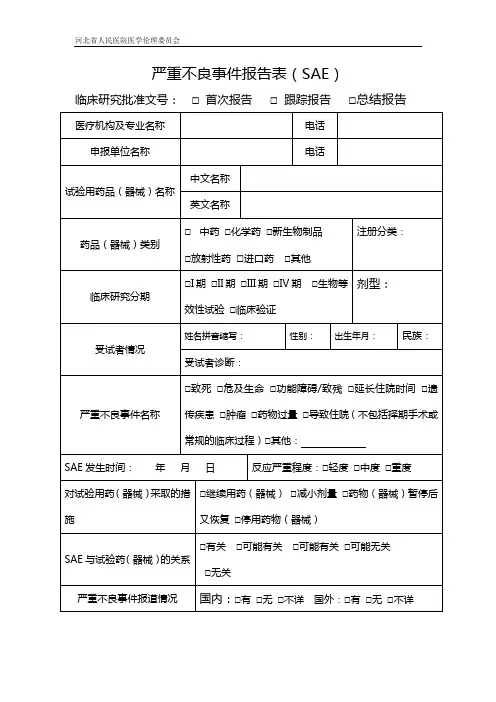
5.对试验药物采取的措施
口继续用药口减小剂量口药物暂停后又恢复口停用药物
6.严重不良事件的转归
口症状消失,无后遗症口症状消失,有后遗症(请说明):
口症状持续,时至口还在接受治疗
口死亡,死亡日期:
7.是否有合并用药和基础疾病(列举严重不良事件发生时的合并用药和基础疾病,包括合并用药的剂量、给药途径和用药的持续时间)
8.严重不良事件是否预期
口该严重不良事件为预期不良事件,已经在获批准的研究方案/知情同意书中说明。
口该严重不良事件为可疑且非预期严重不良反应,没有在获批准的研究方案/知情同意书中说明。
口其他,请说明:
9.破盲情况
口未破盲口已破盲(破盲时间:年月日):
口试验组口对照组
10.已采取措施
是否打算修改方案和/或知情同意书
口否
口是口已经修改方案和/或知情同意书以避免该风险口即将修改方案和/或知情同意书
主要研究者签名:日期:建议审查方式:
口不良事件审查委员初审口紧急会议审查口会议通报
主任/副主任委员签名:日期:。
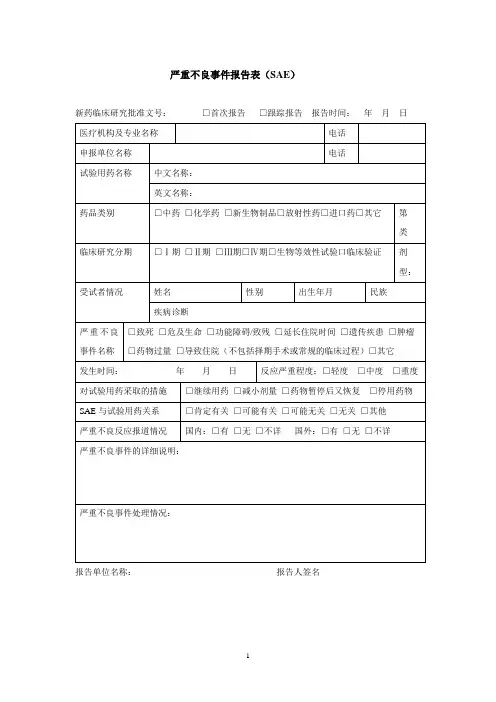
严重不良事件报告表(SAE)新药临床研究批准文号:编号:
报告单位名称:报告人职务/职称:报告人签名:
当本PV-AD form生成文件时,需删除本填表说明
填表说明:
1.在获知SAE的24小时内,严格按照本指导原则完整填写SAE报告表,并经传真发送SAE报告至相关负
责部门;
2.日期格式为:年/月/日;
3.需要修改某处时,请用单横线划去要修改的记录,使原有记录仍可辨认,然后在旁边填写正确记录,
并签署修改者姓名或姓名拼音首字母以及修改日期,不能使用修改液或任何其他的删改方法。
逐项说明
注:1. SAE两页如是电脑打印,必须两页均有研究者签名;
2. 每个项目PA制作IF SAE表格时,可以把本项目以上通用信息添加到SAE表格中。