学案 第一节化学键与化学反应第一课时
- 格式:doc
- 大小:84.00 KB
- 文档页数:4
《化学键与化学反应》(第一课时)教学设计回顾这三个过程中的微观变化【展示】①②③【板书】化学键:相邻原子间的强烈的相互作用。
引导学生注意:①相邻原子(也可以是离子)②强相互作用【投影】思考:①和②哪一个是化学键?均存在着相互作用。
但分子之间的作用力微弱,晶体内离子之间或分子中原子间相互作用强烈观察、分析回答②的相互作用力强,属于化学键为帮助学生从微观角度分析吸收热量的用途,课堂中利用PPT展示物质变化前后的亚微观结构,使得变化过程形象化、直观化。
引导学生结合上述交流研讨内容感受化学键的含义。
学以致用,巩固对化学键的理解新知探究2:化学键探究二:化学键的形成(1)化学键的成因【播放视频】氯气和钠、氢气的反应视频。
【过渡】化合价是元素在化学变化前后表现出来的性质。
由此可见Na、H、Cl原子重新结合成NaCl和HCl的过程应该与原子最外层电子有关,那它们是如何结合的呢?【交流研讨2】观看视频,写出反应方程式。
标出Na、H、Cl三种元素的化合价画出氢原子、氯原提供宏观事实——氯气和钠、氢气能在一定条件下反应生成新的物质,利用反应前后化合价的改变,引导学生深入开展微观本质的探究。
的形成 1.画出H、Cl、Na三种原子的原子结构示意图。
2.H、Cl、Na原子的结构稳定么?什么样的原子结构是稳定的?3.H、Cl、Na原子需要怎样才能达到稳定结构?(2)共价键观念的建立【小组合作】组合稳定的氯化氢分子你实验盒中的红色圆纸片代表氢原子,绿色的圆纸片代表氯原子,图钉代表原子最外层的电子,请你们小组合作组合稳定的氯化氢分子。
【讲解】氢原子最外层有一个电子,我们可以用一个小黑点• (或×)来表示它,化学上称为“电子式”。
氢氯原子在反应中均想得到一个电子间,它们只能通过共用电子的方式达到稳定结构,氢原子和氯原子结合成氯化氢分子过程可以这样表示:这种作用称为共价键。
【思考】如果把氢原子换为氯原子呢?把氯原子换成氧原子呢?还可以换成什么元素的原子呢?【板书】共价键:相邻原子通过共用电子对子和钠原子的原子结构示意图,思考并回答H和Cl原子得到一个电子,氯原子失去一个电子达到相邻稀有气体稳定结构。
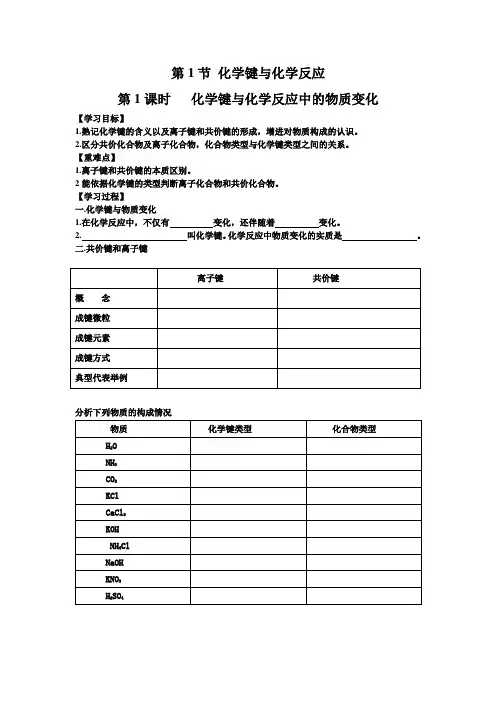
第1节化学键与化学反应第1课时化学键与化学反应中的物质变化【学习目标】1.熟记化学键的含义以及离子键和共价键的形成,增进对物质构成的认识。
2.区分共价化合物及离子化合物,化合物类型与化学键类型之间的关系。
【重难点】1.离子键和共价键的本质区别。
2能依据化学键的类型判断离子化合物和共价化合物。
【学习过程】一.化学键与物质变化1.在化学反应中,不仅有变化,还伴随着变化。
2. 叫化学键。
化学反应中物质变化的实质是。
二.共价键和离子键离子键共价键概念成键微粒成键元素成键方式典型代表举例分析下列物质的构成情况物质化学键类型化合物类型H2ONH3CO2KClCaCl2KOHNH4ClNaOHKNO3H2SO4三.离子化合物与共价化合物离子化合物共价化合物概念粒子间作用熔沸点、硬度较高、较大较低、较小溶解性一般易溶于水部分溶于水导电性熔融或水溶液导电水溶液部分导电实例【当堂小结】【当堂检测】1.下列分子中,所有原子最外层都是8电子结构的是()A.H2B.H2OC.CO2D.CH42. 下列各组物质中,两种物质所含化学键类型不同的是()。
A. H2O和HNO3B. NaCl和NH3C. CaF2和CsClD. Cl2和O23.下列变化过程中,共价键被破坏的是()A.冰变成水B. HCl溶于水得到盐酸C. NaCl溶于水D.溴蒸气被木炭吸附4.下列性质中,可以证明某化合物内一定存在离子键的是( )。
A. 可溶于水B. 具有较高的熔点C. 熔融状态能导电D. 水溶液能导电5.下列物质中:N2、H2O、Na2O2、CaCl2、KOH、NaF、NH4Cl、Na2CO3,只含有共价键的物质是;只含有离子键的物质是;既含有离子键又含有共价键的物质是。
离子化合物是,共价化合物是。
6. (2012年山东省理科综合化学9).下列关于原子结构、元素性质的说法正确的是A.非金属元素组成的化合物中只含共价键B.IA族金属元素是同周期中金属性最强的元素C.同种元素的原子均有相同的质子数和中子数D.ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强。

城东蜊市阳光实验学校化学键与化学反响学习目的:1.通过理解化学键的含义和理解和离子键和一一共价键的形成,增进学生对物质构造的认识;2.通过理解化学反响中物质变化和能量变化的本质,使学生初步学会如何从微观角度认识化学;3.通过对化学键、离子键、一一共价键的学习是同学们的想象力和分析推理才能得到增强;4.通过消费、生活中实例理解化学能与热能的转化,认识提过燃料的利用率,开发高能燃料的重要性,逐步形成可持续开展的思想。
学习过程:第一课时化学键与化学反响中的物质变化【复习回忆】1、化学变化的概念?2、金属元素的原子构造和非金属元素的原子构造的特点是怎样的?【联想、质疑】阅读教材P31的内容,并观察演示实验谁在通电条件下的分解?,考虑教材提出的两个问题。
【阅读学习】阅读教材P32页上边的内容,理解什么叫化学键。
一、化学键与化学反响中的物质变化1:化学键与物质变化化学键的概念化学键【交流研讨】通过观察水电解时发生分解反响生成氢气和氧气的化学键变化的模拟动画,分析下表列出的各种反响中的化学键的变化:[实验演示]水的电解观察并考虑:水分子分解为什么要通电?通常情况下为什么不分解?(1)化学键概念。
[交流与研讨]分析下表列出的各反响中化学键变化情况。
【归纳总结】化学反响中的物质变化的本质【考虑】1、以下变化中,不需要破坏化学键的是〔〕A、氯化氢溶于水B、加热氯酸钾使其分解C、碘升华D、氯化钠溶于水(2、从元素原子得失电子的才能比照角度分别分析水分子、氯化氢分子、和氯化钠固体中化学键是否一样?【阅读学习】阅读教材P33内容,观察一一共价键形成过程的模拟动画,理解氯化氢分子中一一共价键成。
并讨论〔1〕氯原子核氢原子为什么有形成分子的趋势?〔2〕氯化氢分子时怎样形成的?〔3〕为什么氯化氢分子、氢气分子、氯分子、二氧化碳分子、水分子是通过原子间一一共用电子对形成一一共建构成分子的?〔4〕稀有气体能不能形成双原子分子?【总结归纳】2、一一共价键一一共价键:。


第一节化学键与化学反应(第一课时)编制审核:课标导航:1、了解化学键的含义,了解离子键、共价键的形成过程与形成条件。
2、理解并学会从微观角度认识化学反应。
3、了解化学键类型与物质构成的关系。
课前预习案:壱、化学键与化学反应中的物质变化:1、化学键:2、化学反应中物质变化的实质:3、化学键的类型:和等1)共价键定义:如:HCl 的形成过程:见课本33 页2)离子键定义:如NaCl 的形成过程:见课本34 页一般情况下,与间易形成离子键,而间形成共价键。
4、化合物的分类:1)、离子化合物:。
如:Na Cl 、Na2 SO4 、NH4Cl 、CaO 、KOH2)、共价化合物:。
如:HCl 、H2 SO4 、CO2、CH4注意:离子化合物(如NaCl)熔化时要破坏其中的离子键,这需要较多的能量,因此它们的熔点。
氮分子内部存在着很强的共价键,很难被破坏,所以在通常情况下氮气的化学性质很。
课上探究案:[ 思考]以电解水为例,观察水分子是如何分解生成氢气与氧气的?再想想水电解时为什么会消耗能量?1.化学键:注意:①直接相邻②原子为广义原子(包括)③强烈的相互作用④相互作用既包括也包括课本32 页交流研讨:2、化学反应中物质变化的实质:例1、写出HCl 的电离方程式,思考物质的电离是不是一个化学变化?3.化学键的类型1)共价键:a.成键元素:b.成键微粒:c.成键实质:例2 请运用你所学的知识判断下列哪些物质中存在共价键?NaF CH4 H2O CaO H2 MgCl2 O2 CO 22)离子键:a.成键元素:b.成键微粒:c.成键实质:例3 请运用你所学的知识判断下列物质中分别存在哪些类型的化学键?NaF CH4 H2O CaO KBr HF BaCl2 O2 CO 2 MgCl2特别提醒:①金属元素与非金属元素之间也可以形成共价键,如AlCl3、AgI。
②非金属元素之间也可以形成离子键,如铵盐:NH4Cl 中,NH +和Cl-形成的键4为离子键。

第二章《化学键化学反应与能量》第1节《化学键与化学反应》学习目标:1.了解化学键的定义。
2.了解离子键、共价键的形成。
3.了解化学反应中能量转化的原因,能说出常见的能量转化形式。
一.化学键与化学反应中的物质变化1.化学键与物质变化化学键的定义:。
注意:①是直接相邻的原子②是强烈的相互作用练习:完成下列表格化学反应断裂的键形成的键2H2 +O2 ==2H2OH2+Cl2==2HClN2+3H2==2NH3从化学键的角度,化学反应的实质是。
2.化学键的类型氢气和氯气在形成氯化氢的过程中,都有达到稳定结构的趋势,氢稳定的核外电子排布是最外层个电子,氯的稳定结构是最外层个电子。
氯和氢通过的形式都达到稳定结构,氢和氯原子通过形成化学键。
共价键:通过形成的化学键。
钠和氯气在形成氯化钠的过程中,都有达到稳定结构的趋势,钠稳定的核外电子排布是最外层个电子,氯的稳定结构是最外层电子,钠原子失去1个电子变为,达到8电子稳定结构,氯原子得到1个电子变为,达到8电子稳定结构,钠离子和氯离子通过形成化学键。
离子键:之间通过形成的化学键。
离子键共价键概念成键粒子成键实质形成条件举例比较:离子键和共价键的区别和联系练习1:指出构成下列物质的微粒和化学键类型物质形成化学键的微粒化学键类型Cl2NH3NaClMgCl2C a OCO2氢氧化钠氯化铵练习2:(1)在水的三态变化中,H2O 中H—O是否有变化?(2)将氯化钠晶体研成粉末,离子键有什么变化?(3)将HCl、NaCl分别溶于水,化学键有什么变化?3.离子化合物和共价化合物离子化合物:。
如:等;共价化合物:。
如:等。
例题:KOH、NH4Cl 中所含有键,它们分别属于化合物。
总结:(1)当一种化合物中存在时,该化合物是离子化合物;(2)当化合物中只.存在时,该化合物才称为共价化合物。
练习:指出下列化合物属于离子化合物还是共价化合物。
化合物化合物类型硫酸钡二氧化硅NaOH氧化钠C2H5OHH2SO4硫酸钠硝酸铵三氧化硫化学键与物质的性质的关系:氯化钠的熔点较高,是因为。



第1课时化学键与化学反应中的物质变化[学习目标] 1.了解化学键的定义,了解化学反应变化的实质,学会从微观角度认识化学反应。
2.了解共价键和离子键的定义及形成过程,会用电子式表示共价键和离子键的形成过程。
3.明确化学键类型与物质类别之间的关系,学会判断物质中的化学键。
一、化学键与物质变化共价键和离子键[自主学习]1.化学键与物质变化02强相互作用称为化学键。
(1)化学键的概念:□01相邻原子间的□(2)化学反应中物质变化的实质:□03旧化学键断裂和□04新化学键形成。
05共价键、□06离子键等。
(3)化学键的分类:化学键包括□08最外层电子的“·”或“×”组成的式子叫(4)由□07元素符号和用于表示该元素原子□电子式。
2.共价键(以HCl为例)(1)形成过程示意图(2)用电子式表示形成过程:。
(3)概念:□10原子间通过□11共用电子形成的化学键。
(4)构成微粒:□12原子。
(5)成键元素:一般情况下,□13非金属元素原子间形成共价键。
3.离子键(以NaCl为例)(1)形成过程示意图(2)用电子式表示形成过程:□14。
(3)概念:阴、阳离子之间通过□15静电作用形成的化学键。
(4)构成微粒:□16阴离子、阳离子。
(5)成键元素:一般情况下,□17活泼金属元素原子与□18活泼非金属元素原子间易形成离子键。
4.微粒间的相互作用(1)强相互作用⎩⎪⎨⎪⎧离子键共价键金属键配位键(2)弱相互作用:分子间作用力。
1.任何物质内部都存在化学键吗?提示:不一定。
如稀有气体元素的原子都具有稳定的电子层结构,所以稀有气体元素的原子间不存在化学键。
2.有化学键的断裂或形成就一定是化学反应吗?举例说明。
提示:不一定。
化学反应物质变化的实质是旧化学键的断裂和新化学键的形成。
只有化学键的断裂,没有化学键的形成不是化学变化;只有化学键的形成,没有化学键的断裂也不是化学变化。
如NaCl溶于水发生电离:NaCl===Na++Cl-,NaCl中的离子键发生断裂,但没有新化学键的形成,因此不属于化学变化。

化学能与热能第一课时:化学键与化学反应中能量变化的关系【学习目标】1、能从化学键的角度理解化学反应中能量变化的主要原因。
2、能从微观的角度来解释宏观化学现象,进一步发展想象能力。
3、通过化学能与热能的相互转变,理解“能量守恒定律”,初步建立起科学的能量观,加深对化学在解决能源问题中重要作用的认识。
【学习重点】1.化学反应中能量变化的主要原因。
2.从本质上理解化学反应中能量的变化,从而建立起科学的能量变化观。
【学习过程】【学海导航】:煤、石油、天然气的主要化学成分是烃类等有机物(煤中含有大量的碳),他们在燃烧时释放出能量。
你知道这种热量从何而来吗?它与化学物质与其化学反应有什么关系?【温顾知新】:物质中的原子是通过相结合的。
化学反应的实质是:。
【自学】:1、化学键是物质内部微粒之间强烈的相互作用,断开反应物中的化学键需要能量,形成生成物中的化学键要能量。
如:氢气和氯气反应的本质是在一定的条件下,氢气分子和氯气分子中的H-H键和Cl-Cl键断开,氢原子和氯原子通过形成H-Cl键而结合成HCl分子。
断开H-H键、Cl-Cl键要能量,而形成 HCl分子中的H-Cl键能量。
这样,由于破坏旧键的能量少于形成新键的能量,根据“能量守恒定律”,多余的能量就会以热量的形式释放出来。
2、化学键的是物质在化学反应中发生能量变化的主要原因。
例题:拆开1molH2吸热436kJ,拆开1molCl2吸热243kJ,形成1molHCl放热431kJ,试推测氢气和氯气反应生成氯化氢的反应是吸收热量还是放出热量?3、从宏观的角度来判断一个反应到底是放热还是吸热的各种物质中都含有化学键,因而我们可以理解为各种物质中都储存有。
不同物质由于组成、结构不同,因而所包含的化学能也同。
一个确定的化学反应在发生过程中是吸收能量还是放出能量取决于相对大小。
反应物总能量>生成物总能量,反应能量反应物总能量<生成物总能量,反应能量4、反应物、生成物总能量的大小与反应中能量变化的关系示意图。

第一节化学键与化学反应第一课时化学反应与物质变化【学习目标】1>通过了解化学键的含义以及离子键和共价键的形成,增进学生对物质结构的认识;2. 认识共价化合物及离了化合物,化合物类型与化学键类型之间的关系。
3、通过对化学键、离了键、共价键的教学,培养学生的想象力和分析推理能力;教学重点、难点化学键、离子键、共价键的含义和对化学反应的理解。
【学习过程】自主预习1. __________________________________ 在化学反应中,不仅有_________ 变化,还伴随着___________________________________ 变化。
2. __________________________________________________ 叫化学键。
化学反应中物质变化的实质是_________________________________________________ o3. 共价键的定义是。
4. 离子键的定义是。
5. 完成课本32页的衣格。
6. _____________________________________________________ 叫离了化合物。
如I ______ •o7. _____________________________________________________ 叫共价化合物。
如______________________________________________________ 0合作学习自主探究1、化学键与物质变化对化学键的概念的理解及对化学变化实质的理解【注意】(1)(2)【典题解悟】例1.下列关于化学键的敘述止确的是()A、化学键既存在于相邻原子之间,又存在与相邻分了Z间B. 两个原子Z间的相互作用叫化学键c.化学键通常指的是相邻的两个或多个原子Z间的强相互作用D.稀有气体分子Z间存在化学键例2、物质Z间发生化学反应时,一定发生变化的是()A.化学键B.状态C.颜色D.原子核2. 通过对& + CL — 2 HC1反应实质的分析,并根据核外电子排布规律思考: (1)氢原子和氯原子为什么有形成分子的趋势?氯化氢分子是怎样形成的?(2)哪些元素的原子和互结合时一般形成共价键?3.通过对2 Na + CI2止2 NaCl反应实质的分析,并根据核外电子排布规律思考:(1)运用核外电了排布的知识解释,钠原了和氯原了是怎样结合在一起的?(2)哪些元素的原子相互结合一般形成离子键?结论:化学键形成的实质,原子间通过电子的得失或共用电子对,使最外层达到 ______________ 或_________ 的稳定结构。
第一节化学键与化学反应导学案(3学时)【第1课时学习目标】1、认识化学键的含义2、离子键和共价键的形成特点、成键微粒、相互作用力及形成条件。
3、从化学键角度认识化学反应的实质。
【第2课时学习目标】1、巩固第一课时目标,了解电子式2、认识化学键与物质结构关系【第3课时学习目标】认识化学键与化学反应中的能量变化关系,初步学会从微观的角度认识化学反应。
[引子]自学习化学以来,已接触过许多化学反应,而且在分析这些化学反应时,主要是考虑参与反应的物质通过反应生成了什么物质。
其实在化学反应中,不仅有物质变化,还伴随能量变化。
利用化学反应,有时为了制取物质,有时利用释放能量。
第1课时:化学键与化学反应中的物质变化思考:1、有些原子为什么要结合成分子?它们是怎么结合成稳定的分子?2、离子如何结合成稳定化合物?3、物质变化的实质是什么?4、水为什么要电解才分解?一、化学键与物质变化1、化学键世界上的一切物质或原子都有形成稳定结构的趋势,它们或通过得失电子或通过共用电子对的方式来实现。
这种得失电子或共用电子对后所产生的强烈作用力叫化学键。
相邻原子间的强相互作用(力)叫。
如:H-H NaCl HCl[思考]为什么惰性气体都是单原子分子而H2等是双原子分子?2、离子键、共价键根据化学键形成时的成键微粒、作用力等不同将化学键分为(1)、共价键:________ 通过_________形成的化学键。
分析HC1形成过程[思考]:①、以HCl、H2O、H2、CO2等为例说明共价键的成键微粒、作用力特点、形成条件。
②、HCl和H2的共价键有什么区别。
(说明极性键与非极性键)(2)、离子键:_____之间通过_____形成的化学键。
分析NaC1形成过程在HCl、NaCl两物质中微粒间的化学键有何区别?离子键与非极性键可以看成是极性键的两个极端 其它作用力如分子间作用力、氢键等(略) 3、化学反应中物质变化的实质 从组成看: 从化学键看:解释水为什么要电解才分解的原因作业 :1、有化学键断裂的变化一定是化学变化吗?化学变化一定有化学键断裂吗?2、预习下一节内容第2课时:化学键与物质结构4、电子式:在元素符号周围用“〃 ”或“×”来表示原子最外层电子的式子,叫电子式。
第二章第一节化学键与化学反应【教学目标】1.知识技能目标:①了解化学键的含义,认识离子键、共价键的形成过程与形成条件;②了解化学键类型与物质构成的关系,从而更好的认识物质构成和化学反应的本质;③认识共价化合物及离子化合物,化合物类型与化学键类型之间的关系。
2.能力方法目标:结合对化学键、离子键、共价键的教学,从而分析比较、归纳推理能力以及想象能力。
3.情感态度与价值观:通过学习,使学生学会从微观角度认识化学变化的实质,培养学生善于思考,勇于探索的品质。
【课堂互动】一、化学键与物质变化【问题组1】阅读课本32页并讨论:2H2O通电 2H2 + O2①水在发生分解时,通电或高温加热的作用是什么?②为什么水在加热到100℃时只汽化,而在加热到2000℃时才发生分解?水发生的这两个变化属于什么变化?③什么是化学键?水分子分解时,断裂了哪些化学键,形成了哪些化学键?两个水分子之间是否存在化学键?④从化学键的角度看,你认为化学反应中物质变化的实质是什么?【整理归纳1】1、化学键是2、从化学键的角度看,化学反应中物质变化的实质是【课堂练习1】二、共价键与离子键【问题组2】1.画出H 、Cl、的原子结构示意图2.通过对H2 + Cl2 2 HCl反应实质的分析,并根据核外电子排布规律思考:(1)氢原子和氯原子为什么有形成分子的趋势?(2)氯化氢分子是怎样形成的?3.通过分析, HCl中存在什么微粒?微粒间强相互作用是什么?4. 通过以上分析,你认为哪些元素的原子之间可能形成共价键?【整理归纳1】共价键的定义成键微粒成键原因成键元素【课堂练习】1.关于化学键的下列叙述中,正确的是()①化学键只存在于分子之间②化学键是相邻原子之间强烈的相互作用③化学键是一种静电作用④化学键是相邻分之之间强烈的相互吸引A.①③ B.②③ C.②④ D.①④2.下列变化过程中,共价键被破坏的是()A.冰变成水B.氯化氢气体溶于水C.乙醇溶于水D.溴蒸气被木炭吸附3.判断物质中所含化学键的类型 H2、 KCl、 H2O、 NH3、 N2 、MgF2 、Na2O其中存在共价键的是:【问题组3】1.画出Na、Cl的原子结构示意图2.通过对2 Na + Cl2点燃 2 NaCl 反应实质的分析,并根据核外电子排布规律思考:钠原子和氯原子是怎样结合在一起的?3.通过分析, NaCl中存在什么微粒?微粒间强相互作用是什么?4.通过以上分析,你认为哪些元素的原子之间可能形成离子键?【整理归纳2】离子键的定义成键微粒成键原因成键元素【拓展探究】从Na、H、O原子角度分析NaOH中存在哪些化学键?【课堂练习】下列物质中:O 2、H2S、Na2SO4、CaCl2、KOH、NaF,只含有共价键的物质是;只含有离子键的物质是;既含有离子键又含有共价键的物质是三.共价键、离子键、共价化合物、离子化合物之间的关系。
必修2 第2章 第1节 第一课时 化学键与化学反应中的物质变化【学习目标】1、认识化学键的含义以及离子键和共价键的形成,增进对物质构成的认识。
2、化合物类型与化学键类型之间的关系。
3、能准确判断离子化合物和共价化合物。
【重点难点】 离子键、共价键的形成及判断;共价化合物和离子化合物的判断。
【知识回顾】 一、化学键与物质变化化学键定义: 。
【注意】1、必须是相邻的原子间。
“相邻”指原子直接相邻,不指非直接相邻;“原子”是广义的原子,它不仅指H 、O 、S 、Cl 等中性原子,还包括Na+、Cl -、OH -、NH 4+、SO 42-等阴、阳离子。
2、“相互作用”不能只理解为相互吸引或相互排斥,它既包含相互吸引,也包含相互排斥,是相互吸引和相互排斥的平衡。
3、相邻原子之间的相互作用有强弱之分,化学键是一种强相互作用,原子之间较弱的相互作用不是化学键。
4、绝大多数物质内均含有化学键,但稀有气体分子内无化学键。
因稀有气体分子是单原子分子,无论是固态的、液态的还是气态的氦气中都不存在化学键。
练习:完成下列表格2由上表可知:化学反应的实质: 。
【注意】有旧化学键断裂的过程并非一定是化学反应,如HCl 溶于水,只有旧化学键的断裂而无新化学键的形成,属于物理变化。
二、化学键的类型:(一)1、共价键:_______间通过 _______________形成的化学键。
如:HCl 的形成过程2、共价键的类型:按共用电子对是否发生偏移,可将共价键分为非极性共价键(简称非极性键)和极性共价键(简称极性键)两种。
①非极性共价键:在单质分子中同种原子形成的共价键,两个原子对共用电子对的吸引能力相同;共用电子对不偏向于任何一个原子,成键原子不显电性。
这样的共价键叫非极性共价键。
如H 2 、Cl 2中的化学键。
②极性共价键:在共价键形成的化合物分子中,由于不同原子对共用电子对的吸引能力不同,共用电子对会偏向于吸引电子能力强的一方,因此吸引电子能力强的原子带部分负电荷,吸引电子能力较弱的一方带部分正电荷,这样的共价键叫极性共价键。