《配合物的形成》
- 格式:ppt
- 大小:1.83 MB
- 文档页数:42


《简单配合物的形成》知识清单一、配合物的定义配合物是由中心原子(或离子)和围绕它的配位体(分子或离子)通过配位键结合而成的复杂离子或分子。
中心原子通常是金属离子或原子,具有空的价电子轨道,可以接受配位体提供的孤对电子。
配位体则是含有孤对电子的分子或离子,能够与中心原子形成配位键。
例如,在 Cu(NH₃)₄²⁺中,Cu²⁺是中心原子,NH₃是配位体。
二、配合物的形成条件1、中心原子(或离子)中心原子(或离子)通常具有空的价电子轨道,能够接受配位体提供的孤对电子。
常见的中心原子包括过渡金属元素的离子,如 Cu²⁺、Fe³⁺、Ni²⁺等。
2、配位体配位体应含有孤对电子,能够与中心原子形成配位键。
常见的配位体有:阴离子,如 Cl⁻、CN⁻等。
中性分子,如 NH₃、H₂O 等。
3、形成配位键配位键是一种特殊的共价键,由配位体提供孤对电子,中心原子提供空轨道形成。
三、配合物的组成配合物通常由内界和外界两部分组成。
内界是由中心原子和配位体通过配位键结合形成的,在化学式中用方括号括起来,如 Cu(NH₃)₄²⁺中的 Cu(NH₃)₄²⁺就是内界。
外界是内界以外的部分,通常是简单离子,如 Cu(NH₃)₄SO₄中的 SO₄²⁻就是外界。
中心原子:位于配合物的中心位置,决定了配合物的性质。
配位体:与中心原子结合的分子或离子。
配位原子:配位体中直接与中心原子形成配位键的原子。
配位数:中心原子周围配位原子的数目。
四、配合物的命名配合物的命名遵循一定的规则:1、内界命名配位体的名称在前,中心原子的名称在后。
不同配位体之间用“·”隔开。
配位体的个数用中文数字表示。
2、外界命名外界离子的命名与一般无机物的命名相同。
例如,Cu(NH₃)₄SO₄命名为硫酸四氨合铜(Ⅱ)。
五、配合物的稳定性配合物的稳定性取决于多种因素:1、中心原子和配位体的性质中心原子的电荷越高、半径越小,形成的配合物越稳定。

专题4分子空间结构与物质性质第二单元配合物的形成和应用课前预习问题导入CH4中的C原子和NH3中的N原子同样是发生sp3杂化,为什么两者的分子空间构型不同?答:在形成氨分子时,氮原子中的原子轨道也发生了sp3杂化,生成四个sp3杂化轨道,但所生成的四个sp3杂化轨道中,只有三个轨道各含有一个未成对电子,可分别与一个氢原子的1s电子形成一个σ键,另一个sp3杂化轨道中已有两个电子,属于孤对电子,不能再与氢原子形成σ键了。
所以,一个氮原子只能与三个氢原子结合,形成氨分子。
因为氮原子的原子轨道发生的是sp3杂化,所以四个sp3杂化轨道在空间的分布与正四面体相似。
又因四个sp3杂化轨道中的一个轨道已有一对电子,只有另外三个轨道中的未成对电子可以与氢原子的1s电子配对成键,所以形成的氨分子的立体构型与sp3杂化轨道的空间分布不同,氨分子的构型为三角锥形。
由于氨分子中存在着未成键的孤对电子,它对成键电子对的排斥作用较强,所以使三个N—H键的空间分布发生一点变化。
知识预览1.配位键(1)用电子式表示NH+的形成过程__________。
4(2)配位键:共用电子对由一个原子单方向提供而跟另一个原子共用的共价键叫配位键。
配位键可用A→B形式表示,A是提供孤对电子的原子,叫做电子对给予体,B是接受电子的原子叫接受体。
(3)形成配位键的条件形成配位键的条件是有能够提供__________的原子,且另一原子具有能够接受__________的空轨道。
常用的表示符号为__________。
2.配位化合物(1)写出向CuSO4溶液中滴加氨水,得到深蓝色溶液整个过程的反应离子方程式。
____________________________________________________________________;___________________________________________________________________。

《配合物的形成和应用》讲义一、配合物的基本概念在化学的世界里,配合物是一类非常重要的物质。
那什么是配合物呢?简单来说,配合物是由中心原子(或离子)和围绕它的若干个分子或离子(称为配位体)通过配位键结合而形成的复杂离子或分子。
中心原子通常是金属离子,它们具有空的价电子轨道,能够接受配位体提供的孤对电子。
而配位体则是含有孤对电子的分子或离子,比如氨分子(NH₃)、水分子(H₂O)、氯离子(Cl⁻)等。
配位键是一种特殊的共价键,它是由配位体提供孤对电子进入中心原子的空轨道而形成的。
这种键的形成使得配合物具有独特的结构和性质。
二、配合物的形成过程让我们以常见的铜氨配合物 Cu(NH₃)₄²⁺为例,来看看配合物的形成过程。
首先,铜离子(Cu²⁺)在水溶液中以水合离子 Cu(H₂O)₄²⁺的形式存在。
当向溶液中加入氨时,氨分子中的氮原子上有一对孤对电子,能够与铜离子的空轨道相互作用。
氨分子逐渐取代水合离子中的水分子,与铜离子形成配位键,最终形成稳定的Cu(NH₃)₄²⁺配合离子。
这个过程是一个动态平衡的过程,受到溶液的浓度、温度等因素的影响。
在配合物的形成过程中,中心原子的电子构型会发生变化,从而影响其化学性质。
同时,配位体的种类和数量也会决定配合物的性质和结构。
三、配合物的结构配合物的结构可以分为内界和外界两部分。
内界是由中心原子和配位体组成的核心部分,它通常以方括号括起来,比如 Cu(NH₃)₄²⁺中的 Cu(NH₃)₄²⁺就是内界。
内界中的中心原子和配位体通过配位键紧密结合,具有相对稳定的结构。
外界则是位于方括号外面的离子,它们与内界通过离子键相结合。
例如,在 Cu(NH₃)₄SO₄中,SO₄²⁻就是外界。
配合物的空间结构也是多种多样的,常见的有直线型、平面三角形、四面体、八面体等。
配合物的空间结构取决于中心原子的价电子构型和配位体的种类及数量。


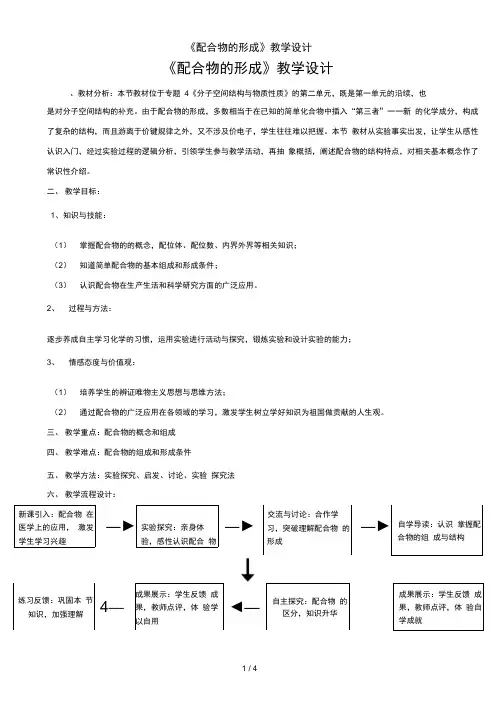
《配合物的形成》教学设计、教材分析:本节教材位于专题4《分子空间结构与物质性质》的第二单元,既是第一单元的沿续,也是对分子空间结构的补充。
由于配合物的形成,多数相当于在已知的简单化合物中插入“第三者”一一新的化学成分,构成了复杂的结构,而且游离于价键规律之外,又不涉及价电子,学生往往难以把握。
本节教材从实验事实出发,让学生从感性认识入门,经过实验过程的逻辑分析,引领学生参与教学活动,再抽象概括,阐述配合物的结构特点,对相关基本概念作了常识性介绍。
二、教学目标:1、知识与技能:(1)掌握配合物的的概念,配位体、配位数、内界外界等相关知识;(2)知道简单配合物的基本组成和形成条件;(3)认识配合物在生产生活和科学研究方面的广泛应用。
2、过程与方法:逐步养成自主学习化学的习惯,运用实验进行活动与探究,锻炼实验和设计实验的能力;3、情感态度与价值观:(1)培养学生的辨证唯物主义思想与思维方法;(2)通过配合物的广泛应用在各领域的学习,激发学生树立学好知识为祖国做贡献的人生观。
三、教学重点:配合物的概念和组成四、教学难点:配合物的组成和形成条件五、教学方法:实验探究、启发、讨论、实验探究法六、教学流程设计:1. 完成表格2. 往[Co(NH3)4Cl2]CI 和[Co(NH 3)4Cl2]NO3溶液中分别加入AgNO3溶液,一个有沉淀产生,另一个没有沉淀产生,能产生沉淀的是,没有沉淀产生的是。
【问题解决】3. 现有两种配合物晶体[Co(NH 3)6]CI 3和[CO(NH 3)5CI]CI 2, 一种为橙黄色,另一种为紫红色。
请设计实验方案将这两种配合物区别开来。
【练一练】某物质的实验式PtCl4 2NH3,其水溶液不导电,加入AgNO3也不产生沉淀,以强碱处理并没有NH3放出,试推测其化学式。
指出其中心原子,配位体及配位数。
学生首先写出这两种配合物的电离方程式:[Co(NH 3)6]CI 3=[Co(NH 3)6]3++3 CI-[Co(NH 3)5CI]CI 2=[Co(NH 3)5CI]2++2 CI-然后比较两者得出结论:要区别这两种配合物应从水溶液中CI-的量来考虑。

《配合物的形成和应用》学习任务单一、学习目标1、理解配合物的基本概念,包括配位键、中心离子、配体等。
2、掌握配合物的形成条件和形成过程。
3、了解常见配合物的结构和性质。
4、认识配合物在生产、生活和科学研究中的广泛应用。
二、学习重点1、配位键的形成和特点。
2、配合物的稳定性及其影响因素。
3、配合物在生物、医药、材料等领域的应用实例。
三、学习难点1、配合物的空间结构和配位键的方向性。
2、解释配合物的颜色变化与结构的关系。
四、学习方法1、理论学习:通过教材、网络资源等,系统学习配合物的相关知识。
2、实验探究:参与相关实验,观察配合物的形成和性质变化。
3、案例分析:研究实际应用中的配合物案例,加深对其作用和价值的理解。
五、学习过程(一)知识回顾1、化学键的类型,如离子键、共价键等。
2、物质的结构和性质的关系。
(二)配合物的概念1、配位键定义:一方提供孤电子对,另一方提供空轨道而形成的化学键。
形成条件:具有孤电子对的原子或离子与具有空轨道的原子或离子。
特点:具有方向性和饱和性。
2、中心离子(原子)定义:在配合物中接受孤电子对的离子或原子。
常见的中心离子:过渡金属离子,如 Fe2+、Cu2+等。
3、配体定义:提供孤电子对的分子或离子。
常见的配体:NH3、H2O、Cl等。
4、配位数定义:直接与中心离子(原子)结合的配体的数目。
(三)配合物的形成1、形成过程以Cu(NH3)42+为例,Cu2+具有空轨道,NH3 分子中的 N 原子有孤电子对,N 原子的孤电子对进入 Cu2+的空轨道,形成配位键,从而形成配合物Cu(NH3)42+。
2、形成条件中心离子(原子)具有空轨道。
配体具有孤电子对。
外界条件,如一定的温度、浓度等。
(四)配合物的结构1、简单配合物的结构直线型:如Ag(NH3)2+。
平面三角形:如Cu(CN)32-。
正四面体:如Zn(NH3)42+。
2、复杂配合物的结构介绍一些具有多核中心或多配体的复杂配合物结构。

配合物的形成和应用[学习目标]1.理解配合物的概念、组成;2.掌握常见配合物的空间构型及其成因;3.掌握配合物的性质特点及应用。
[学习重、难点]配合物的空间构型、配合物的应用[课时安排]3课时[学习过程][活动及探究]:实验1:向试管中加入2mL5%的硫酸铜溶液,再逐滴加入浓氨水,振荡,观察。
现象:原理:(用离子方程式表示)实验2:取5%的氯化铜、硝酸铜进行如上实验,观察现象并分析原理。
[交流讨论] Cu2+及4 个NH3分子是如何结合生成[Cu(NH3)4]2+的?⑴ 用结构式表示出NH3及H+反应生成NH4+的过程:⑵ 试写出[Cu(NH3)4]2+的结构式:一、配位键、配合物:1、配位键:配位键是一种特殊的共价键。
成键的两个原子间的共用电子对是由一个原子单独提供的。
2、形成条件:形成配位键的条件是其中一个原子有孤电子对,另一个原子有接受孤电子对的“空轨道”。
配位键用A→B表示,A是提供孤电子对的原子,B是接受孤电子对的原子。
3、配合物:通常把金属离子或原子(称为中心原子)及某些分子或离子(称为配位体)以配位键结合形成的化合物称为配合物。
4、常见配位键的形成过程(1) NH4+ 、H3O+中配位键的形成注意:结构式中“→”表示配位键及其共用电子对的提供方式。
(2)配离子[Ag(NH3)2]+中配位键的形成在[Ag(NH3)2]+里,NH3分子中的氮原子给出孤电子对,Ag+接受电子对,以配位键形成了[Ag(NH3)2]+:[ H3N→Ag←NH3] +(3)配离子[Cu(NH3)4]2+的形成在[Cu(NH3)4]2+里,NH3分子中的氮原子给出孤电子对,Cu2+接受电子对,以配位键形成了二、配合物的组成配合物的组成包含中心原子/离子、配体和配位原子、配位数,内界和外界等。
以[Cu(NH3)4]SO4为例说明,如右图所示:配合物的内界和外界之间多以离子键结合,因而属于离子化合物、强电解质,能完全电离成内界离子和外界离子,内界离子也能电离但程度非常小,可谓“强中有弱”。
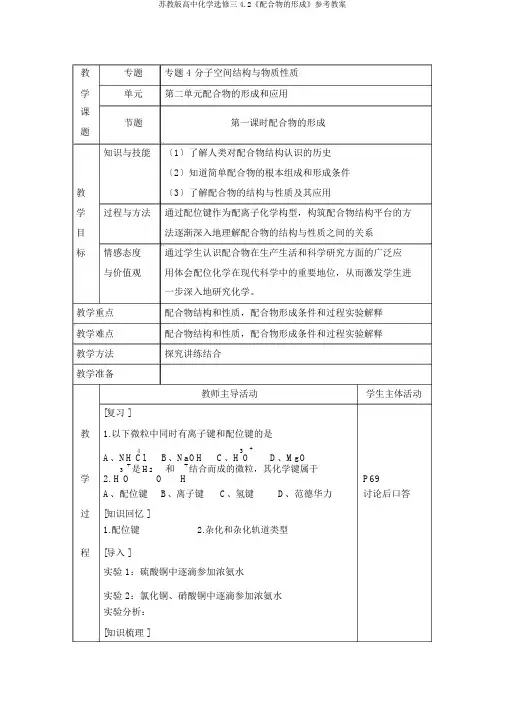
教专题专题 4 分子空间结构与物质性质学单元第二单元配合物的形成和应用课节题第一课时配合物的形成题知识与技能〔1〕了解人类对配合物结构认识的历史〔2〕知道简单配合物的根本组成和形成条件教〔3〕了解配合物的结构与性质及其应用学过程与方法通过配位键作为配离子化学构型,构筑配合物结构平台的方目法逐渐深入地理解配合物的结构与性质之间的关系标情感态度通过学生认识配合物在生产生活和科学研究方面的广泛应与价值观用体会配位化学在现代科学中的重要地位,从而激发学生进一步深入地研究化学。
教学重点配合物结构和性质,配合物形成条件和过程实验解释教学难点配合物结构和性质,配合物形成条件和过程实验解释教学方法探究讲练结合教学准备教师主导活动学生主体活动[复习 ]教 1.以下微粒中同时有离子键和配位键的是4B、NaOH 3+D、MgOA、NH Cl C、H O学3+是H2O和+结合而成的微粒,其化学键属于P692. H O HA、配位键B、离子键C、氢键D、范德华力讨论后口答过[知识回忆 ]1.配位键2.杂化和杂化轨道类型程[导入 ]实验 1:硫酸铜中逐滴参加浓氨水实验 2:氯化铜、硝酸铜中逐滴参加浓氨水实验分析:[知识梳理 ]一、配合物的形成1、配合物: 由提供孤 子 的配体与接受孤 子 的中 察心原子以配位 合形成的化合物称 配位化合物 称 配合物。
理解 教 主 活 学生主体活2、配合物的 成从溶液中析出配合物 , 配离子 常与 有相反 荷的其他离子合成 , 称 配 。
配 的 成可以划分 内界和外界。
配离子属于内界, 配离子以外的其他离子属于外界。
内、外界之 以离子 合。
外界离子所 荷 数等于配离子的 荷数。
〔1〕中心原子:通常是 渡金属元素〔离子和原子〕 ,少数是非金属元素,例如: Cu 2+,Ag +,Fe 3+,Fe ,Ni ,B Ⅲ,P Ⅴ⋯⋯〔2〕配位体: 含孤 子 的分子和离子。
如:- ,OH -, CN -,H 2 ,3 , CO ⋯⋯ I O NH配位原子: 配位体中具有孤 子 的原子。

实验3 配合物的形成和性质实验目的:了解有关配合物的生成,配离子和简单离子的区别。
熟悉配位平衡与沉淀法应、氧化还原法应和溶液酸度的关系;了解螯合物的形成。
实验用品仪器:试管、白瓷板、滴管。
材料:PH 试纸、红色石蕊试纸。
液体药品:H 2SO 4(1:1) 、H 2S(0.1M)、 H 2C 2O 4(0.1M) 、NaOH(2M 、0.1M)、 氨水(6M 、2M 、0.1M)、CuSO 4(1M)、HgCl 2(0.1M)、KI(0.1M)、NiSO 4(0.2M)、BaCl 2(0.1M)、FeCl 3(0.5、0.1M)、KSCN(0.1M)、KBr(0.1M)、K 3[Fe(CN)6] (0.1M) 、AgNO 3(0.1M)、NaCl(0.1M)、Na 2S 2O 3 (0.1M)、SnCl 2(0.1M)、NH 4F(4M)、FeSO 4(0.1M)、EDTA (0.1M )、邻菲罗啉(0.25%)、二乙酰二肟(1%)、无水酒精。
实验内容一、配离子的生成和配合物的组成1、在试管中加入 1mL 1M CuSO 4 溶液,在逐滴滴入 2M 氨水,观察有无沉淀生成。
继续注入过量氨水,观察有无变化?写出化学反应式。
取出1mL 溶液注入另一试管,往其中注入1mL 无水酒精又有什么现象?解释这种现象。
CuSO 4 3NH −−−→ Cu 2(OH)2 SO 4↓3NH −−−→ [Cu(NH 3)4]2+ + SO 24-无水酒精出现蓝色结晶体[Cu(NH 3)4] SO 4 ,[Cu(NH 3)4] SO 4在乙醇中溶解度小。
2、在试管中滴几滴0.1M HgCl 2溶液(极毒!)使用时注意安全,实验后废液不要倒入下水道,回收)逐滴滴入0.1M KI 溶液,观察红色沉淀的生成,再继续滴入少量KI 溶液,观察沉淀的溶解,化学反应式如下。
HgCl 2 KI −−→ HgI 2 ↓(桔色) KI −−→ HgI 24-(无色溶液) 3、在两支试管中各注入1mL 0.2M NiSO 4溶液,然后在这两试管中分别注入少量0.1M BaCI 2溶液和0.1M NaOH 溶液,观察现象,化学反应式如下。
简单配合物的生成
勒篇文章咱们来摆一摆简单配合物是啷个生成嘞。
在化学里头,配合物这个东西挺有意思,它就好像是耍朋友一样,要得就是两个或多个东西互相看得上眼,愿意凑一堆儿。
咱们说的简单配合物,就好比是小年轻谈个简单恋爱,没得啥子复杂嘞纠葛。
要生成简单配合物,首先得有个中心原子,它就好像是那个小伙子,长得标标致致嘞,等着姑娘来瞧。
然后呢,还得有些配体,这些配体就好像是那些小姑娘,各有各嘞好,有的温柔,有的活泼。
当中心原子遇上配体,要是互相觉得合适,那就能牵起手来,形成一个配合物。
这个过程就好像是两个人看对眼了,决定要在一起。
配合物里头,中心原子和配体之间是通过配位键连起来嘞,这个配位键就好像是他们嘞定情信物,把两个人紧紧嘞绑在一起。
生成配合物嘞条件也不复杂,只要中心原子有空嘞轨道,配体有孤对电子,他们就能通过配位键结合在一起。
这就好像是小伙子有空嘞心房,姑娘有满满嘞爱意,两个人一靠近,自然就擦出了火花。
所以嘞,简单配合物嘞生成,说到底就是中心原子和配体互相吸引,愿意凑一堆儿,通过配位键形成一个新嘞整体。
这个过程既简单又奇妙,真是让人不得不感叹化学嘞魅力。
配合物的生成和性质实验报告配合物的生成和性质实验报告引言:配合物是由中心金属离子与配体之间形成的化合物。
通过配位键的形成,配合物具有独特的结构和性质。
本实验旨在通过合成不同配合物,探究其生成机制和性质。
实验一:合成铁氰化物配合物材料与方法:1. 氰化钠(NaCN)溶液2. 氯化铁(III)溶液3. 乙醇溶液4. 氢氧化钠(NaOH)溶液5. 过滤纸6. 玻璃棒步骤:1. 取一定量的氰化钠溶液,加入氯化铁(III)溶液中。
2. 搅拌溶液,观察颜色变化。
3. 加入乙醇溶液,继续搅拌。
4. 加入氢氧化钠溶液,观察颜色变化。
5. 过滤得到沉淀。
结果与讨论:实验过程中,我们观察到溶液由无色逐渐变为深蓝色,并最终生成了蓝色的沉淀。
这表明我们成功合成了铁氰化物配合物。
实验二:配合物的溶解性实验材料与方法:1. 合成的铁氰化物配合物2. 氯化铵(NH4Cl)溶液3. 硝酸银(AgNO3)溶液4. 玻璃棒步骤:1. 取一定量的铁氰化物配合物溶液。
2. 分别加入氯化铵溶液和硝酸银溶液。
3. 观察颜色变化和沉淀的生成情况。
结果与讨论:我们发现,加入氯化铵溶液后,配合物的颜色变浅,说明配合物发生了溶解。
而加入硝酸银溶液后,观察到白色沉淀的生成。
这表明铁氰化物配合物可以与氯化铵发生配位置换反应,但无法与硝酸银发生反应。
实验三:配合物的热稳定性实验材料与方法:1. 合成的铁氰化物配合物2. 火焰步骤:1. 将铁氰化物配合物放置在火焰上方。
2. 观察颜色变化和物质的行为。
结果与讨论:我们观察到,铁氰化物配合物在火焰下发生分解,产生橙色火焰。
这表明配合物在高温下不稳定,容易分解。
结论:通过本实验,我们成功合成了铁氰化物配合物,并探究了其性质。
我们发现铁氰化物配合物具有一定的溶解性和热稳定性。
这些实验结果对于进一步研究配合物的生成机制和性质具有重要的参考价值。
附录:实验中所用的化学品均需在实验室中按照安全操作规程进行操作。