水质铝测定实验报告
- 格式:doc
- 大小:11.53 KB
- 文档页数:3

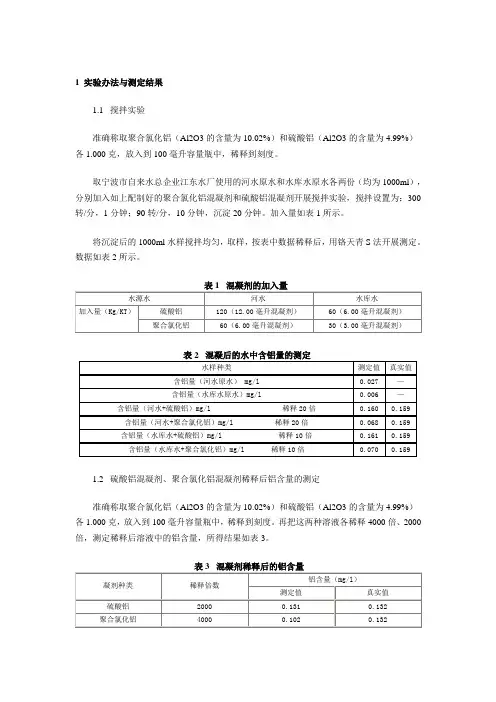
1 实验办法与测定结果1.1 搅拌实验准确称取聚合氯化铝(Al2O3的含量为10.02%)和硫酸铝(Al2O3的含量为4.99%)各1.000克,放入到100毫升容量瓶中,稀释到刻度。
取宁波市自来水总企业江东水厂使用的河水原水和水库水原水各两份(均为1000ml),分别加入如上配制好的聚合氯化铝混凝剂和硫酸铝混凝剂开展搅拌实验,搅拌设置为:300转/分,1分钟;90转/分,10分钟,沉淀20分钟。
加入量如表1所示。
将沉淀后的1000ml水样搅拌均匀,取样,按表中数据稀释后,用铬天青S法开展测定。
数据如表2所示。
1.2 硫酸铝混凝剂、聚合氯化铝混凝剂稀释后铝含量的测定准确称取聚合氯化铝(Al2O3的含量为10.02%)和硫酸铝(Al2O3的含量为4.99%)各1.000克,放入到100毫升容量瓶中,稀释到刻度。
再把这两种溶液各稀释4000倍、2000倍,测定稀释后溶液中的铝含量,所得结果如表3。
1.3 改进铬天青S法(一)实验实验办法和顺序同1.1,只是先将样品倒入一干净烧杯中,将pH调节到3前后,再用碱液(10%氢氧化钠溶液)将pH调节到7前后,或者先用碱液(10%氢氧化钠溶液)将pH 调节到11前后,再用酸液(1+1盐酸)将pH调节到7前后,调节时的pH测定用pH试纸即可。
然后取样,再按照铬天青S法开展测定。
混凝剂为聚合氯化铝、硫酸铝,加入量分别为30Kg/KT、60Kg/KT,测定数据如表3.水库原水含铝量:0.014 mg/L。
1.4 改进铬天青S法(二)实验实验办法和顺序同1.1,但样品先开展前处理,办法为:取一定量的试样,用盐酸溶液将pH调整到1以下,将试样加热近沸,用氢氧化钠溶液将试样pH调整到7前后,再按照铬天青S法开展测定。
测定数据如表5,实验中所用原水为水库水,所用混凝剂为聚合氯化铝,加入量为30 Kg/KT。
1.5 用铬天青S法和改进铬天青S法对水厂滤后水的测定结果在使用硫酸铝混凝剂和聚合氯化铝混凝剂的水厂各取滤后水水样一个,在不加酸不加碱、先加酸(到pH为3)后加碱(到pH为7)、先加碱(到pH为11)后加酸(到pH为7)、先加酸(到pH<1=后加热近沸再加碱(到pH为7)的前处理条件下测定水样中的铝含量,测定数据如表6所示。


一、测定方法铬天青S分光光度法二、方法依据《生活饮用水卫生规范》(2001)三、测定范围1. 适用于测定生活饮用水及其水源水中铝的含量。
2. 最低检测质量为0.20μg,若取25mL水样,则最低检测质量浓度为0.008mg/L,适宜的测定范围为0.008---0.200mg/L。
3. 水中铜、锰及铁干扰测定。
1mL抗坏血酸(100g/L)可消除25μg铜,30μg锰的干扰,2 mL 硫代乙醇酸可消除25μg铁的干扰。
四、测定原理在pH6.7---7.0范围内,铝在聚乙二醇辛基苯醚(OP)和溴代十六烷基吡啶(CPB)的存在下,与铬天青S反应生成蓝色的四元混合胶束,比色定量。
五、试剂1. 铬天青S溶液(1g/L):称取0.1g铬天青S(C23H13O9SC l2Na3)溶于100mL乙醇溶液(1 1)中,混匀。
2. 乳化剂OP滴液(3 100):吸取3.0mL乳化剂OP溶于100mL纯水中.3. CPB溶液(3g/L):称取3.0克CPB(C21H36BrN)溶于150mL乙醇(95%)中,加水稀释至1000mL。
4. 乙二胺---盐酸缓冲液(pH6.7----7.0)。
取无水乙二胺(C2H8N2)100mL,加纯水200mL,冷却后缓缓加入190mL盐酸(1.19g/mL),搅匀,调pH6.7----7.0,若pH>7,则慢慢滴加盐酸;若pH<6.7,则补加乙二胺溶液(1 2)。
5. 氨水:1 66. 硝酸溶液:0.1mol/L7. 铝标准储备溶液(1mg/mL):称取8.792克硫酸铝钾[KAL(SO4)212H2O],溶于纯水中,定容至500 mL。
8. 铝标准使用溶液(1μg/mL):临用时将标准储备溶液稀释而成。
9. 对硝基酚乙醇溶液(1.0g/L):称取0.1g对硝基酚,溶于100 mL乙醇(95%)中。
六、仪器设备1. 50mL具塞比色管。
2. 722S分光光度计3. pH试纸七、分析步骤1. 取水样25.0 mL于50mL具塞比色管中。

饮用水中铝的紫外分光光度检测研究目的对聊城市东昌府区饮用水进行随机抽检,通过紫外分光光度法测定饮用水中铝含量。
方法于2016年6月对聊城市东昌府区饮用水进行抽检,遵循区域均匀布点的原则进行随机采样,共108份。
其中包水样采集为出厂水16份、末梢水68份二次供水24份。
使用国家标准检验方法GB/T 5750.6-2006 生活饮用水标准检验法金属指标铝:铬天青S分光光度法测定。
结果紫外分光光度法检测结果提示具有良好的线性关系(r=0.999),相对标准偏差 1.31%,标准差0.05),且各水样中铝含量均低于0.2 mg/L。
样本紫外分光检测回收率93.5%~97.5%。
详见表2。
2.4 水样检测合格情况通过抽样检测,末梢水、出厂水、二次供水水样样检测均未出现铝含量超标的水样。
3 讨论铝普遍存在于所有的自然水中,饮用水亦成为人体摄入铝的重要来源,生理状态下,机体吸收的铝经过肾脏可以得到排除,当摄入量增多且且得到及时排出,部分被吸收的铝无法及时排除体外就会蓄积在体内[8]。
严重的蓄积具有严重危害,会影响神经功能,导致老年痴呆、记忆学习能力下降[9-10],也会对成骨细胞的形成产生抑制导致软骨症[11-12],且高剂量的铝具有胚胎发育毒性,严重抑制人胚脑神经细胞和成骨细胞的发育[13]。
近年饮用水质检测指标得到全面完善,检测标准也越来越严格,鉴于铝对人体的严重危害性,有必要对饮用水中铝含量检测提出相应的定量测定和确切评估。
紫外分光光度法通过对样品溶液采用不同波长连续照射获得吸收光谱曲线,通过对相对应的吸收强度进行比对实现物质量的定量计算。
生活饮用水卫生标准规定铝含量<0.2 mg/L为临界值,超过此数值则为不合格。
为了解聊城市东昌府区饮用水铝的情况,于2016年6月对聊城市东昌府区108份饮用水进行随机抽检,其中水样采集为出厂水16份、末梢水68份、二次供水24份。
采用紫外分光光度法对水样进行定量检测予以合格性评估,从结果来看,紫外分光光度法检测结果提示具有良好的线性关系(r=0.999),相对标准偏差1.31%,标准差<5%,检测回收率93.5%~97.5%。

第1篇一、实验目的1. 了解水样中铝的测定原理和方法。
2. 掌握水样中铝的测定操作步骤。
3. 学会运用化学分析方法对水样中铝含量进行测定。
二、实验原理铝是一种常见的金属元素,广泛存在于自然界和人类生活中。
水样中的铝主要来源于土壤、岩石、工业排放等。
铝对人体的健康有一定影响,因此,测定水样中的铝含量具有重要意义。
本实验采用分光光度法测定水样中的铝含量。
其原理是:在一定的pH值下,铝离子与显色剂形成稳定的络合物,该络合物在特定波长下有最大吸收,通过测定其吸光度,即可计算出铝的含量。
三、实验仪器与试剂1. 仪器:分光光度计、电子天平、容量瓶、移液管、锥形瓶、烧杯、滴定管等。
2. 试剂:(1)硝酸:分析纯;(2)氢氧化钠:分析纯;(3)铝标准溶液:1000mg/L;(4)显色剂:分析纯;(5)其他试剂:无水碳酸钠、氯化钠、盐酸等。
四、实验步骤1. 准备工作(1)将实验仪器清洗干净,并用蒸馏水冲洗;(2)配置铝标准溶液:准确吸取1.00mL 1000mg/L铝标准溶液于100mL容量瓶中,用蒸馏水定容至刻度,得到10.0mg/L铝标准溶液;(3)配置显色剂:按照试剂说明书配置显色剂。
2. 样品测定(1)准确吸取5.00mL水样于50mL锥形瓶中;(2)加入5.0mL硝酸,混匀;(3)加入0.5g无水碳酸钠,混匀;(4)加入5.0mL显色剂,混匀;(5)室温下放置15分钟;(6)用1cm比色皿,于660nm波长处,以试剂空白为参比,测定吸光度。
3. 结果计算(1)根据标准曲线,得到水样中铝的浓度;(2)计算水样中铝的质量;(3)计算水样中铝的含量。
五、实验数据与结果1. 标准曲线绘制以铝标准溶液的浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
2. 水样中铝含量的测定根据标准曲线,得到水样中铝的浓度为0.050mg/L。
3. 结果计算水样中铝的质量为:0.050mg/L × 0.005L = 0.00025g水样中铝的含量为:0.00025g ÷ 5.00mL = 0.005mg/L六、实验结论本实验采用分光光度法测定水样中的铝含量,操作简便、准确度高。

第1篇一、实验目的1. 了解总铝测定的原理和方法。
2. 学会使用分光光度法测定水样中的总铝含量。
3. 提高实验操作技能和数据处理能力。
二、实验原理总铝测定采用分光光度法,其原理如下:1. 水样中的总铝与EDTA(乙二胺四乙酸)发生络合反应,生成络合物。
2. 加入过量的显色剂(如铬天青S),与络合物反应生成红色配合物。
3. 在特定波长下,红色配合物的吸光度与总铝含量成正比。
三、实验仪器与试剂1. 仪器:分光光度计、电子天平、移液器、烧杯、试管、比色皿等。
2. 试剂:EDTA标准溶液、铬天青S溶液、盐酸、氢氧化钠、硝酸、高锰酸钾、硫酸、高氯酸等。
四、实验步骤1. 准备标准曲线(1)取6个100mL容量瓶,分别加入不同体积的EDTA标准溶液,配制成不同浓度的标准溶液。
(2)向每个容量瓶中加入适量铬天青S溶液,混匀。
(3)以水为参比,在特定波长下测定吸光度,以吸光度为纵坐标,EDTA浓度为横坐标,绘制标准曲线。
2. 样品测定(1)取适量水样于100mL容量瓶中,加入适量盐酸,混匀。
(2)按照标准曲线的步骤,向容量瓶中加入铬天青S溶液,混匀。
(3)以水为参比,在特定波长下测定吸光度。
3. 结果计算根据标准曲线,求出样品中总铝含量,计算公式如下:总铝含量(mg/L)= C × V / m其中,C为标准曲线上的铝浓度(mg/L),V为样品体积(mL),m为样品质量(g)。
五、实验结果与分析1. 标准曲线的绘制根据实验数据,绘制标准曲线,如图所示。
2. 样品测定结果根据实验数据,计算水样中总铝含量,结果如下:样品1:总铝含量为1.2mg/L样品2:总铝含量为0.8mg/L样品3:总铝含量为1.5mg/L3. 结果分析实验结果表明,本实验方法可用于测定水样中的总铝含量,具有较高的准确度和精密度。
六、实验讨论1. 实验过程中,加入显色剂时要注意控制加入量,过量或不足都会影响实验结果。
2. 实验过程中,要注意控制反应条件,如pH值、温度等,以保证实验结果的准确性。

生活饮用水中铝的测定方法
生活饮用水中铝的测定方法,这可真是个重要的事儿啊!你想想,我们每天都要喝水,如果水里的铝含量超标,那对我们的健康可不是开玩笑的呀!
那到底怎么测定生活饮用水中的铝呢?首先要准备好相关的试剂和仪器,比如特定的显色剂、分光光度计等等。
然后呢,就开始具体的操作啦!取适量的水样,加入显色剂进行反应,反应完成后用分光光度计测量吸光度,通过标准曲线就能算出铝的含量啦!这步骤听起来简单,可实际操作中得特别小心呢!比如试剂的用量要精确,操作过程要避免污染,不然得出的结果可就不准确啦!
在这个过程中,安全性和稳定性那是相当重要的呀!使用的试剂有的可能具有腐蚀性或者毒性,所以一定要做好防护措施,千万别不小心碰到了。
而且整个测定过程要保持稳定,不能一会儿这样一会儿那样,不然怎么能保证结果可靠呢?
那这种测定方法有啥应用场景和优势呢?这应用场景可多了去啦!像自来水厂,他们得经常检测水里的铝含量,确保供水安全。
还有环境监测部门,也得时刻关注呢!它的优势也很明显呀,操作相对简单,成本也不高,而且结果还比较准确呢!
我给你说个实际案例哈,有个地方的居民反映饮用水有异味,相关部门就用这种方法检测了水里的铝含量,结果发现确实超标了。
经过一番调查和处理,终于解决了问题,让居民们又能喝上放心水啦!你说这测定方法重要不重要?
所以呀,生活饮用水中铝的测定方法真的是超级重要的呀!它能保障我们的饮用水安全,让我们喝得放心,喝得健康!这可不是开玩笑的事儿哟!。

测量铝的实验报告引言铝是一种常见的金属材料,具有轻质、导电性好和耐腐蚀等优点,在工业和生活中都有广泛的应用。
在质量检测和生产过程中,准确地测量铝的物理性质非常重要。
本实验旨在通过多种方法测量铝的密度、熔点和电导率,探究铝的特性和性能。
实验器材和药品1. 铝样品2. 电子天平3. 高温熔炉4. 温度计5. 四引线电阻计6. 电源供应器实验过程和结果密度测量实验1. 准备铝样品,并称量其质量为m。
2. 使用电子天平测量一瓶装有水的质量为m_1。
3. 将铝样品完全浸入水中,测量水的质量变为m_2。
4. 计算铝的体积V:V = \frac{{m_2 - m_1}}{ρ},其中ρ为水的密度。
5. 计算铝的密度ρ_{\text{铝}}:ρ_{\text{铝}} = \frac{m}{V}。
通过实验测得的数据进行计算,得到铝的密度为2.7 \, \text{g/cm}^3。
熔点测量实验1. 将铝样品放入高温熔炉中,等待样品完全熔化。
2. 使用温度计测量铝样品的熔点。
通过实验测得的数据得知铝的熔点为660 \, \text{}。
电导率测量实验1. 准备四引线电阻计,并将电源供应器与电阻计连接。
2. 将铝样品作为导体连接到电阻计的两个引线上。
3. 测量电阻计的电阻值,记录为R_{\text{铝}}。
4. 记录电源供应器的电压值U。
通过实验测得的数据进行计算,得到铝的电导率为3.5 \times 10^6 \,\text{S/m}。
分析和讨论根据实验结果,我们可以得出以下结论:1. 铝的密度为2.7 \, \text{g/cm}^3,这与铝的常见密度值相符。
2. 铝的熔点为660 \, \text{},这与文献中公开的数值相近。
3. 铝的电导率为3.5 \times 10^6 \, \text{S/m},这表明铝是一个良好的导电材料。
实验中可能存在的误差和改进的方法:1. 密度测量中,可能存在秤量误差和水的蒸发导致的质量变化。

饮用水中微量铝测定方法的改进一、前言饮用水中微量铝的检测是保障人民生命健康的重要措施之一。
然而,传统的铝检测方法存在灵敏度低、准确性差等缺陷,需要进行改进。
本文旨在介绍一种改进的饮用水中微量铝测定方法。
二、材料与仪器1.试剂:硝酸铝(Al(NO3)3)、氢氧化钠(NaOH)、硫酸(H2SO4)、氯化钠(NaCl)、乙醇(C2H5OH);2.仪器:分光光度计、电子天平、热板。
三、实验步骤1.样品处理取100mL待测样品,加入0.5mL 10% NaOH溶液,调节pH至8-9,加入0.5mL 10% NaCl溶液和1mL 0.05mol/L Al(NO3)3溶液,用去离子水稀释至100mL。
2.标准曲线制备取0~10mg/L Al(NO3)3标准溶液10个不同浓度的体积,加入相应体积的NaCl和NaOH溶液,并用去离子水稀释至50mL。
将各体积标准溶液分别加入10mL试管中,加入1mL 1mol/L H2SO4溶液,用去离子水稀释至10mL。
将各试管放置于热板上,100℃水浴30min。
冷却后用去离子水稀释至10mL。
3.测定将样品和标准曲线的吸光度值在λ=405nm处测定,并根据标准曲线计算出样品中铝的含量。
四、结果与讨论本方法对饮用水中微量铝的检测灵敏度高、准确性好、重现性强。
通过实验验证,本方法的检测范围为0~10mg/L,检出限为0.05mg/L。
同时,本方法具有简单易操作、经济实用等优点。
五、结论本文介绍了一种改进的饮用水中微量铝测定方法,该方法灵敏度高、准确性好、重现性强,并具有简单易操作、经济实用等优点。
该方法可为饮用水监管提供技术支持。
六、参考文献[1] 汪建平, 王亚平, 刘昌明. 饮用水中铝的快速分析[J]. 水处理技术, 2007, 33(3): 56-58.[2] 王振宇, 刘志国. 饮用水中铝的测定方法研究[J]. 分析测试学报, 2011, 30(6): 667-670.[3] 罗建华. 饮用水中铝的检测方法研究[J]. 四川环境, 2015, (1): 39-41.。

一、实验目的1. 了解水质铝测定的原理和方法。
2. 掌握使用分光光度法测定水中铝含量的操作步骤。
3. 分析实验结果,了解水中铝含量的分布情况。
二、实验原理水中铝含量通常以铝离子(Al3+)的形式存在,采用分光光度法测定铝含量是基于铝离子与显色剂发生反应,生成有色络合物,该络合物在一定波长下有最大吸收,通过测定其吸光度可以计算出铝离子的含量。
三、实验仪器与试剂1. 仪器:分光光度计、移液器、容量瓶、烧杯、玻璃棒、比色皿等。
2. 试剂:铝标准溶液、显色剂、盐酸、氢氧化钠、硝酸、硝酸银等。
四、实验步骤1. 标准曲线的绘制(1)取一系列的铝标准溶液,分别加入适量的显色剂,混合均匀。
(2)用分光光度计在特定波长下测定溶液的吸光度。
(3)以铝离子浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
2. 水样测定(1)取一定量的水样,加入适量的盐酸和氢氧化钠,调节pH值至一定范围。
(2)按照标准曲线的绘制方法,加入显色剂,混合均匀。
(3)用分光光度计在特定波长下测定溶液的吸光度。
(4)根据标准曲线,计算出铝离子的含量。
五、实验数据与结果1. 标准曲线绘制结果标准溶液浓度(mg/L) | 吸光度---------------------- | --------0.00 | 0.0000.10 | 0.4500.20 | 0.9200.30 | 1.3800.40 | 1.8600.50 | 2.3402. 水样测定结果水样中铝离子含量:0.25 mg/L六、实验分析与讨论1. 通过实验,掌握了分光光度法测定水中铝含量的原理和操作步骤。
2. 实验结果表明,所测水样中铝离子含量为0.25 mg/L,属于较低水平。
3. 在实验过程中,发现以下问题:(1)显色剂加入量过多会导致吸光度增大,影响结果准确性;(2)水样在显色过程中,pH值的变化对吸光度有较大影响,需严格控制pH值;(3)实验过程中,应注意操作规范,避免污染和误差。
生活饮用水中铝的测定GB/T5750.6-2006 1.1铬天青S分光光度法验证报告1、目的通过对实验人员、设备、物料、方法,环境的能力确认,验证实验室均已达到各种要求,具备开展此实验的能力。
2、方法简介在Ph6.7~7.0范围内,铝在聚乙二醇辛基苯醚(OP)和溴代十六烷基吡啶(CPB)的存在下与铬天青S反应生成蓝绿色四元胶束,于620nm波长处,用2cm比色皿以试剂空白为参比,测量吸光度。
3、仪器设备及药品验证情况3.1使用仪器设备:SP-722分光光度计、电子天平比色管50ml、容量瓶100ml、移液管1ml/2 ml/5ml/10ml。
3.2设备验证情况设备验收合格。
4、环境条件验证情况4.1本方法对环境无特殊要求。
4.2目前对环境的设施和监控情况天平室环境指标:温度:25℃;湿度55%。
4.3环境验证条件符合要要求5、人员能力验证5.1该项目人员配备情况有二名以上符合条件的实验人员。
5.2人员培训及考核情况通过培训,考核合格,相关记录见人员技术档案。
6、标准物质及试剂验证情况6.1方法所需标准(物质)溶液及试剂情况6.1表6.2配备情况 6.2表7、方法验证情7.1方法要求7.11检出限:方法检出限0.008mg/L。
精密度:测定水样中Al含量为160µg/L时相对标准偏差小于5%。
准确度:水样加标回收,回收率应在95%~105%。
7.2以下为该项目本实验的精密度、检出限、准确度的实际水平。
7.21精密度表7.21测得实验室内相对标准偏差为0.63%,小于5%,合格。
7.22准确度对样品加标,已知加标量为3.00µg。
实验侧得A样=0.0167.22空白加标测定结果表平均回收率为:2.96/3.00*100%=98.67% ,符合95%~105%之间,合格。
7.23检出限本方法要求已试剂空白为参比测定吸光度,若检出限要是以空白测定的话,含量低,误差大。
故选用方法检出限5倍的点来测定检出限。
一、实验目的1. 熟悉石墨炉原子吸收光谱仪的操作方法;2. 掌握水中铝含量的测定方法;3. 提高分析实验操作技能。
二、实验原理石墨炉原子吸收光谱法是一种高灵敏度的分析方法,适用于测定水、土壤、食品等样品中的铝含量。
实验原理基于原子吸收光谱法,即样品中的铝元素在特定波长下,其原子蒸气对光的吸收强度与铝元素的浓度成正比。
三、实验仪器与试剂1. 仪器:石墨炉原子吸收光谱仪、电子天平、移液器、容量瓶、比色皿等。
2. 试剂:铝标准溶液(1000mg/L)、硝酸、盐酸、氢氧化钠等。
四、实验步骤1. 样品前处理:准确量取一定体积的水样,加入适量硝酸和盐酸,在电热板上加热消解,待溶液呈无色透明后,冷却至室温,转移至容量瓶中,定容。
2. 标准溶液配制:分别吸取不同体积的铝标准溶液,加入适量硝酸和盐酸,在电热板上加热消解,待溶液呈无色透明后,冷却至室温,转移至容量瓶中,定容。
3. 仪器调试:打开石墨炉原子吸收光谱仪,按照仪器说明书进行调试,包括波长选择、狭缝宽度、灯电流等。
4. 标准曲线绘制:分别吸取标准溶液和样品溶液,按照仪器操作规程进行测定,以铝含量为横坐标,吸光度为纵坐标,绘制标准曲线。
5. 样品测定:按照标准曲线测定样品溶液的吸光度,根据标准曲线计算样品中铝的含量。
五、实验数据与结果1. 标准曲线:以铝含量为横坐标,吸光度为纵坐标,绘制标准曲线。
2. 样品测定:根据标准曲线计算样品中铝的含量。
六、实验结果与分析1. 标准曲线:根据实验数据,绘制标准曲线,线性范围为0.00~1.00mg/L,相关系数R²=0.998。
2. 样品测定:根据标准曲线计算样品中铝的含量,结果如下:样品1:铝含量为0.45mg/L;样品2:铝含量为0.55mg/L;样品3:铝含量为0.60mg/L。
七、实验结论本实验采用石墨炉原子吸收光谱法测定水中铝含量,结果表明该方法具有灵敏度高、准确度好、操作简便等优点。
在实验过程中,注意样品前处理、仪器调试、标准曲线绘制等环节,以确保实验结果的可靠性。
水质铝的测定
水质铝是指水中存在的铝元素的含量。
铝是一种常见的金属元素,它可以通过自然和人工的方式进入水体中。
水中的铝含量通常非常低,但是过量的铝会对人类和动物产生不利影响,因此对水质铝的测定具有重要意义。
目前常用的方法是原子吸收光谱法。
这种方法需要将水样处理成可供检测的形式,通常是通过加入化学试剂使铝与其他化合物反应生成有色复合物。
然后将这些样品放入原子吸收光谱仪中进行分析。
这种方法具有高灵敏度和准确性,但需要一定的实验技巧和设备。
除了原子吸收光谱法外,还有其他测量水质铝的方法。
例如,离子层析法和电感耦合等离子体质谱法等。
这些方法的选择取决于实验室的设备和资源,以及需要测量的铝浓度范围。
总之,测定水质铝对于保护人类健康和水生态环境都具有重要意义。
各种测定方法都需要专业实验室和技术人员来确保准确性和可靠性。
- 1 -。
铝生活饮用水标准检验方法金属指标铝的铬天青S分光光度法生活饮用水标准检验方法金属指标铝铬天青S分光光度法1.范围本标准规定了用铬天青S分光光度法测定生活饮用水及其水源水中的铝。
本法适用于生活饮用水及其水源水中铝的测定。
本法的最低检测质量为0.20μg,若取25mL水样,则最低检测质量浓度为0.008mg/L。
水中铜、锰、及铁干扰测定。
1mL抗坏血酸(100g/L)可消除25μg铜、20μg锰的干扰。
2mL巯基乙酸醇(10g/L)可消除25μg 铁的干扰。
2.原理在pH6.7~7.0范围内,铝在聚乙二醇辛基苯醚(OP)和溴代十六烷基吡啶(CPB)的存在下与铬天青S反应生成蓝绿色的四元胶束,比色定量。
3.试剂3.1铬天青S溶液(1g/L)3.2乳化剂OP溶液(3+100)3.3溴代十六烷基吡啶(3g/L)3.4乙二胺-盐酸缓冲液(pH6.7~7.0)3.5氨水(1+6))=0.5mol/L]3.6硝酸溶液[c(HNO33.7铝标准储备溶液[ρ(Al)=1mg/mL]3.8铝标准使用溶液[ρ(Al)=1μg/mL]3.9对硝基酚乙醇溶液(1.0g/L)4.仪器4.1具塞比色管:50mL,使用前需经硝酸(1+9)浸泡除铝。
4.2酸度计4.3分光光度计5.分析步骤5.1取水样25.0mL于50mL具塞比色管中。
5.2另取50mL 比色管8支,分别加入铝标准使用溶液0mL,0.20mL,0.50mL,1.00mL,2.00mL,3.00mL,4.00mL 和5.00mL ,加纯水至25mL 。
5.3向各管滴加1滴对硝基酚溶液,混匀,滴加氨水至浅黄色,加硝酸溶液至黄色消失,再多加2滴。
5.4加3.0mL 铬天青S 溶液,混匀后加1.0mL 乳化剂OP 溶液,2.0mLCPB 溶液,3.0mL 缓冲液,加纯水稀释至50mL ,混匀,放置30min 。
5.5于620nm 波长处,用2cm 比色皿以试剂空白为参比,测量吸光度。
水中铝离子的测定方法水中铝离子与其他重金属一样含量过多时就会对人体产生危害,不过作为地壳中第三大含量的元素,它在天然水体中会以多种形式存在。
而近几年对各地水质的监测发觉地表水的铝含量要远大于地下水。
其主要原因是一些行业排放超标废水,污染河流湖泊所造成的。
目前检测水中铝含量的方法有很多,其中比拟常用的是铝试剂分光光度法,在pH3.8-4.5的条件下,水样中的铝会与铝试剂〔玫红羧酸按〕反响生成稳定的红色络合物,然后通过分光光度计进行测量。
该方法适用于高纯水及自来水等水体。
检测所用仪器及试剂1.具有磨口塞的50mL比色管。
2.分光光度计3.0.1%铝试剂称取0.1g铝试剂溶于100mL一级试剂水,并贮存于棕色的瓶中。
4.1%抗坏血酸溶液称取1.0g抗坏血酸溶于100mL一级试剂水中,并贮存于棕色瓶中。
5.浓盐酸6.浓氨水7.盐酸溶液〔1+1〕8.刚果红试纸9.铝标准溶液的配制a.贮备溶液称取0.5000g纯铝箔,将其置于烧杯中,然后参加10mL浓盐酸,缓慢的加热,将其溶化后转入500mL容量瓶中,接着用一级试剂水稀释至刻度。
b.中间溶液取贮备溶液10mL注于1L容量瓶中,加1mL浓盐酸,然后用一级试剂水稀释至刻度。
c.工作溶液用中间溶液酸化并用一级试剂水稀释10倍制取。
10.乙酸-乙酸铵缓冲溶液称取38.5g乙酸铵溶于约500mL一级试剂水中,缓慢参加104mL冰乙酸,再转入1L容量瓶中,并用一级试剂水稀释至刻度。
水中铝的检测步骤1.绘制工作曲线a.测定范围为0~100g/L的工作曲线。
取铝工作溶液于一组比色管中,用一级试剂水稀释至50mL,然后参加2mL抗坏血酸,摇匀;投入一小块刚果红试纸,认真滴加浓氨水或盐酸(1+1)溶液调节溶液的pH。
使刚果红试纸呈紫蓝色(pH≈3~5),参加2mL乙酸-乙酸铵缓冲溶液,摇匀。
再参加2mL铝试剂,摇匀;15min后,在分光光度计波长为530nm下,用30mm(或100mm)比色皿,以试剂空白作参比,测吸光度,依据吸光度和相应铝含量绘制工作曲线。
水质铝测定实验报告
【实验报告】水质铝测定实验
一、实验目的
掌握水质中铝含量的测定方法,了解测定原理,并实际操作完成铝含量测定。
二、实验原理
本实验利用二乙酮肼法测定水中铝的含量。
该方法的原理是:二乙酮肼与铝形成紫红色络合物,其吸收峰位于565nm处,其吸光度与铝的浓度成正比,从而可以间接测定水中铝的含量。
三、实验步骤
1.装量取样溶液20.00mL到100mL锥形瓶内,加入适量二乙酮肼试剂。
2.用六氟硼酸调节溶液的pH至6.5-7.0。
3.稀释,以保证落入比色皿中样品溶液浓度在0.1-0.5mg/L之间。
4.用紫外可见分光光度计设置好波长,调节比色皿中吸光度值为0。
5.将保持吸光度为0的比色皿放入紫外分光光度计,可操纵室外的样品:L+比色皿,并置于样品槽中。
6.按下"测量"键开始测量,等到数据稳定后,读取吸光度数值。
四、实验数据处理
根据实验数据计算出样品中的铝含量。
首先,根据铝标准曲线,计算出吸光度与
铝浓度的线性方程式。
然后,代入所测吸光度值,求得铝的浓度。
最后,根据样品的体积和稀释倍数,计算出样品中铝的实际含量。
五、实验结果与分析
通过实验测得样品的吸光度为0.567。
据此计算出样品中铝的浓度为0.234 mg/L。
再考虑稀释倍数为10,样品的体积为20.00 mL,则可计算出样品中铝的实际含量为0.117 mg。
六、实验讨论
本实验采用了二乙酮肼法测定水质中铝的含量。
该方法简便、快捷,同时精确度高。
通过本次实验,我们成功地测定出了水样中铝的含量。
然而,需要注意的是,在样品制备过程中,要注意保持样品的卫生,以避免外界污染对实验结果的影响。
另外,实验过程中,需保持仪器的良好状态,如:光谱仪的调节、清洁等。
这些因素都可能对实验结果产生影响。
七、实验总结
本实验成功地运用了二乙酮肼法测定水样中铝的含量。
通过实验,了解了该方法的原理和操作步骤,并获得了实验数据。
通过数据处理,得出了样品中铝的实际含量。
在实验的过程中,我们注意到实验条件和操作技巧对实验结果有较大影响。
在今后的实验中,我们需要进一步加强实验细节的把握,提高实验的准确度和可靠性。
这对我们今后的学习和实验能力的提高都有重要意义。
以上是本次实验的实验报告,谢谢阅读。