高中化学竞赛无机化学
- 格式:pptx
- 大小:206.52 KB
- 文档页数:36




第一章 化学基础知识1. 1. 01 理想气体模型的基本假定:气体分子的自身体积可以忽略,分子可看成有质量的几何点;气体分子间的作用力可以忽略,分子与分子之间、分子与器壁之间的碰撞,可认为是完全弹性碰撞,即碰撞过程中无动能损失。
高温、低压下的实际气体很接近理想气体。
1. 1. 02 理想气体状态方程:理想气体状态方程 pV = nRT中,若压力 p 以Pa 为单位,体积 V 以m 3为单位,温度 T 以K 为单位,物质的量 n 以mol 为单位,则比例系数R = 8.314 J•mol -1•K -1。
R 称为摩尔气体常数。
pV 之积可以看成一种功。
若理想气体状态方程中体积 V 的单位变为 dm 3,而其余物理量的单位不变,则 R = 8.314 103 Pa•dm 3•mol -1•K -1,这个R 值用于处理压力与浓度的关系时,十分方便,如用在下面的公式中p = —— RT p = c RT 式中 c 是以 mol•dm -3 为单位的浓度。
1. 1. 03 混合气体和组分气体:由两种或两种以上的气体混合在一起组成的体系,称为混合气体。
组成混合气体的每种气体,都称为该混合气体的组分气体。
1. 1. 04 组分气体的摩尔分数:若第i 种组分气体的物质的量用n i 表示,混合气体的物质的量用n 表示,则—— 称为第i 种组分气体的摩尔分数,用 x i 表示。
显然有 1. 1. 05 组分气体的分压:混合气体的体积称为总体积,用 V 总 表示。
当第i 种组分气体单独存在,且占有总体积时,其具有的压力,称为该组分气体的分压。
若第i 种组分气体的分压,用 p i 表示,则有下面理想气体的状态方程式成立p i V 总 = ni R T 1. 1. 06 组分气体的分体积:n in nV混合气体所具有的压力,称为总压,用 p 总 表示。
当第i 种组分气体单独存在,且具有总压时,其所占有的体积,称为该组分气体的分体积。

全国高中化学竞赛真题汇总高中化学竞赛是一项极具挑战性和专业性的学科竞赛,对于热爱化学、追求知识深度和广度的学生来说,是一个展示自己才华和实力的舞台。
以下是为大家汇总的一些全国高中化学竞赛的真题,希望能对准备参赛的同学们有所帮助。
一、无机化学部分真题 1:已知某元素 X 的原子序数为 25,其+2 价离子的电子构型为 Ar3d5。
请回答下列问题:(1)写出元素 X 的名称和元素符号。
(2)预测元素 X 的常见氧化态。
(3)比较元素 X 的+2 价离子和+3 价离子的稳定性,并说明原因。
这道题主要考查了原子结构和元素周期表的相关知识。
对于原子序数为 25 的元素,我们可以通过电子构型来确定其为锰(Mn)。
锰常见的氧化态有+2、+4、+6、+7 等。
在+2 价和+3 价离子中,由于+2 价离子的 3d 轨道半充满,结构相对稳定,所以+2 价离子比+3 价离子更稳定。
真题 2:给出下列化合物的名称:K2PtCl6、Co(NH3)6Cl3。
这道题考查了配合物的命名。
K2PtCl6的名称为六氯合铂(Ⅳ)酸钾,Co(NH3)6Cl3 的名称为三氯化六氨合钴(Ⅲ)。
二、有机化学部分真题 1:完成下列反应方程式:(1)CH3CH2CH=CH2 +HBr →(2)CH3CH2OH +PBr3 →对于第一个反应,根据马氏规则,氢原子会加到含氢较多的双键碳原子上,所以产物为 CH3CH2CHBrCH3。
第二个反应中,PBr3 可以将醇羟基转化为溴原子,产物为 CH3CH2Br。
真题 2:用化学方法鉴别以下化合物:苯甲醛、乙醛、丙酮。
鉴别这三种化合物可以利用醛基的特殊反应。
首先,分别加入银氨溶液(托伦试剂),能产生银镜反应的是苯甲醛和乙醛,无现象的是丙酮。
然后,向产生银镜反应的两种物质中加入斐林试剂,加热后产生砖红色沉淀的是乙醛,不产生沉淀的是苯甲醛。
三、物理化学部分真题 1:在 298 K 时,反应 2A +B → C 的速率常数 k = 10×10^(-3) L·mol^(-1)·s^(-1)。

高中化学竞赛无机化学6高中化学竞赛中的无机化学部分,是一个充满挑战与趣味的领域。
在这其中,第六部分的知识更是涵盖了众多关键的概念和原理。
首先,让我们来聊聊原子结构。
原子是构成物质的基本单位,了解其结构对于理解化学性质至关重要。
原子核位于原子的中心,由质子和中子组成,而电子则围绕着原子核高速运动。
质子的数量决定了元素的种类,而原子的质量主要由质子和中子共同决定。
电子在不同的能级轨道上运动,其分布遵循特定的规律。
比如,能层、能级、原子轨道等概念,都是理解电子运动状态的重要基础。
说到化学键,这可是无机化学中的重点。
离子键是通过阴阳离子之间的静电作用形成的,通常在活泼金属与活泼非金属之间形成。
共价键则是原子之间通过共用电子对形成的,分为极性共价键和非极性共价键。
金属键则存在于金属单质中,是由金属阳离子和自由电子之间的相互作用形成的。
这些不同类型的化学键决定了物质的物理性质和化学性质。
比如离子化合物通常具有较高的熔点和沸点,而共价化合物的性质则较为多样。
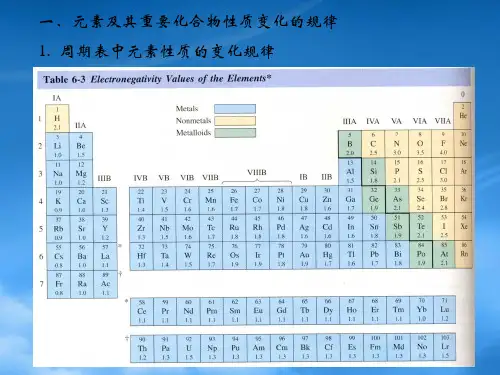
元素周期表是无机化学的重要工具。
在高中化学竞赛中,对元素周期表的深入理解是必不可少的。
同一周期的元素,从左到右,原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强。
同一主族的元素,从上到下,原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱。
这些规律有助于我们预测元素的性质和化合物的形成。
再来看看无机化合物。
氧化物是其中的一大类,包括酸性氧化物、碱性氧化物和两性氧化物等。
酸和碱的性质和分类也是重要的考点。
强酸强碱在溶液中完全电离,而弱酸弱碱则部分电离。
盐的种类繁多,有正盐、酸式盐和碱式盐等。
了解它们的水解规律对于判断溶液的酸碱性非常关键。
化学反应速率和化学平衡也是竞赛中的重点。
影响化学反应速率的因素有浓度、温度、压强、催化剂等。
而化学平衡则是一个动态平衡,当外界条件改变时,平衡会发生移动。
通过勒夏特列原理,我们可以判断平衡移动的方向。
在无机化学的实验部分,各种实验操作和实验现象需要我们熟练掌握。

无机化学计算题化学热力学:1.高价金属的氧化物在高温下容易分解为低价氧化物。
以氧化铜分解为氧化亚铜为例,估算反应分解的温度。
该反应的自发性是焓驱动的还是熵驱动的?温度升高对反应自发性的影响如何?解:4CuO===2Cu2O+O2△r Hθm(298K)=2△fHθm(298K,Cu2O)+△fHθm(O2)-4△fHθm(298K,CuO)=2×(-169)+0-4×(-157.3)=291.2kJ·mol-1△r Sθm(298K)=2Sθm(298K,Cu2O)+Sθm(298K,O2)-4Sθm(298K,CuO)=2×93.3+205.138-4×42.7=220.94J·mol-1·K-1分解时:△rGθm≤0即△rHθm(298K)-T△r Sθm(298K)≤0∴T≥△r Hθm(298K)/△r Sθm(298K)=1318K在此反应中,△r Hθm(298K)>0,△rSθm(298K)>0,故该反应的自发性是熵驱动的。
温度升高,此反应更易朝着正反应方向进行。
2.银器与硫化物反应表面变黑是生活中的常见现象。
(1)设空气中H2S气和H2气“物质的量”都只达10-6mol,问在常温下银和硫化氢能否反应生成氢气?温度达到多高,银器表面才不会因上述反应而变黑?(2)如果考虑空气中的氧气加入反应,使反应改为2Ag(s)+H2S(g)+1/2O2(g)==Ag2S(s)+H2O(l),该反应是否比银单独和硫化氢反应放出氢气更容易发生?通过计算来回答。
温度对该反应自发性的影响如何?附:298K下Ag2S的标准生成焓和标准熵分别为-31.8kJ·mol-1和146J·mol-1·K-1解:(1)2Ag(s)+H2S(g)==Ag2S(s)+H2(g)298K时,△r Hmθ=△fHθm(Ag2S)-△fHθm(H2S)=-31.8-(-20.63)kJ·mol-1 =-11.17kJ·mol-1△r Smθ=130.684+146-205.79--2×42.55J·K-1·mol-1=-14.206J·K-1·mol-1△r Gmθ=△rHmθ-T△rSmθ=-6.94kJ·mol-1△r Gm=△rGmθ+RT ln[(p(H2)/pθ)/(p(H2S)/pθ)]=△r G mθ=-6.94kJ·mol-1要使反应不发生,则△r Gmθ≥0T≥△r Hmθ/△rSmθ=787K即温度高于787K银器表面才不会因上述反应而变。

高中化学竞赛推荐书目一、无机化学:1、基础教材类:《无机化学》(武汉大学、吉林大学,第三版,高教社,1994)很多人极崇拜的无机教材,的确很适合竞赛。
竞赛需要的元素知识大部分都在其中,编排思路也不错,但错误较多,看的时候需要慎重。
《无机化学》(吉林大学、武汉大学、南开大学,第四版,高教社,2004)我的启蒙教材啊。
普遍认为不如第三版,个人感觉理论部分还可以,条理比较清晰。
元素就不用看了,或者对照第三版找找新的东西就行。
《无机化学》(北京、华中、南京师范大学,第一版,人教社,1981)初中时查资料用的书。
感觉比第四版要好一些,不过很罕见。
《无机化学》(北京、华中、南京师范大学,第四版,高教社,2002)吴国庆的书,对于竞赛来说有一些参考价值。
理论部分很好,元素就是照格林伍德的书抄的,而且漏洞百出。
无机拓展知识部分值得一看,已经从中出过很多道竞赛题。
《普通化学原理》(华彤文、陈景祖等,第三版,北大,2005)北大普化教材,相当基础,相当细致,做启蒙教材比较适合。
《基础无机化学》(尹敬执、申泮文,第一版,人教社,1980)很老的一套教材,排版较乱,不过毕竟是院士的书,某些方面还是有值得借鉴之处的。
《基础无机化学》(F.A.科顿、G.威尔金森,南开大学译,第一版,科学,1984)当代著名无机化学家和诺贝尔化学奖得主共同编写的基础教材,有一些个人色彩,在有机金属化合物方面有较详尽的介绍。
2、元素化学类:《普通无机化学》(严宣申、王长富,第二版,北大,1999)与一般的教材思路不同,很有看的价值。
《化学元素周期系》(车云霞,申泮文,第一版,南开大学出版社,1999)书中有两个申老先生的科研成果,但整体较简略。
价值不大《大学普通化学》(傅鹰,人教社,1981)院士的书,其下册可以算是我看过的最经典的元素教材了。
语言相当风趣,讲述知识的同时也讲述科研方法、思想,而且适时地介绍做人的道理。
全书条理清晰,详略得当,对主要元素的介绍很到位,而且有一些独到的东西,看过之后大部分元素知识就不会再忘了。


高中上册化学竞赛试题及答案
问题一
请问酒精的化学式是什么?
答案:酒精的化学式为C2H5OH。
问题二
请列举一些常见的无机化合物及其化学式。
答案:常见的无机化合物及其化学式如下:
- 水:H2O
- 二氧化碳:CO2
- 硫酸:H2SO4
- 氧化钙:CaO
- 氯化钠:NaCl
问题三
请解释一下酸和碱的特性及反应。
答案:酸的特性包括酸味、酸性物质能与金属反应生成氢气、酸性物质能与碱中和生成盐和水等。
碱的特性包括苦味、碱性物质能与酸中和生成盐和水等。
酸和碱反应时会产生中和反应,生成盐和水。
问题四
请简述一下金属氧化物的性质及其与酸的反应。
答案:金属氧化物的性质通常是碱性的,能与酸发生反应。
当金属氧化物与酸反应时,会产生中和反应,生成相应的盐和水。
问题五
请说明化学反应速率的影响因素。
答案:化学反应速率受以下因素影响:
- 温度:温度升高会加快反应速率。
- 浓度:反应物浓度较高会加快反应速率。
- 催化剂:加入适当的催化剂可加快反应速率。
- 表面积:反应物表面积较大会加快反应速率。
以上是高中上册化学竞赛试题及答案,希望对您有帮助!。
化学竞赛如何搞定无机化学一、教学内容1. 无机化合物的命名规则;2. 离子键、共价键和金属键的特点与区别;3. 氧化还原反应、酸碱反应、置换反应、合成反应等基本反应类型;4. 常见元素和化合物的性质及其应用。
二、教学目标1. 使学生掌握无机化合物的命名规则,能够准确、规范地命名各类无机化合物;2. 帮助学生理解离子键、共价键和金属键的特点与区别,提高其对无机化合物结构的认识;3. 培养学生掌握无机化学基本反应类型,能够分析判断化学反应的性质和方向。
三、教学难点与重点1. 无机化合物的命名规则;2. 离子键、共价键和金属键的特点与区别;3. 无机化学基本反应类型的判断与分析。
四、教具与学具准备1. 教材《无机化学》;2. 课件或黑板;3. 各类无机化合物的模型或图片;4. 化学试剂及相关实验器材。
五、教学过程1. 实践情景引入:通过展示一些日常生活中的化学现象,如钢铁生锈、酸碱中和反应等,引导学生思考无机化学的重要性及其在实际应用中的作用。
2. 知识讲解:讲解无机化合物的命名规则,通过示例使学生掌握命名方法;分析离子键、共价键和金属键的特点与区别,结合实例让学生理解各种键的概念;介绍氧化还原反应、酸碱反应、置换反应、合成反应等基本反应类型,以及它们的判断方法。
3. 例题讲解:选取具有代表性的例题,分析其反应类型,解释反应原理,引导学生学会运用所学知识分析化学现象。
4. 随堂练习:设计一些练习题,让学生在课堂上完成,检验其对所学知识的掌握程度,并及时给予解答和指导。
5. 课后作业:布置一些相关的作业题,使学生巩固所学知识,提高其运用能力。
六、板书设计1. 无机化合物的命名规则;2. 离子键、共价键和金属键的特点与区别;3. 氧化还原反应、酸碱反应、置换反应、合成反应等基本反应类型及其判断方法。
七、作业设计3. 设计一个实验,验证铁在氧气中燃烧四氧化三铁的反应。
八、课后反思及拓展延伸课后反思:本节课通过讲解无机化合物的命名规则,使学生掌握了命名的基本方法;分析了离子键、共价键和金属键的特点与区别,提高了学生对无机化合物结构的认识;介绍了氧化还原反应、酸碱反应、置换反应、合成反应等基本反应类型,为学生进一步学习无机化学奠定了基础。
高中化学竞赛无机化学在高中化学竞赛的领域中,无机化学无疑是一座巍峨的山峰,等待着学子们去攀登和征服。
无机化学,作为化学学科的重要分支,涵盖了丰富多样的内容,从元素周期表的规律到各种无机化合物的性质,从化学反应的原理到实际应用,无一不让人感受到化学世界的神奇与魅力。
首先,元素周期表是无机化学的基石。
它不仅仅是一张罗列元素的表格,更是揭示元素性质规律的密码图。
沿着周期表的横行和纵列,我们可以清晰地看到元素的周期性变化。
同一周期中,从左到右,原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强;同一主族中,从上到下,原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱。
这些规律为我们理解元素的化学性质提供了重要的线索。
比如,碱金属元素(锂、钠、钾等)具有很强的还原性,而卤族元素(氟、氯、溴等)则具有很强的氧化性。
无机化合物的种类繁多,性质各异。
氧化物、酸、碱、盐是其中常见的几大类。
氧化物又分为酸性氧化物、碱性氧化物和两性氧化物。
酸性氧化物如二氧化碳、二氧化硫等,能与碱反应生成盐和水;碱性氧化物如氧化钠、氧化钙等,能与酸反应生成盐和水;而两性氧化物如氧化铝,既能与酸反应,又能与碱反应。
酸和碱的性质也是竞赛中的重点。
强酸强碱在水溶液中完全电离,而弱酸弱碱则部分电离。
常见的强酸有盐酸、硫酸、硝酸等,强碱有氢氧化钠、氢氧化钾等。
盐的种类更是丰富多样,正盐、酸式盐、碱式盐都有各自独特的性质。
化学反应是无机化学的核心内容之一。
氧化还原反应、酸碱中和反应、沉淀反应等在竞赛中经常出现。
氧化还原反应中,电子的转移是关键。
通过化合价的变化,我们可以判断氧化剂和还原剂,计算电子转移的数目。
酸碱中和反应则是氢离子和氢氧根离子结合生成水的过程。
沉淀反应则涉及到溶度积的概念,通过比较离子积和溶度积的大小,可以判断是否会生成沉淀。
在无机化学的学习中,实验也是不可或缺的一部分。
通过实验,我们可以直观地观察到化学反应的现象,验证理论知识。