小鼠摘除眼球采血及分离血清
- 格式:doc
- 大小:26.50 KB
- 文档页数:1

健脾祛湿针法对ob小鼠瘦素的影响目的:探讨健脾祛湿针法电针对ob小鼠瘦素影响规律。
方法:将18只ob/ob 小鼠随机分成3组:针刺组、假针刺组、肥胖对照组,以c57小鼠作为固定组、以及空白对照组。
电针治疗时电针穴位组取后三里、三阴交、中脘和关元穴。
固定组、以及空白对照组、肥胖对照组不予以电针刺激,电针非穴位组选取斜肋部针刺。
各组体重差及体重降低率应用spss19.0统计软件进行单因数方差分析。
实验结束时,消毒小鼠眼球后,摘除小鼠眼球,取血并提取血清。
采用免疫酶联法测定瘦素的含量。
获得数据后应用spss19.0统计软件进行单因数方差分析其组间差异。
结果:1、通过28天的治疗,电针穴位组与肥胖对照组体重增长率有显著性差异(P=0.000),说明电针能显著降低ob小鼠的生长率。
2、经间单因素方差分析电针穴位组与其余各组血清中瘦素含量有显著性差异(P<0.05)。
结论:统计结果显示健脾化湿针法显著改变了ob小鼠血清中瘦素含量,针对于瘦素紊乱的肥胖有重要的干预作用。
标签:针灸;瘦素;ob小鼠;1 前言肥胖(obesity)是指一定程度的明显超重与脂肪层过厚,是体内脂肪,尤其是甘油三酯积聚过多而导致的一种状态,是能量的摄入大于消耗,造成体内脂肪过度积聚或分布异常的一种慢性代谢紊乱性疾病疾病。
中医认为脾失健运,导致水湿内停是肥胖的基本病理机制,在治疗上以健脾利湿为主要原则。
在中医理论的指导下,中药、针刺、穴位埋线、灸法、耳穴压豆等等方法都广泛应用于临床。
而针灸以其安全、减肥作用显著、疗效持久及毒副作用小的优点已得到越来越多人的关注。
针灸减肥的基本理念是以调整脾胃功能和神经内分泌为原则,通过调整体内多种活性物质及代谢途径的综合作用而达到减肥效果的[2]。
即通过刺激经络腧穴来调整下丘脑—垂体—肾上腺皮质和交感—肾上腺髓质两大系统功能,加快基础代谢率,由此提高脂肪循环,产生热量,使积存的脂肪消耗掉,进而调整、完善、改善人体自身平衡[3]。

动物血液的采集、抗凝及血清分离技术实验目的动物血液的采集、抗凝及血清分离技术实验,是一项常用的生命科学实验技术。
该实验的主要目的是使用该技术从动物体内采集血液样本,然后对血液样本进行抗凝和血清分离处理,得到纯净的血清样本,以进行后续的研究。
血液是维持生命的重要物质之一,血清样本中含有许多生物大分子,如抗体、酶、激素等。
因此,血清样本可以用于研究生命科学领域的课题,如基础医学研究、药物研发、生物学实验等。
实验材料:小鼠或大鼠、抗凝剂、离心管、离心机、移液器、冰桶、平板、热水浴。
实验步骤:1、选择小鼠或大鼠进行血液样本的采集。
准备好动物和所需实验材料。
2、将离心管标明,每只小鼠或大鼠用一个离心管,分别通入不同的抗凝剂中,使抗凝剂充分混合。
3、拿出小鼠或大鼠,用酒精或碘酒消毒动物的采血部位(一般为尾部),并用镊子夹着皮肤使之易于穿刺。
4、用注射器注入部分抗凝剂,让其渗到穿刺处,然后在穿刺处刺入注射器,缓慢吸出血液至离心管中。
每只小鼠或大鼠最多采集300-500μL。
5、将血液样本离心约10分钟,血细胞沉淀在管底,将上清液吸出到新的离心管中。
6、将新的离心管置于热水浴中,设定温度在56-58℃之间,使血清凝结,然后置于冰桶中冷却。
7、将血液中的凝块用棉签或吸头慢慢挑出,将纯净的血清样本转移至新的离心管中。
8、用移液器分装血清样本,冷冻保存或使用于后续实验中。
实验注意事项:1、动物对人类的消毒要求严格,操作前要仔细消毒,以防止交叉感染。
2、由于采血时对动物的创伤,应采取痛苦较小或无痛的方法。
3、血液样本的采集量应根据动物种类、体重和年龄等因素而定,不可过多。
4、血清要避免暴晒和震荡,冷冻保存期限为1年左右。
需要重新使用时应先将样品回温至室温,避免多次冻融。
血液的采集、抗凝及血清分离技术实验是一项成熟的生命科学实验技术,它广泛应用于生物学、医学、药学等领域。
本实验的完成不仅能让学生学会实验操作的基本技巧,更能深入理解动物血液及其组成,为进一步的研究打下坚实的基础。

动物实验●动物的选择选择的原则:一切实验动物应具有个体间的均一性,遗传的稳定性和容易获得三个基本要求。
1.从研究目的和实验要求选择,尽量选择与研究对象的机能,代谢,结构,疾病性质的动物。
2.是否易获得,是否经济,是否容易饲养。
●实验动物本实验室常用的实验动物多为小鼠和家兔1.小鼠(Mus musculus)实验小鼠是目前教学,医学科学研究工作中经常应用的,使用量最大的一种动物。
其性成熟早,产仔多,繁殖快,体型小,便于管理,价格低廉,应用极广,特别使用于需要大量动物进行的实验,如药物筛选,半数致死量,药物的效价比较等。
用人工接种或化学致癌物方法可以导致生长各种响应肿瘤,因此也很适应抗癌药物的研究。
我国医学实验中常用的小鼠是野生鼷鼠的变种,属于哺乳纲,啮齿目,鼠科,鼠属。
小鼠1.5-2 月龄体重达20g以上,可供实验使用。
常用的实验小鼠,尤其是纯品系小鼠,经过人们长期的定向培育与纯化之后,一般具有与野生动物或家畜不同的独有特性(对实验的敏感性和实验结果的一致性,个体动物遗传的均一性),这些都是衡量实验小鼠质量好坏的重要标志。
我国常用的实验小鼠品种有:Balb/c鼠,昆明鼠等。
2.家兔(Oryctolagus cunieulus Rabbits)兔形目,兔科。
常用的家兔为真兔属,由欧洲野生穴兔驯化而成,目前已有五十多个品种。
生物医学研究中常用的家兔均为欧洲兔的后代,使用最多的有新西兰兔,大耳白兔,青紫兰兔,荷兰兔,弗莱密西兔。
●抗原剂量的选择不同抗原的免疫原性强弱不同,取决于其分子量,化学活性基团,立体结构,物理性状和弥散速度等。
抗原的免疫剂量依照给予抗原的种类,免疫次数,注射途径以及受体动物的种类,免疫周期及所要求的抗体特性等而不同。
剂量过低不能形成足够强的免疫刺激,剂量过高,又有可能造成免疫耐受。
在一定范围内,抗体效价随注射抗原的剂量而增高。
蛋白质抗原的免疫剂量比多糖类抗原宽。
一般而言,小鼠首次抗原剂量为50-400μg/次,大鼠为100μg-1mg/次,加强免疫的剂量为首次剂量的1/5-2/5。

小鼠实验在各药物剂型研究中的应用实验小鼠来自与野生小鼠,经过人们长期选择培育而成。
十七世纪就被人们用作动物实验,是目前应用最广泛、被研究最详尽、品种最多的哺乳类实验动物,被广泛运用于各种药物试验。
药剂学在剂型的开发中同样需要药效学实验数据作为支持,所以各种剂型的动物学实验就很有必要,以下是几种常用剂型的小鼠实验做为例子进行探讨。
1.丸剂我们以祛风息痛丸为例进行讨论。
祛风息痛丸由祖师麻、独活、木瓜、当归等16味中草药组成,具有祛风、散寒、活血、止痛等功用,临床用于风寒湿痹、四肢麻木、周身疼痛和腰膝酸痛等症。
1.1 实验前准备药品与试剂祛风息痛丸(QF)(TW):为糖衣浓缩丸,去糖衣后呈棕褐色,素丸每10丸重3.0 g,相当于生药3.0 g。
本试验所用为QFXTW成丸前药粉,为棕褐色粉末,1.0 g药粉与1.0 g祛风息痛丸含生药量相同,,临用前用蒸馏水配制为适当浓度的混悬液。
阿司匹林:临用前用蒸馏水配制为适当浓度的混悬液。
醋酸等试剂为国产分析纯试剂。
实验动物健康成年昆明种小鼠,日龄为45d,体重为18—22 g,雌雄兼用,灌胃给药前禁食不禁水8—12h。
1.2 实验方法1.2.1 对腹腔注射醋酸所致小鼠扭体反应的影响昆明种小鼠100只,体重18—22 g,随机分为5组,每组20只,雌雄各半。
对照组:灌胃生理盐水10 ml/kg;QFXTW 低、中、高剂量组:分别灌胃QFXTW 0.36,1.08,3.24 g/kg。
阳性药对照组(阿司匹林组):灌胃阿司匹林0.4 g/kg。
每日灌胃一次,连续给药10 d,末次灌胃后2 h,给每只小鼠腹腔注射(ip)0.7%的醋酸(临用前新鲜配制)每只0.2 ml,5 min后记录15 min 内小鼠的扭体反应次数(扭体反应表现为动物腹部内凹,臀部高起,躯干和后肢伸张[1])。
.1.2.2 对小鼠热板法痛阈的影响采用RI~200智能热板仪(成都泰盟),控制热板温度为(55±1)℃进行热板实验 2。


小鼠外周血单个核细胞分离、纯化徐太哲;李丽;王长山【摘要】目的:探讨小鼠外周血单个核细胞(PBMC)最佳分离条件,提高细胞获得率与纯度,以便后续分子生物学实验.方法:小鼠摘除眼球取血,设置离心力、离心时间、实验环境温度等梯度优化,分别采用EDTA-K2、肝素、枸橼酸钠抗凝,Ficoll密度梯度离心法分离单个核细胞,直接进行贴壁培养和分析获得率、纯度,计数存活率.结果:Ficoll密度梯度离心法经条件优化后分离的PBMC纯度可达85%,细胞获得率最高可达80%以上,活细胞百分率在92%以上.结论:Ficoll密度梯度离心法在优化条件下可有效地分离PBMC,对后续分子生物学实验无影响.【期刊名称】《黑龙江医药科学》【年(卷),期】2016(039)004【总页数】3页(P10-11,13)【关键词】小鼠;Ficoll密度梯度离心;PBMC【作者】徐太哲;李丽;王长山【作者单位】佳木斯市红十字医院,黑龙江佳木斯154003;佳木斯大学,黑龙江佳木斯154007;佳木斯大学,黑龙江佳木斯154007【正文语种】中文【中图分类】R446.11+3外周血单个核细胞(Peripheral blood mononuclear cells,PBMCs)包括淋巴细胞和单核细胞。
是免疫系统的重要组成,是研究免疫老化和衰老的主要依据。
研究T、B淋巴细胞首要分离外周血单个核细胞,主要的分离方法是Ficoll-hypaque密度梯度离心法,因血液中各组成成分的沉降系数存在差异,而得以分离[1]。
离心后,单个核细胞因与分离液密度相当,集中在血浆层和分层液的界面上,呈白雾层,吸取该层细胞经洗涤离心即获得PBMC。
PBMC分离是分子生物学试验常用的技术,其效果直接影响PCR等后续试验结果。
实验对象小鼠因体重小,体内血液量少,Ficoll密度梯度离心法正适用这样少量血液的分离,本文探讨小鼠外周血单个核细胞的分离最佳条件。
1.1 材料与分组BALB/c小鼠18只,5~6月龄,体重23~25g,雌雄不限;小鼠外周血单核细胞分离液试剂(天津市灏洋生物制品科技有限责任公司)。

.眼眶静脉丛采血采血者的左手拇食两指从背部较紧地握住小鼠或大鼠的颈部(大鼠采血需带上纱手套),应防止动物窒息。
当取血时左手拇指及食指轻轻压迫动物的颈部两侧,使眶后静脉丛充血。
右手持续接7号针头的1ml注射器或长颈(3~4cm)硬质玻璃滴管(毛细管内径0.5-1.0mm),使采血器与鼠面成45℃的夹角,由眼内角刺入,针头斜面先向眼球,刺入后再转180度使斜面对着眼眶后界。
刺入浓度,小鼠约2~3mm,大鼠约4~5mm。
当感到有阻力时即停止推进,同时,将针退出约0.1-0.5mm,边退边抽。
若穿刺适当血液能自然流入毛细管中,当得到所需的血量后,即除去加于颈部的压力,同时,将采血器拔出,以防止术后穿刺孔出血。
若技术熟练,用本法短期内可重复采血均无多大困难。
左右两眼轮换更好。
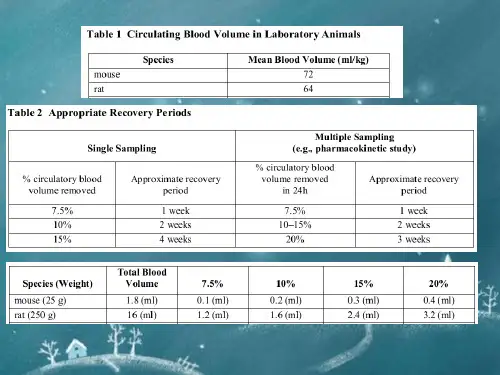
体重20-25g 的小鼠每次可采血0.2-0.3ml;体重200-300g大鼠每次可采血0.5-1.0ml,可适用于某些生物化学项目的检验。

实验⼩⿏的基本操作⼀、⼩⿏的抓取固定正确的抓取固定⼩⿏,是为了不损害⼩⿏健康,不影响观察指标,并防⽌被⼩⿏咬伤,保证实验顺利进⾏。
抓取固定时既要⼩⼼仔细,不能粗暴,⼜要⼤胆敏捷。
⼩⿏性情较温顺,⼀般不会咬⼈,⽐较容易抓取固定。
通常⽤右⼿提起⼩⿏尾巴将其放在⿏笼盖或其它粗糙表⾯上,在⼩⿏向前挣扎爬⾏时,⽤左⼿拇指和⾷指捏住其双⽿及颈部⽪肤,将⼩⿏置于左⼿掌⼼、⽆名指和⼩指夹其背部⽪肤和尾部,即可将⼩⿏完全固定。
在⼀些特殊的实验中,如进⾏尾静脉注射时,可使⽤特殊的固定装置进⾏固定,如尾静脉注射架或粗的玻璃试管。
如要进⾏⼿术或⼼脏采⾎应先⾏⿇醉再操作,如进⾏解剖实验则必须先⾏⽆痛处死后再进⾏。
⼆、⼩⿏的采⾎1.剪尾采⾎⼿拇指和⾷指从背部抓住⼩⿏颈部⽪肤,将⼩⿏头朝下,⼩⿏保定后将其尾巴置于50°热⽔中浸泡数分钟,使尾部⾎管充盈。
擦⼲尾部,再⽤剪⼑或⼑⽚剪去尾尖1~2mm,⽤试管接流出的⾎液,同时⾃尾根部向尾尖按摩。
取⾎后⽤棉球压迫⽌⾎并⽤6%液体⽕棉胶涂在伤⼝处⽌⾎。
每次采⾎量0.1ml。
2.摘除眼球采⾎左⼿抓住⼩⿏颈部⽪肤,轻压在实验台上,取侧卧位,左⼿⾷指尽量将⼩⿏眼周⽪肤往颈后压,使眼球突出。
⽤眼科弯镊迅速夹去眼球,将⿏倒⽴,⽤器⽫接住流出的⾎液。
采⾎完毕⽴即⽤纱布压迫⽌⾎。
每次采⾎量0.6~0.1ml。
3.⼼脏采⾎⼩⿏仰卧位固定,剪去胸前区被⽑,⽪肤消毒后,⽤左⼿⾷指在左侧第3~4肋间触摸到⼼搏处,右⼿持带有4~5号针头的注射器,选择⼼搏最强处穿刺,当刺中⼼脏时,⾎液会⾃动进⼊注射器。
每次采⾎量0.5~0.6ml。
4.断头采⾎右⼿⽤剪⼑剪断⼩⿏颈部约1/2~4/5,让⾎液流⼊试管。
此法可采⾎0.8~1.2ml。
三、⼩⿏给药1.⽪下注射给药将药液推⼊⽪下结缔组织,经⽑细⾎管、淋巴管吸收进⼊⾎液循环的过程。
作⽪下注射常选项背或⼤腿内侧的⽪肤。
操作时,常规消毒注射部位⽪肤,然后将⽪肤提起,注射针头取⼀钝⾓⾓度刺⼊⽪下,把针头轻轻向左右摆动,易摆动则表⽰已刺⼊⽪下,再轻轻抽吸,如⽆回⾎,可缓慢地将药物注⼊⽪下。

动物的采血方法动物的采血方法一、小鼠、大鼠的采血1.眼眶后静脉丛采血左手拇指及食指抓住鼠两耳之间的皮肤使鼠固定,并轻轻压迫颈部两侧,阻碍静脉回流,使眼球充分外凸。
右手持玻璃采血管,将其尖端插入内眼角与眼球之间,轻轻向眼底方向刺入,小鼠刺入2~3mm,大鼠刺入4~5mm,当感觉有阻力时即停止刺入,放置取血管以切开静脉丛,血流即流入取血管。
采血结束后,拔出取血管,放松左手,出血即停止。
本方法在短期内可重复采血。
小鼠一次可采血0.2~0.3ml,大鼠一次可采血0.5~1.01ml。
为防止血液在取血管中凝固,可将取血管进入1%肝素溶液,干燥后使用。
2.摘眼球采血此方法用于鼠类大量采血。
采血时,用左手固定动物,压迫眼球,尽量使眼球凸出,右手用弯头镊子摘除眼球,眼眶内很快流出血液。
二、兔的采血1.耳中央动脉、耳沿静脉采血左手固定兔,并用酒精棉球消毒采血部位,右手持注射器,在兔耳血管的末端,沿着与血管平行的向心方向刺入血管,即可见血液流入针管,注意固定好针头。
采血结束后,拔出注射器,用棉球压迫止血2~3min。
2.颈静脉采血将兔麻醉后,仰卧在固定台上固定,剪去一侧颈部被毛,用碘酒、酒精棉球消毒皮肤,手术刀轻轻划破皮肤,钝性分离静脉,颈静脉暴露后,用注射器针头沿血管平行的远心方向刺入,采血结束后,拔出注射器,缝合切口。
三、狗的采血1.前、后肢皮下静脉血此方法一次可取较多的血,操作可参照相应的静脉注射。
如需采少量血。
则可用5.5号针头直接刺入静脉。
如需采一定量的血,最好用静脉滴注针头与注射器连接,以防狗挣扎时针头刺破血管。
2.股动脉采血将狗仰卧后固定,伸展后肢向外拉直,暴露腹股沟,在腹股沟三角区动脉搏动的部位剪去被毛,用碘酒、酒精消毒。
左手中指、食指探摸股动脉搏动部位并固定好血管,右手区静脉滴注针,针头由动脉搏动处慢慢刺入,当血液流入针头后的朔料管时,固定好针头,连接好注射器可抽到大量血液。
3.心脏采血将狗仰卧固定,前肢向背侧方向固定,暴露胸部,剪去左侧第3~5肋间的被毛,用碘酒、酒精消毒皮肤。

动物血液的采集、抗凝及血清分离技术实验目的一、引言动物血液的采集、抗凝及血清分离技术是生物医学领域中常见的实验操作。
该技术可以用于研究动物体内的生理及病理过程,为疾病的诊断和治疗提供重要的实验数据。
本实验旨在探讨动物血液的采集、抗凝和血清分离技术的原理、方法及应用。
二、动物血液的采集1.实验目的在进行动物血液采集的过程中,首先要明确其实验目的。
动物血液的采集可以用于检测血液中的生化指标、病原体、药物浓度等。
因此,在进行血液采集之前,需要明确实验目的,以便确定采集的样本种类和数量。
2.采集方法(1)大动物的血液采集大动物如猪、狗等,可以通过耳静脉、颈静脉等部位进行血液采集。
在进行采血前,可以使用消毒纱布擦拭采血部位,并在采血时利用一次性注射针和血管采血管进行采血,以确保采血的安全和卫生。
(2)小动物的血液采集小动物如小鼠、大鼠等,可以通过尾静脉或颈部静脉进行血液采集。
在进行采血前,需要对小动物进行固定,使用专用的血管采血管进行采血。
在采集血液时,需要注意采血的数量,以免对动物的健康造成影响。
3.注意事项在进行动物血液采集时,需要严格遵守实验动物使用的伦理规范和操作规程。
同时,采血过程中需要注意消毒和安全,以免造成交叉感染和安全风险。
三、抗凝剂的选择和使用1.实验目的在进行动物血液采集后,需要选择适当的抗凝剂来保持血液的流动性,防止凝血。
抗凝血剂的选择和使用方法对血液样本的质量和稳定性具有重要影响。
因此,本实验旨在探讨抗凝剂的选择和使用方法。
2.抗凝剂的选择(1)EDTA-2KEDTA-2K是一种常用的抗凝剂,能够与血液中的钙离子结合,阻止凝血过程的发生。
在进行血液样本的细胞计数和分类时,常常使用EDTA-2K作为抗凝剂。
(2)肝素肝素是一种天然的抗凝剂,能够抑制凝血酶的活性,从而防止血液的凝固。
在进行凝血酶活性的检测和血栓病的研究时,常常使用肝素作为抗凝剂。
3.抗凝剂的使用方法在进行动物血液的抗凝处理时,需要根据实验目的选择适当的抗凝剂,将其加入到采集的血液样本中,并充分混匀。
小鼠含药血清的制备概述小鼠含药血清的制备是一种常用的实验手段,用于研究药物在小鼠体内的代谢、药效以及毒性等方面。
本文将介绍小鼠含药血清的制备方法及注意事项。
制备方法1. 实验材料准备•小鼠:合适的品种和体重的小鼠•药物:所需的研究药物•离心管:用于采集血液和离心操作•注射器和针头:用于给小鼠注射药物•离心机:用于离心操作•无菌一次性手套、口罩和洗涤液:保持实验的无菌环境2. 实验操作步骤2.1 小鼠药物给药1.将小鼠按照实验要求随机分组。
2.使用注射器和针头将药物按照实验方案注射给小鼠。
根据药物的性质,可以选择不同的给药途径,如静脉注射、腹腔注射、口服等。
3.在规定时间内观察小鼠的行为、体温、血压等指标,记录相关数据。
2.2 小鼠血液采集1.选择合适的时间点,将小鼠处于麻醉状态。
2.使用无菌注射器和针头,从小鼠的眼眶静脉或尾静脉采集血液。
注意血液采集的数量要根据实验需要,并避免过量采集导致小鼠死亡。
3.将采集的血液立即转移到预先准备好的离心管中。
注意操作的无菌性,尽量避免污染。
2.3 血液离心分离1.使用离心机将血液离心,以分离血浆或血清。
离心条件需要根据实验要求进行调整,一般为3000 rpm离心10分钟。
2.将得到的血浆或血清转移到无菌离心管中,并进行标记。
2.4 血清处理1.根据实验需要,对血清进行不同的处理,如冻存、分装等。
注意操作过程的无菌性,避免污染。
3. 实验结论通过上述步骤,我们成功制备了含药血清。
这种含药血清可以用于后续的实验操作,如药物浓度分析、生物活性评价等。
注意事项•实验操作需要在无菌条件下进行,以避免外源性污染对实验结果的影响。
•实验过程中需要尽量减少对小鼠的伤害,严格遵守动物实验伦理原则。
•注意药物给药的剂量、途径和时间等因素,以免对小鼠造成不必要的损伤。
•实验过程中应密切观察小鼠的生理状况,及时记录相关数据。
•血液采集后要及时进行离心分离,避免血液成分的变化对实验结果的干扰。
小鼠摘除眼球采血及分离血清
一.器材离心管,弯头镊子,离心机,移液器
二.步骤
1. 摘除眼球采血
(1)左手拇、食指抓取小鼠双耳及颈后皮肤,小指固定尾部;(2)中指将小鼠左侧前肢轻压在胸骨心脏部位,无名指按在腹部,捻动拇指,轻压取血侧眼部皮肤,使眼球充血突出;(3)用弯头镊夹取眼球;(4)根据需要捻动拇指与食指的方向,使血液从眼眶内以不同速度垂直流入离心管;(5)同时用左手中指轻按小鼠心脏部位,以加快心脏泵血速度;(6)当血液流尽时,用脱臼法处死小鼠。
2. 分离血清(1)将离心管中的血置37℃温箱或水浴1小时,也可室温2小时;(2)再置4℃冰箱内3~4小时或过夜;(3)待血液凝固血块收缩后,4000rpm离心10分钟;(4)取上清于干净的离心管中,保存于-20℃,或加入防腐剂(0.01%硫柳汞或0.02%叠氮钠),置4℃冰箱中保存备用。
三.注意: 1. 采血前,可给小鼠喂点水; 2. 摘眼球采血取血量能达0.8~1.2ml,但老年和疾病小鼠血量会降低;3. 采血场所有充足的光线;室温夏季保持在25~28℃,冬季,15~20℃为宜;4. 防止血液浸入眼部周围毛发,否则会造成污染和溶血; 5. 按压心脏时,用力一定要适度,若用力过度,一是会造成动物采血中途死亡,使采血不完全,二是有可能引起溶血现象发生,影响实验结果;6. 采血用的器材和试管必须保持清洁干燥;7. 采血时要防止小鼠挣扎,否则会损失比较多的血样;8. 血液凝固后不宜在4℃放置过久,否则会溶血。