第十章羧酸及其衍生物
- 格式:doc
- 大小:361.00 KB
- 文档页数:23



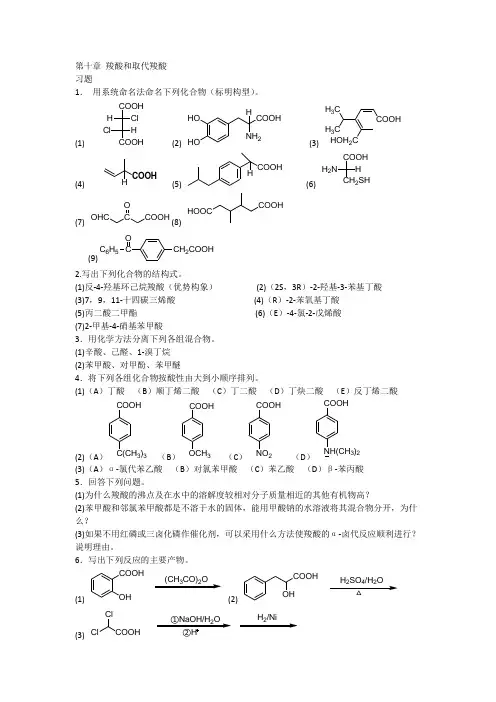
第十章羧酸和取代羧酸习题1.用系统命名法命名下列化合物(标明构型)。
(1){EMBED ChemDraw.Document.6.0 \* MERGEFORMAT |COOHCOOHClHHCl(2)(3)(4) (5) (6)(7) (8) (9)2.写出下列化合物的结构式。
(1)反-4-羟基环己烷羧酸(优势构象)(2)(2S,3R)-2-羟基-3-苯基丁酸(3)7,9,11-十四碳三烯酸(4)(R)-2-苯氧基丁酸(5)丙二酸二甲酯(6)(E)-4-氯-2-戊烯酸(7)2-甲基-4-硝基苯甲酸3.用化学方法分离下列各组混合物。
(1)辛酸、己醛、1-溴丁烷(2)苯甲酸、对甲酚、苯甲醚4.将下列各组化合物按酸性由大到小顺序排列。
(1)(A)丁酸(B)顺丁烯二酸(C)丁二酸(D)丁炔二酸(E)反丁烯二酸(2)(A)(B)(C)(D)(3)(A)α-氯代苯乙酸(B)对氯苯甲酸(C)苯乙酸(D)β-苯丙酸5.回答下列问题。
(1)为什么羧酸的沸点及在水中的溶解度较相对分子质量相近的其他有机物高?(2)苯甲酸和邻氯苯甲酸都是不溶于水的固体,能用甲酸钠的水溶液将其混合物分开,为什么?(3)如果不用红磷或三卤化磷作催化剂,可以采用什么方法使羧酸的α-卤代反应顺利进行?说明理由。
6.写出下列反应的主要产物。
(1) (2)(3)(4)(5) (6)(7) (8)(9) (10)7.下列化合物在加热条件下发生什么反应?写出主要产物。
(1)3-苯基-2-羟基丙酸(2)邻羟基苯乙酸(3)2-环戊酮羧酸(4)顺-β(邻羟基苯)丙烯酸(5)丁二酸(6)庚二酸8.用化学方法区别下列各组化合物。
(1)乙醇,乙醛,乙酸(2)水杨酸,2-羟基环己烷羧酸,乙酰水杨酸(3)甲酸,草酸,丙二酸(4)对甲基苯甲酸,对甲氧基苯乙酮,2-乙烯基-1,4-苯二酚9.指出下列反应式中存在的问题。
(1)(2)(3)(4)10.按由快到慢的次序排列下列醇或酸在酸催化下酯化时的速度。




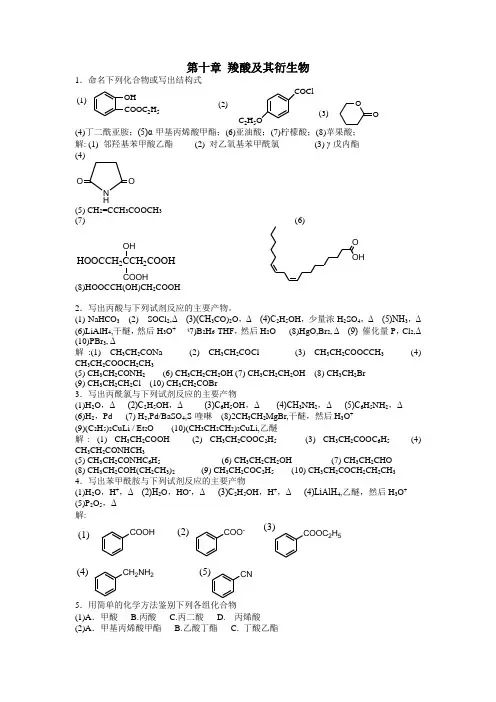
第十章 羧酸及其衍生物1.命名下列化合物或写出结构式 OHCOOC 2H 5(1)(2)COClC 2H 5OOO(3)(4)丁二酰亚胺;(5)α-甲基丙烯酸甲酯;(6)亚油酸;(7)柠檬酸;(8)苹果酸;解: (1) 邻羟基苯甲酸乙酯 (2) 对乙氧基苯甲酰氯 (3) γ-戊内酯 (4) N H OO(5) CH 2=CCH 3COOCH 3(7) (6)HOOCCH 22COOHOHCOOH O OH(8)HOOCCH(OH)CH 2COOH2.写出丙酸与下列试剂反应的主要产物。
(1) NaHCO 3 (2) SOCl 2,Δ (3)(CH 3CO)2O ,Δ (4)C 2H 5OH ,少量浓H 2SO 4,Δ (5)NH 3,Δ (6)LiAlH 4,干醚,然后H 3O + (7)B 2H 6-THF ,然后H 2O (8)HgO,Br 2, Δ (9) 催化量P ,Cl 2,Δ (10)PBr 3, Δ解:(1) CH 3CH 2CONa (2) CH 3CH 2COCl (3) CH 3CH 2COOCCH 3 (4) CH 3CH 2COOCH 2CH 3(5) CH 3CH 2CONH 2 (6) CH 3CH 2CH 2OH (7) CH 3CH 2CH 2OH (8) CH 3CH 2Br (9) CH 3CH 2CH 2Cl (10) CH 3CH 2COBr3.写出丙酰氯与下列试剂反应的主要产物(1)H 2O ,Δ (2)C 2H 5OH ,Δ (3)C 6H 5OH ,Δ (4)CH 3NH 2,Δ (5)C 6H 5NH 2,Δ (6)H 2,Pd (7) H 2,Pd/BaSO 4,S-喹啉 (8)2CH 3CH 2MgBr,干醚,然后H 3O + (9)(C 2H 5)2CuLi / Et 2O (10)(CH 3CH 2CH 2)2CuLi,乙醚解: (1) CH 3CH 2COOH (2) CH 3CH 2COOC 2H 5 (3) CH 3CH 2COOC 6H 5 (4) CH 3CH 2CONHCH 3(5) CH 3CH 2CONHC 6H 5 (6) CH 3CH 2CH 2OH (7) CH 3CH 2CHO (8) CH 3CH 2COH(CH 2CH 3)2 (9) CH 3CH 2COC 2H 5 (10) CH 3CH 2COCH 2CH 2CH 3 4.写出苯甲酰胺与下列试剂反应的主要产物(1)H 2O ,H +,Δ (2)H 2O ,HO -,Δ (3)C 2H 5OH ,H +,Δ (4)LiAlH 4,乙醚,然后H 3O + (5)P 2O 5,Δ 解:(1)(2)(3)(4)(5)COOHCOO -COOC 2H 5CH 2NH 2CN5.用简单的化学方法鉴别下列各组化合物(1)A .甲酸 B.丙酸 C.丙二酸 D. 丙烯酸(2)A .甲基丙烯酸甲酯 B.乙酸丁酯 C. 丁酸乙酯(3)A. 乙醇 B.乙醚 C.乙醛 D.乙酸(4) A. 水杨酸 B.苯甲酸 C.苯酚 D.苯甲醚 (5)A .丙酸 B.丙酰氯 C.丙酸乙酯 D.丙酰胺解: (1) 能使溴的四氯化碳溶液褪色的为丙烯酸;能发生银镜反应的为甲酸;加热能放出二氧化碳的为丙二酸(2) 能使溴的四氯化碳溶液褪色的为甲基丙烯酸甲酯;余下的两种物质在碱性条件下水解产物能使三氯化铁的溶液形成红棕色的为乙酸丁酯(3) 能溶于氢氧化钠溶液的为乙酸,能与金属钠反应的为乙醇;余下的能溶于浓硫酸的为乙醚 (4) 不溶于NaOH 溶液的为苯甲醚;不能与溴水产生沉淀的为苯甲酸;余下的两种物质能与NaHCO 3溶液反应的为水杨酸(5) 能使石蕊试纸变蓝的为丙酸,与硝酸银的水溶液有沉淀生成的为丙酰氯,加碱煮沸后放剌激性氨气的为丙酰胺,剩下的为丙酸乙酯 6.试比较下列化合物的酸性大小(1)A .C 2H 5OH B.CH 3COOH C.HOOCCH 2COOH D.HOOC-COOH (2) A.Cl 3CCOOH B.ClCH 2COOH C.CH 3COOH(3) A.CH 3COOH B.FCH 2COOH C.ClCH 2COOH D.CH 3OCH 2COOH (4) A.乙二酸 B.乙酸 C.苯甲酸 D.丙二酸(5)A.CH 3COOH B.C 6H 5OH C.C 2H 5OH D.CH≡CH(6) A.邻硝基苯甲酸 B.间羟基苯甲酸 C.对羟基苯甲酸 D.苯酚 (7)A .对甲氧基苯甲酸 B.对氯苯甲酸 C.苯甲酸 D.苯酚(8)A .CH 3COCH 2COCH 3 B.CH 2(COC 2H 5)2 C.CH 3COCH 2COOC 2H 5 D.CH 3COOC 2H 5(9)A B C D CH 3CH 2OHCH 3CH 2COC 2H 5OHCH 3CH 2CNH 2OH CH 3CH 23OH(10) A .乙酸 B.苯酚 C.三氟乙酸 D.氯乙酸 E.乙醇 F.丙酸 G.乙烯 H.乙炔 I 乙烷 解:(1) D>C>B>A (2) A>B>C (3) B>C>A>D (4) A>C>D>B (5) A>B>D>C(6) A>B>C>D (7) B>C>A>D (8) A>C>B>D (9)A>B>D>C (10) C>D>A>F>B>H>E>I>G 7.分离下列化合物(1)苯甲酸、苯酚、正丁醚和环已酮 (2)苯甲醚、苯甲酸和苯酚(3)2-辛醇、2-辛酮和正辛酸 解:(1)分别用NaHCO 3,NaOH,饱和的NaHSO 3溶液处理,使四者分开后分别提纯NaOHH +苯甲酸苯甲醚苯酚(2)苯甲醚苯甲酸钠酚钠水洗干燥蒸馏苯甲醚过滤结晶干燥蒸馏苯酚(3) 分别用NaHCO 3, 饱和的NaHSO 3溶液处理,使三者分开后分别提纯 8.写出下列化合物加热后生成的主要产物(1)α-甲基-α-羟基丙酸 (2)β-羟基丁酸 (3)β-甲基-γ-羟基戊酸 (4)δ-羟基戊酸 (5)乙二酸 (6)已二酸 (7)庚二酸 (8)戊二酸解: (1) (2) CH 3CH=CHCOOH (3)OO OOH 3C CH 3OH 3CO(4) (5) HCOOH (6)oOO(7) (8)OOO O 9.把下列各组化合物按碱性强弱排列成序(1)A.CH 3CONH 2 B.CH 3CONHCH 3 C.CH 3CONHC 6H 5 D.邻苯二甲酰亚胺 (2)A .CH 3CONH 2 B.CH 3CON(CH 3)2 C.NH 3 D.丁二酰亚胺 (3)A .HOCH 2COO - B.H 3N +CH 2COO - C.HSCH 2COO -(4) A. CH 3CH 2COO - B.CH 3CH 2O - C.(CH 3)3CO - D.CH≡C - E.CH 3CH 2- F.CH 2=CH -(5) ACCHCOCF 3O ..CCHCOCH 3O ..H 3C 3O ..BC 解: (1) B>A>C>D (2) C>B>A>D (3) A>C>B (4) F>E>C>.B>D>A (5) C>B>A 10.把下列各组化合物按反应活性大小排列成序(1)与乙酸酯化:A.CH 3CH 2OH B.CH 3OH C.CH 3CH 2CH 2OH D.(CH 3)2CHCH 2OH (2) 与丙醇酯化:A.CH 3COOH B.(CH 3)2CHCOOH C.CH 3CH 2CH 2COOH D.(CH 3)3CCOOH(3) 与甲醇反应:A.CH 3CH 2COOC 2H 5 B.CH 3CH 2COCl C.CH 3CH 2CONH 2 D.(CH 3CH 2CO)2O(4) 碱水解:A.(CH 3)3CCOOCH 3 B.CH 3COOCH 3 C.(CH 3)2CHCOOCH 3 D.CH 3CH 2COOCH 3 (5) 与甲醇酯化:A COOHH 3CCOOHCH 3H 3CB COOHCOOH CH 3H 3CCH 3CD(6)烯醇化反应: A.CH 3COCH 2COOC 2H 5 B.CH 3COCH 2COCH 3C.CH 3COCH(C 2H 5)COOC 2H 5D.CH 3COC 2H 5E.CH 3COOC 2H 5解: (1) B>A>C>D (2) A>C>B>D (3) B>D>A>C (4) B>D>>C>A (5) C>A>B>D (6) B>A>C>E>D 11.完成下列反应 CH 3CH 2CH 2CH=CH 2?SOCl 2?CH 3COONa?(1)CH 2COOHO 2N?CHCOOH O 2NC 2H 5OH 24?(2)HOOCCH 2CHCH 2COOH3???CH 3OHSOCl 2(3)(4)OHH 2,Pt?HNO 33CH 2MgBr300℃?3?(5)C 6H 5CHCHCOOHKMnO △?HNO 324(6)H 3CCOOH(7)CH 3COONa+O 2NCH 2Br(10)(CH 3)2CHCH 2CH 2OH KMnO 4△???PCl 5NH 325(11)KMnO 4△??Ba(OH)2△水杨酸(12)?CH 2=CH 2Br 2?H 3O??NH 32??(13)2NaCN丁二酸LiAlH 4?H(14)+(CH 3CO)2O COONa HBr ?CH 2Br 2P ????(16)NaOH NaCNH 3O +=?o =OO?H +?(17)CH 3CH=CH 2HBr?(CH 3)2CHMgBr ??H 2(CH 3)2CHCOOHPCl 3NH 3NaOBr (18)(19)CH 3?H 3C NO 2?O 2NCOOHPCl 5?333(20)CH 2?CH 2COOH?C 2H 5OHC 2H 5ONa 32?C 2H 5ONa 25?稀NaOH,H 2???(21)H 2C C O H 2O(22)CHO+?OH △C H3O ?CH COCH COOC H C 2H 5ONa,C 2H 5OH?(8)油酸(23)O??COOHC2H5(24) 2CH3COOC2H5(1)C2H5ONa(2) H ?NaH?NaOH,H2O??H+??解:(1)CH3CH2CH2COOH CH3CH2CH2COCl CH3CH2CH2COOOCCH3(2)Cl2 , P CHCOOC2H5O2NHOOCCH2CHCH2COOCH33(3)OOOH3CClOCCH2CHCH2COOCH33(4)HOOCCH2CH2CH2CH2COOHOHO HO CH2CH3 COOH(5)(6)H3C COOHO2N(7)O2N CH2OOCCH3(8)CH3(CH2)7COOH + HOOC(CH2)7COOH(10)(CH3)2CHCH2COOH(CH3)2CHCH2COCl(CH3)2CHCH2CONH2(CH3)2CHCH2CN(11)COOHCOOHO(12)OHCOOHBrCH2BrCH2Br(13)NCCH2CH2CN HOOCCH2CH2COOHoooHOOCCH2CH2CONH2(14)HOCH2CH2CH2CH2OHO(15)2COOH2COOH CHBrCOOH(16)CHBrCOONa CHCNCOONa CH(COOH)2(17)CH3CO3H HOOCCH2CH2CH2CH2CH2OHNaOOCCH2CH2CH2CH2CH2OHCH 3CHBrCH 3(18)22(CH 3)2CClCOOH(CH 3)2CClCONH 2(CH 3)2CClNH 2(19)+O 2NCOClO 2NCHO(20)ROOR NaCN 2CH 2Br(21)CH 3COCH 2COOC 2H 5CH H 3C H 3CCHCOOC 2H 5COCH 3CH H 3CH 3C C2H 5COCH 3C 2H 5CH H 3CH 3CC COOHCOCH 3C 2H 5CH H 3CH 3C CH 2H 5COCH 3(22)CH 3COCH 3CC 6H 5HC=HC H 3CC COOC 2H 5COCH 3(23)HCNC 2H 5Na/C 2H 5Br2CNCH 3COCH 2COC 2H 5(24)CH 3COCHCOC 2H 5Na +-CH 3COCHCOC 2H 53)2CH 3COCHCOONa3)2CH 3COCHCOOH3)2CH 3COCH 2COCH(CH 3)213. 由指定原料合成下列化合物 (1)乙炔─→丙烯酸甲酯(2)异丙醇─→α-甲基丙烯酸甲酯 (3)丁酸─→乙基丙二酸 (4)乙烯─→β-羟基丙酸(5)对甲氧基苯甲醛─→α-羟基对甲氧基苯乙酸 (6)丁酸─→丙酸 解:HC CHNaCNHClCH 2=CHClCH 2=CHCNH /H 2OCH 2=CHCOOHH 2SO 4 , CH 3OHCH 2=CHCOOCH 3(1)H3CCCHNaNH 2 , NH 3NaCNH /H 2OH 2SO 4 , CH 3OH(2)CH 3CHOHCH 3CH 3CH=CH 2Br 2CH 3CHBrCH 2Br +2ROOR CH 3CH=CHBrCH 3CH=CHCNCH 3CH=CHCOOHCH 3CH=CHCOOCH 3NaCNH +/H 2O(3)CH 3CH 2CH 2COOHP , Cl 2CH 3CH 2CHClCOOHCH 3CH 2CHCNCOOHHOOCCHCOOHCH 2CH 3NaCNH +/H 2O(4)CH 2=CH 2Cl 2 , H 2OCH 2ClCH 2OH HOCH 2CH 2CNHOCH 2CH 2COOHH /H 2O(5)H 3COCHOH 3COCHOHCNHCNH 3COCHOHCOOH(6)CH 3CH 2CH 2COOHLiAlH 4CH 3CH 2CH 2CH 2OH CH 3CH 2CH=CH 2KMnO 4 , H +CH 3CH 2COOH14.由乙酰乙酸乙酯作为原料之一合成下列化合物。

第十章羧酸及其衍生物羧酸及其衍生物❖羧酸及其衍生物的结构特征;❖羧酸及其衍生物的物理和化学性质;❖乙酰乙酸乙酯和丙二酸酯的特性及其在有机合成上的应用;❖蜡和油脂,碳酸衍生物重点要求掌握羧酸及其衍生物的化学性质;乙酰乙酸乙酯在有机合成上的应用。
10.1 羧酸10.1.1 羧酸的构造、分类和命名1、羧酸的构造和分类分子中具有羧基的化合物,称为羧酸。
它的通式为 RCOOH。
2、命名由它的来源命名:甲酸最初是由蚂蚁蒸馏得到的,称为蚁酸。
乙酸最初是由食用的醋中得到,称为醋酸。
还有草酸、琥珀酸、苹果酸、柠檬酸。
系统命名:含羧基最长的碳链作为主链,根据主链上碳原子数目称为某酸.编号从羧基开始.3,4-二甲基戊酸3-甲基-2-丁烯酸芳香族羧酸可以作为脂肪酸的芳基取代物命名:羧酸常用希腊字母来标名位次,即与羧基直接相连的碳原子为α,其余位次为β、γ…,距羧基最远的为ω位。
二元酸命名:10.1.2 羧酸的物理性质在室温下10个碳原子以下的饱和一元羧酸是液体。
10个碳原子以上的羧酸为石蜡固体,挥发性很低,无气味。
4~9个碳原子的脂肪酸具有腐败恶臭、动物的汗液和奶油发酸变坏的气味。
饱和一元羧酸的沸点比相对分子质量相似的 醇还要高。
饱和一元羧酸的熔点随分子中碳原子数目的增加呈锯齿状的变化。
低级脂肪酸易溶于水,但随分子量的增高而降低。
甲酸与水通过氢键缔合在固态和液态,羧酸主要以二聚体形式存在。
低级的羧酸,在气相时仍以双分子缔合状态存在。
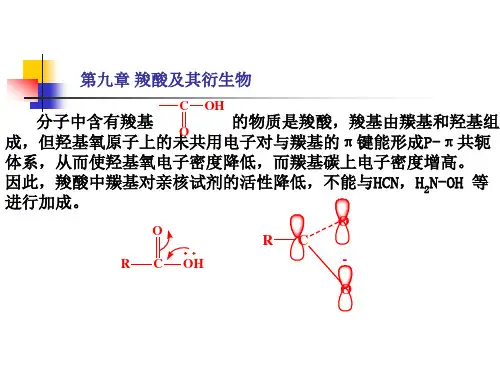
10.1.3 羧酸的化学性质OOH H HOH O HH HHOCRCOOHOORHO ORHCC2HOR H O HC Cα10.1.3.1 酸性羧酸具有弱酸性,在水溶液中存在着如下平衡:乙酸的离解常数K a 为1.75×10-5 甲酸的K a =2.1×10-4 , p Ka =3.75其他一元酸的K a 在1.1~1.8×10-5之间, p Ka 在4.7~5之间。
第13章 羧酸学习要求:1. 掌握羧基的结构和羧酸的化学性质2. 掌握诱导效应和共轭效应对羧酸酸性的影响 3. 掌握羧酸的制备方法以及重要的羧酸的主要用途 4. 掌握二元羧酸取代羧酸的特性反应分子中含有羧基(-COOH )的一类化合物称为羧酸(Carboxylic acid )。
羧基是羰酸 的官能团。
除甲酸外,羧酸可看作是烃的羧基衍生物,其通式为:按羧基所连的烃基种类不同,羧酸可分为脂肪族羧酸、脂环族羧酸和芳香族羧酸。
按烃基是否饱和,可分为饱和羧酸和不饱和羧酸。
按羧酸分子中所含羧基的数目不同,又可分为一元羧酸、二元羧酸、三元羧酸等。
二元及二元以上羧酸统称为多元羧酸。
羧基中的碳原子也是sp 2杂化方式成键的,它用三个sp 2杂化轨道分别与-OH的氧原子,羰基的氧原子和一个烃基的碳原子(也可以是一个氢原子)以σ键相结合,且这三个σ键在同一平面内。
羰基碳原子上未参与杂化的p 轨道与羰基氧原子的p 轨道相互交盖而形成π键。
-OH氧原子上的带有未共用电子对的p 轨道可以与π键形成p -π共轭体系,发生电子离域。
RH..13.1 羧酸的物理性质甲酸、乙酸、丙酸是具有刺激性臭味的液体,丁酸至壬酸是具有腐败气味的油状液体,癸酸以上的正构羧酸是无臭的固体。
脂肪族二元羧酸和芳香族羧酸都是结晶固体。
由于羧酸是个亲水基团,可和水形成氢键。
甲酸至丁酸能与水混溶。
从戊酸开始随相对分子质量增加,分子中非极性烃基增大,水溶性迅速降低。
癸酸以上的羧酸不溶于水。
脂肪族一元羧酸一般都能溶于乙醇、乙醚、氯仿等有机溶剂中。
低级的饱和二元羧酸也可溶于水,并随碳链的增长而溶解度降低。
芳酸的水溶性极微。
饱和一元脂肪酸,除甲酸、乙酸的相对密度大于1外,其它羧酸的相对密度都小于1。
二元羧酸和芳酸的相对密度都大于1。
饱和一元羧酸的沸点随相对分子质量的增加而增高。
羧酸的沸点比相对分子质量相同或相近的醇的沸点高。
例如,甲酸和乙醇的相对分子质量均为46,而甲酸的沸点为100.7℃,乙醇的沸点为78℃;又如乙酸和丙醇的相对分子质量均为60,而乙酸的沸点为118℃,正丙醇的沸点为97.2℃。
这是由于羧酸分子之间能由两个氢键互相结合形成双分子缔和二聚体。
在固态和液态,羧酸主要以二聚体形式存在。
据物理方法测定证明,甲酸、乙酸等低级的羧酸,在气相时仍以双分子缔和状态存在。
ORCO HOO C RH羧酸的熔点随着碳原子数的增加而呈锯齿状上升。
含偶数碳原子的羧酸的熔点比相邻两个奇数碳原子的羧酸的熔点高。
如图13-1。
这是因为偶数碳原子的羧酸分子的对称性较高,晶体排列比较紧密的缘故。
RCOH O芳酸一般具有升华性,有些能随水蒸汽挥发。
一些羧酸的物理常数见表13-1所示。
表13-1 一些羧酸的名称和物理常数*在13332Pa。
13.2 羧酸的化学性质羧酸的主要化学反应都发生在羧基官能团上或受羧基影响较大的α-碳原子上。
根据羧酸分子结构中键的断裂方式不同而发生不同的反应,可表示如下:①O-H键断裂而表现出酸性②-OH被取代的反应③羰基的亲核加成反应④C-C键断裂发生脱羧反应。
⑤α-H的取代反应。
13.2.1 羧酸的酸性1.酸性与成盐羧酸呈明显的酸性。
在水溶液中,羧基中的氢氧键断裂,离解出的氢离子能与水结合成为水合氢离子。
RCOOH-+H2O RCOO一般羧酸的pKa约在4~5之间,属于弱酸,但比碳酸的酸性(pKa=6.5)要强些。
所以羧酸可与Na2CO3或NaHCO3溶液发生反应,而苯酚(pKa=10)不能发生反应,因此可利用这个性质来分离或鉴别酚和羧酸。
一些羧酸的pKa值可见表13-1。
羧酸与碳酸氢钠(或碳酸钠、氢氧化钠)的成盐反应如下:RCOOH+NaHCO3RCOONa+CO2+H2O 加入无机强酸又可以使盐重新变为羧酸游离出来。
R CHHCOO H②③④⑤RCOONa+HCl RCOOH+NaCl因此可利用上述性质使羧酸与不溶于水的或易挥发的物质分离。
各类羧酸盐有广泛的应用,如醋酸钾可用作脱水剂、纤维处理剂、分析化学试剂,以及用作青霉素培养基和其它药用;醋酸锰可用作乙醛和二甲苯的氧化催化剂、纤维染色氧化催化剂、媒染剂、涂料和清漆的干燥剂;醋酸锌主要用作有机合成的催化剂,也可用于印染的媒染剂和木材的防腐剂,在医药上用于收敛剂、消毒剂和防腐剂;醋酸钴主要用作催化剂,还可用于制造油漆的干燥剂、玻璃固化促进剂及隐显墨水等;醋酸铅在医学、农药、染料、涂料等行业中有大量的应用,等等。
羧酸呈现酸性,一方面是由于羧基中的羟基氧原子上带未共用电子对的p轨道可以与羰基的碳氧π键形成p-π共轭体系,羟基氧上的未共用电子对发生离域,使羟基O-H键减弱,使它易离解成负离子和质子。
另一方面,羧酸解离后形成的羧酸根负离子,由于p-π共轭效应,使氧上带的负电荷被平均分散在它的两个氧原子上。
由于负电荷得到分散,羧酸根负离子是比较稳定的。
实验已证明羧酸根负离子的结构和原来羧酸中羧基的结构有所不同,两个碳氧键是等同的,这种结构可以用下列共振结构式表示:21R CO -OR COO -R COO----21根据X射线研究表明,在甲酸根负离子中,两个碳氧键的键长是一样的,都等于0.127nm。
甲酸的C=O键长为0.120nm,C-O键长为0.134nm,这说明在甲酸根负离子中已没有一般的碳氧双键和碳氧单键,由于电子的离域而发生键长的平均化,两个碳氧键是完全相同的。
2.影响酸性的因素不同结构的羧酸其酸性强弱不同。
表13-2列出了部分羧酸的pKa值。
表13-2 某些羧酸和卤代羧酸的pKa值影响羧酸酸性强弱的因素很多,其中主要是电子效应和空间效应,溶剂和温度也是不可忽视的因素。
从表13-2中的数据可以看出:羧酸分子烃基上的氢原子被氯原子取代后,其酸性增强。
氯乙酸的酸性(pKa=2.86)远比于乙酸(pKa=4.74)强,这是因为氯原子的电负性较大,是个吸电子基,由于氯原子吸电诱导效应,使羟基氧原子上的电子云向氯原子方向偏移,有利于质子的解离,使酸性增强。
由于同样的原因,使羧酸根负离子稳定,也有利于质子的解离,酸性增强。
ClCOOClCO-+H+从表13-2还可以看出:羧酸分子中引入氯原子的数目愈多,吸电子诱导效应愈强,酸性也愈强;氯原子距羧基的位置愈近,对羧基的影响愈大,酸性愈强。
诱导效应是沿着σ键由近及远传递的一种电子效应(这种传递常用箭头表示),随着传递距离的增加而减弱,一般超过3个原子后影响就不明显了。
羧酸分子中引入的取代原子电负性愈强,吸电子诱导效应愈强,酸性愈强。
羧酸分子中引入供电子基团后,由于供电子诱导效应使酸性减弱。
乙酸的酸性比甲酸弱,因为甲基具有供电子性。
HCO OH CH 3O从表13-1中还可以看出:苯甲酸的酸性(pKa=4.19)比HCOOH 的酸性弱(pKa=3.77),是由于苯基具有吸电诱导效应和供电共轭效应,且供电共轭效应大于吸电诱导效应,因此苯基对羧基有供电子能力,使苯甲酸的酸性比HCOOH 弱。
但是在生成苯甲酸根时,由于苯环对这个负离子的稳定化作用,却使苯甲酸的酸性比乙酸、丙酸和苯乙酸强:HCOOH CH 3COOH CH 3CH 2COOH C 6H 5COOH C 6H 5CH 2COOHpKa 3.77 4.76 4.84 4.17 4.13取代苯甲酸的酸性不仅与取代基的种类有关,而且与取代基在苯环上的位置有关(见表13-3)。
表13-3 取代苯甲酸(Y —C 6H 4—COOH )的pKa 值(25℃)从表中的间位和对位取代基对羧酸酸性的影响可以看到,取代基的吸电子作用(-I,-C 效应)使酸性增强,而取代基的供电子作用(+I,+C)则使酸性减弱.邻位取代基对取代苯甲酸的酸性影响,除了有基团的电子效应外,还有基团的场效应(field effect)、立体效应(stericeffect )、氢键的形成等因素,总称为邻位效应(ortho effect )。
如邻位的CH 3 、C 2H 5 由于空间的拥挤,取代基破坏了羧基与苯环的共平面性,苯环对羧基的+C 效应减弱甚至消失,使其酸性接近甲酸,这种立体效应使酸性比间位或对位取代的苯甲酸强。
另外,具有强吸电子作用的邻位取代基(如F 2,NO 2),由于它可在空间上对羧酸根施加空间诱导作用(通称场效应),使羧酸根上的负电荷通过空间场直接分散到邻位的吸电基上,结果使羧酸根的稳定性增加,因此使该取代酸的酸性比其间位和对位异构体的强。
有的邻位取代苯甲酸,如邻羟基苯甲酸(水杨酸),由于羧酸根负离子与相邻的羟基可以通过形成氢键而使其稳定性增强,所以邻羟基苯甲酸的酸性也比其间位和对位异构体都强。
苯二甲酸的三个异构体中,以邻苯二甲酸的pKa 1为最小,其pKa 2为最大,这种情况也13.2.2羧酸衍生物的生成羧酸分子中羧基上的羟基被卤素(—X )、酰氧基 RCO O、烷氧基(—OR )及氨基(—NH 2)取代分别生成酰卤、酸酐、酯和酰胺等羧酸衍生物(Carboxylicacid derivatives )。
1. 酰氯的生成羧酸与三氯化磷、五氯化磷或亚硫酰氯反应,可生成酰氯。
RCOHO OSO 2SOCl RCOH O PCl RCCl O POCl RCOH O PCl RCCl OH 3PO 3+++HCl+++3+酰氯非常活泼,极易水解,所含无机杂质不能水洗除去,只能用蒸馏方法分离。
在选择氯化剂时,要注意产物与副产物的沸点差距,差距较大有利于产物的分离提纯。
通常是用PCl 3 来制备沸点较低的酰氯,而用PCl 5制备具有较高沸点的酰氯。
例如:CH 3COOH3+PCl 33CH 3COCl+H 3PO 3bp:118℃75℃52℃亚硫酰氯在实验室中常用来制备酰氯(也用于制备氯代烷),由于生成的HCl 和SO 2可从反应体系中移出,所以反应的转化率很高,酰氯的产率也高达90%以上。
但由于使用SOCl 2过量,应当在制备与它有较大沸点差别的酰氯中使用,以便于蒸馏分离。
例如:CH 3(CH 2)4COOH +SOCl CH 3(CH 2)4COCl ++bp:205℃76℃153℃生成的酸性气体HCl 和SO 2要回收或吸收,以避免造成对环境的污染。
芳香族酰氯一般是由五氯化磷或亚硫酰氯与芳酸作用制取的。
芳香族酰氯的稳定性较好,在水中发生水解反应缓慢。
苯甲酰氯是常用的苯甲酰化试剂。
COOH+PCl5COCl+POCl 3+HClbp: 249℃ 197℃105℃2.酸酐的生成羧酸在脱水剂(如乙酸酐或五氧化二磷等)的作用下,两分子羧酸脱去一分子水生成酸酐。
RCOH O HOCRO P 2O 5O OO +有些二元酸,如丁二酸、戊二酸等,只需加热,分子内就可脱水形成五元环或六元环的酸酐,而不必使用脱水剂,这是由于五、六元环稳定,容易形成的缘故。