19届高考化学总复习第3章金属及其化合物学案三无机化学工艺流程配套练习
- 格式:pptx
- 大小:625.56 KB
- 文档页数:15

2019高考化学总复习第三章金属及其化合物3-4-2 考点二金属材料与金属矿物的开发和利用学后即练新人教版编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2019高考化学总复习第三章金属及其化合物3-4-2 考点二金属材料与金属矿物的开发和利用学后即练新人教版)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2019高考化学总复习第三章金属及其化合物3-4-2 考点二金属材料与金属矿物的开发和利用学后即练新人教版的全部内容。
3-4—2 考点二金属材料与金属矿物的开发和利用1.下列关于金属冶炼方法的叙述不正确的是()解析:钠一般是由电解熔融NaCl的方法来制取,而电解饱和食盐水得到的是NaOH、H2和Cl2。
答案:D2.工业上制备下列金属,采用的化学反应原理正确的是( )A.钾:K2O+H2===2K+H2OB.钙:CaO+C错误!Ca+CO↑C.锰:3MnO2+4Al错误!3Mn+2Al2O3D.汞:HgS错误!Hg+S解析:钾为活泼金属,不可以用H2还原法制取,A项错误;钙的工业制法与镁相似,电解熔融的氯化钙,B项错误;工业制取Mn用还原法,单质Al与二氧化锰发生置换反应,C项正确;汞单质的制取用加热分解法,分解HgO得到Hg单质,D项错误。
答案:C3.用自然资源生产部分材料,其产品流程示意图如图所示:下列有关说法正确的是( )A.制取铝也可用电解熔融AlCl3的方法B.由赤铁矿冶炼生铁时,发生的反应既有吸热反应,又有放热反应C.粗铜精炼时往往以粗铜作电解池的阴极D.将MgCl2溶液加热浓缩、冷却结晶、过滤,即可得到氯化镁晶体解析:AlCl3属于共价化合物,熔融状态下不能导电,故无法通过电解熔融AlCl3的方法制取金属铝,A项错误;冶炼生铁时发生反应C+O2错误!CO2(放热反应)、C+CO2错误!2CO(吸热反应)、3CO+Fe2O3错误!2Fe+3CO2(吸热反应),B项正确;粗铜精炼时应以粗铜作阳极,C项错误;MgCl2在溶液中会水解生成Mg(OH)2,若直接将溶液加热浓缩、冷却结晶将得不到氯化镁晶体,需在加热浓缩时向溶液中滴加浓盐酸,防止Mg2+水解,D项错误。
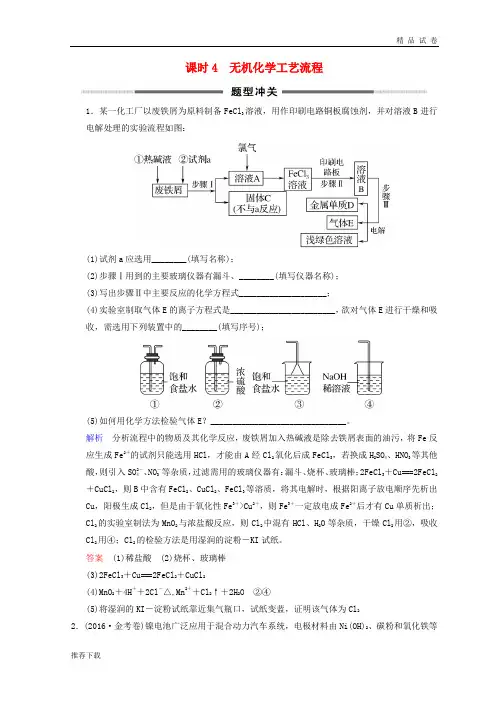
课时4 无机化学工艺流程1.某一化工厂以废铁屑为原料制备FeCl3溶液,用作印刷电路铜板腐蚀剂,并对溶液B进行电解处理的实验流程如图:(1)试剂a应选用________(填写名称);(2)步骤Ⅰ用到的主要玻璃仪器有漏斗、________(填写仪器名称);(3)写出步骤Ⅱ中主要反应的化学方程式____________________;(4)实验室制取气体E的离子方程式是________________________,欲对气体E进行干燥和吸收,需选用下列装置中的________(填写序号);(5)如何用化学方法检验气体E?_______________________________。
解析分析流程中的物质及其化学反应,废铁屑加入热碱液是除去铁屑表面的油污,将Fe反应生成Fe2+的试剂只能选用HCl,才能由A经Cl2氧化后成FeCl3,若换成H2SO4、HNO3等其他酸,则引入SO2-4、NO-3等杂质,过滤需用的玻璃仪器有:漏斗、烧杯、玻璃棒;2FeCl3+Cu===2FeCl2+CuCl2,则B中含有FeCl2、CuCl2、FeCl3等溶质,将其电解时,根据阳离子放电顺序先析出Cu,阳极生成Cl2,但是由于氧化性Fe3+>Cu2+,则Fe3+一定放电成Fe2+后才有Cu单质析出;Cl2的实验室制法为MnO2与浓盐酸反应,则Cl2中混有HCl、H2O等杂质,干燥Cl2用②,吸收Cl2用④;Cl2的检验方法是用湿润的淀粉-KI试纸。
答案(1)稀盐酸(2)烧杯、玻璃棒(3)2FeCl3+Cu===2FeCl2+CuCl2(4)MnO2+4H++2Cl-△,Mn2++Cl2↑+2H2O ②④(5)将湿润的KI-淀粉试纸靠近集气瓶口,试纸变蓝,证明该气体为Cl22.(2016·金考卷)镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉和氧化铁等涂在铝箔上制成。
由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行回收研究,设计实验流程如下:已知:a.NiCl2易溶于水,Fe3+不能氧化Ni2+。

第三章 金属及其化合物考点一 钠的性质与应用一、5个关键字记牢钠的物理性质 1.软——质软,硬度小。
2.亮——银白色,有金属光泽。
3.轻——ρ(H 2O)>ρ(Na)>ρ(煤油)。
4.低——熔点低,低于100 ℃。
5.导——可导电、导热。
[注意] (1)钠的质地柔软,可以用小刀切割。
(2)钠通常保存在煤油中。
二、从原子结构认识钠的化学性质——还原性1.钠与非金属单质反应 (1)与O 2反应(2)与Cl 2反应的化学方程式:2Na +Cl 2=====△2NaCl 。
(3)与S 反应的化学方程式:2Na +S=====△ Na 2S 。
[思考1] 金属钠长期露置于空气中,最终得到的白色粉末是什么? 提示:碳酸钠;转化过程为银白色金属钠――→O 2表面变暗(生成Na 2O) ――→H 2O 出现白色固体生成――→H 2O 出现液滴潮解――→CO 2白色块状物质(生成Na 2CO 3·10H 2O) ――→风化白色粉末状物质(生成Na 2CO 3)2.钠与水、盐溶液的反应 (1)钠与水的反应①钠与水反应的离子方程式:2Na +2H 2O===2Na ++2OH -+H 2↑。
②钠与水(含酚酞)反应的实验现象及解释:(2)钠与盐溶液的反应Na ――→先与水反应NaOH ――→再与盐溶液是否发生复分解反应 如钠投入CuSO 4溶液中,反应的离子方程式为2Na +2H 2O +Cu 2+===2Na ++Cu(OH)2↓+H 2↑。
钠投入BaCl 2溶液中,反应的化学方程式为2Na +2H 2O===2NaOH +H 2↑。
3.钠与盐酸的反应离子方程式为2Na +2H +===2Na ++H 2↑。
[思考2] (1)钠着火时,能否用水灭火?(2)将大小相同的钠块分别投入到①水,②乙酸,③乙醇中,反应剧烈程度由大到小的顺序是____________。
提示:(1)不能;因为钠能与水剧烈反应,且钠着火生成的Na 2O 2也与水反应,应用干燥沙土盖灭。


2019版高考化学总复习第3章金属及其重要化合物第3节铁及其重要化合物高考真题实战新人教版编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2019版高考化学总复习第3章金属及其重要化合物第3节铁及其重要化合物高考真题实战新人教版)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2019版高考化学总复习第3章金属及其重要化合物第3节铁及其重要化合物高考真题实战新人教版的全部内容。
第3节铁及其重要化合物1.有关铁及其化合物的说法正确的是()A.(2016·高考全国卷Ⅰ,10C)配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释B.(2016·高考全国卷Ⅱ,13A)将NaOH浓溶液滴加到饱和FeCl3溶液中,制备Fe(OH)3胶体C.(2016·高考全国卷Ⅲ,7B)利用铁比铜金属性强的性质,可用FeCl3腐蚀Cu刻制印刷电路板D.(2016·高考上海卷)Fe与Cl2反应生成FeCl3,推测Fe与I2反应生成FeI3解析:选A。
A项,在溶液中铁离子极易发生水解反应,产生难溶性的氢氧化铁,为了抑制铁离子的水解,应该先将氯化铁溶解在较浓的盐酸中,然后再加水稀释到相应的浓度,正确;B项,制备Fe(OH)3胶体,应将饱和氯化铁溶液滴入沸水中,错误;C项,铁离子与铜反应生成铜离子和亚铁离子,利用的是铜的还原性比亚铁离子的还原性强的性质,错误;D项,因I2的氧化性较弱,故与铁反应生成FeI2,错误。
2.(2016·高考上海卷)下列各组混合物,使用氢氧化钠溶液和盐酸两种试剂不能分离的是( )A.氧化镁中混有氧化铝B.氯化铝溶液中混有氯化铁C.氧化铁中混有二氧化硅D.氯化亚铁溶液中混有氯化铜解析:选D。

2019届高考化学总复习第3章金属及其化合物第4讲金属材料与金属矿物的开发利用配套练习新人教版编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2019届高考化学总复习第3章金属及其化合物第4讲金属材料与金属矿物的开发利用配套练习新人教版)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2019届高考化学总复习第3章金属及其化合物第4讲金属材料与金属矿物的开发利用配套练习新人教版的全部内容。
第4讲金属材料与金属矿物的开发利用【2019·备考】最新考纲:1.了解常见金属活动顺序。
2。
了解合金的概念及其重要应用。
3。
了解铜及其重要化合物的制备方法。
4.掌握铜及其重要化合物的主要性质及其应用。
考点一铜及其化合物(频数:★☆☆难度:☆☆☆)1.铜的性质(1)物理性质:铜是紫红色金属,具有良好的导电性、导热性和延展性.(2)化学性质写出图中有关反应的化学方程式或离子方程式:①2Cu+O2+CO2+H2O===Cu2(OH)2CO3②2Cu+S错误!Cu2S2.铜的重要化合物(1)氧化铜和氧化亚铜名称氧化铜氧化亚铜颜色黑色砖红色与酸反应(H+)CuO+2H+===Cu2++H2O Cu2O+2H+===Cu2++Cu+H2O与H2反应CuO+H2错误!Cu+H2O Cu2O+H2错误!2Cu+H2O转化关系4CuO错误!2Cu2O+O2↑(2)氢氧化铜a.物理性质:蓝色不溶于水的固体。
b.化学性质及应用反应①的化学方程式:Cu(OH)2错误!CuO+H2O;反应②的化学方程式:Cu(OH)2+2H+===Cu2++2H2O。
(3)铜盐①C u2(OH)2CO3的名称为碱式碳酸铜,是铜绿、孔雀石的主要成分,是铜在潮湿空气中被腐蚀的结果,其受热分解的化学方程式为Cu2(OH)2CO3错误!2CuO+H2O+CO2↑.②CuSO4·5H2O为蓝色晶体,俗称蓝矾、胆矾,其受热分解的化学方程式为CuSO4·5H2O错误!CuSO4+5H2O,蓝色晶体受热转化为白色粉末.无水CuSO4遇水变蓝色(生成CuSO4·5H2O),据此可用来检验水的存在。

学案三 无机化学工艺流程【教学目标】1.使学生了解化学工艺流程题的常见题型。
2.掌握化学工艺流程题的分析方法和技巧。
3.培养学生发散、联想、归纳、整合、提炼知识的能力。
【教学重点】 化学工艺流程题的分析方法和技巧。
【教学难点】 隐含信息的挖掘和计算能力的提升。
【考情分析】1.工艺流程题过程解读(1)读流程图①箭头:箭头进入的是投料(反应物)、出去的是主产物或副产物(生成物)。
②三线:出线和进线均表示物料流向或操作流程,可逆线表示物质循环。
(2)解题要点①审题要点:a.了解生产目的、原料及产品,b.了解题目提供的信息,c.分析各步的反应条件、原理及物质成分,d.理解物质分离、提纯、条件控制等操作的目的及要点。
②答题切入点:a.原料及产品的分离提纯,b.生产目的及反应原理,c.生产要求及反应条件,d.有关产率、产量及组成的计算,e.绿色化学。
2.工艺流程题常见答题方向考点指导1 以物质制备为目的工艺流程【典例1】______________________________________________(2)“酸浸”后,钛主要以形式存在,写出相应反应的离子方________________________________________沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:(4)Li2Ti5O15中Ti的化合价为+4,其中过为________________。
(5)若“滤液②”中c(Mg2+)=0.02 mol·L-1,加入双氧水和磷酸(设溶液(6)写出“高温煅烧②”中由的化学方程式__________________________________。
【审题指导】①分析图像,浸出率达到70%只有90 ℃、100 ℃两条曲线。
②反应物FeTiO3+H++Cl-,生成物TiOCl2-4+Fe2+,结合原子守恒和电荷守恒写出离子方程式。
③可以从温度、浓度、压强等方面考虑转化率的因素,结合考虑双氧水在高温下易分解、氨水中氨气会逸出。

常考专题讲座(三) 无机化学工艺流程题的解题策略[学生用书P 66考查特点工艺流程题就是将化工生产中的生产流程用框图形式表示出来,并根据生产流程中有关的化学知识步步设问,是无机框图题的创新,题目常常以现代工业生产为基础,将化学工艺流程进行简化,与化工生产成本、环境保护等相融合,考查物质的制备、检验、分离等基本实验原理在化工生产中的实际应用,是近几年高考化学命题中的常考题型。
解题指导一、题型结构 1.化工流程线路示意图 (1)箭头:箭头进入的是投料(即反应物)、出去的是生成物(包括主产物和副产物)。
(2)三线:物料进出线、操作流程线、循环操作线。
2.涉及问题(1)原料的预处理。
(2)反应条件的控制(温度、压强、催化剂、原料配比、pH、溶剂等)。
(3)反应原理(化学平衡、水解平衡、化学反应速率、反应热、电化学等)。
(4)绿色化学问题(物质循环利用、废物的处理、原子利用率、能量充分利用等)。
(5)化工安全(防爆、防污染、防中毒等)。
二、解题思路及方法 1.解题思路2.解题方法(1)首尾分析法:对一些线型流程工艺(从原料到产品为一条龙的生产工序)试题,首先对比分析流程图中第一种物质(原材料)与最后一种物质(产品),从对比分析中找出原料与产品之间的关系,弄清生产过程中原料转化为产品的基本原理和除杂、分离、提纯产品的化工工艺,然后再结合题设的问题,逐一推敲解答。
(2)分段分析法:对于用同样的原材料生产多种(两种或两种以上)产品(包括副产品)的工业流程题,用分段分析法更容易找到解题的切入点。
(3)交叉分析法:有些化工生产选用多组原材料,先合成一种或几种中间产品,再用这一中间产品与部分其他原材料生产所需的主流产品,这种题适合用交叉分析法。
就是将提供的工业流程示意图结合常见化合物的制取原理划分成几条生产流水线,然后上下交叉分析。
3.答题步骤 (1)从题干中获取有用信息,了解生产的产品。
(2)整体浏览一下流程,基本辨别出预处理、反应、提纯、分离等阶段。

第三章 金属及其化合物本章知识系统及重要化学方程式再书写1.钠及其重要化合物(1)知识网络构建(2)重要反应必练写出下列反应的化学方程式,是离子反应的写出离子方程式。
①Na 和H 2O 的反应2Na +2H 2O===2Na ++2OH -+H 2↑;②Na 在空气中燃烧2Na +O 2=====点燃Na 2O 2;③Na 2O 2和H 2O 的反应2Na 2O 2+2H 2O===4Na ++4OH -+O 2↑;④Na 2O 2和CO 2的反应2Na 2O 2+2CO 2===2Na 2CO 3+O 2;⑤向NaOH 溶液中通入过量CO 2OH -+CO 2===HCO -3;⑥将Na 2CO 3溶液与石灰乳混合CO 2-3+Ca(OH)2===CaCO 3↓+2OH -;⑦向Na 2CO 3稀溶液中通入过量CO 2CO 2-3+CO 2+H 2O===2HCO -3;⑧将NaHCO 3溶液和NaOH 溶液等物质的量混合HCO -3+OH -===CO 2-3+H 2O ;⑨将NaHCO 3溶液与澄清石灰水等物质的量混合HCO -3+Ca 2++OH -===CaCO 3↓+H 2O ;⑩将NaHCO 3溶液与少量澄清石灰水混合2HCO -3+Ca 2++2OH -===CaCO 3↓+CO 2-3+2H 2O 。
2.铝及其重要化合物(1)知识网络构建(2)重要反应必练写出下列反应的离子方程式。
①Al和NaOH溶液的反应2Al+2OH-+2H2O===2AlO-2+3H2↑;②Al(OH)3和NaOH溶液的反应Al(OH)3+OH-===AlO-2+2H2O;③Al(OH)3和盐酸的反应Al(OH)3+3H+===Al3++3H2O;④Al2O3和NaOH的反应Al2O3+2OH-===2AlO-2+H2O;⑤Al2O3和盐酸的反应Al2O3+6H+===2Al3++3H2O;⑥NaAlO2和过量盐酸的反应AlO-2+4H+===Al3++2H2O;⑦向NaAlO2溶液中通入过量CO2气体AlO-2+CO2+2H2O===Al(OH)3↓+HCO-3;⑧将NaAlO2溶液与NaHCO3溶液混合AlO-2+HCO-3+H2O===Al(OH)3↓+CO2-3;⑨将NaAlO2溶液与AlCl3溶液混合3AlO-2+Al3++6H2O===4Al(OH)3↓;⑩将AlCl3溶液与NaHCO3溶液混合Al3++3HCO-3===Al(OH)3↓+3CO2↑。


2019高考化学总复习第三章金属及其化合物3-1-3 考点三碳酸钠与碳酸氢钠学后即练新人教版编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2019高考化学总复习第三章金属及其化合物3-1-3 考点三碳酸钠与碳酸氢钠学后即练新人教版)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2019高考化学总复习第三章金属及其化合物3-1-3 考点三碳酸钠与碳酸氢钠学后即练新人教版的全部内容。
3—1—3 考点三碳酸钠与碳酸氢钠1.向NaOH和Na2CO3混合溶液中滴加0。
1 mol·L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。
下列判断正确的是( )A.在0~a范围内,只发生中和反应B.ab斜段发生反应的离子方程式为CO错误!+2H+===H2O+CO2↑C.a=0。
3D.原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2解析:向NaOH和Na2CO3混合溶液中滴加0。
1 mol·L-1稀盐酸,发生的反应依次为OH-+H+===H2O,CO错误!+H+===HCO错误!,HCO错误!+H+===CO2↑+H2O,据此可以解答。
在0~a范围内,发生的反应应该是OH-+H+===H2O,CO错误!+H+===HCO错误!,不只发生中和反应,A错误;ab段发生反应的离子方程式为HCO错误!+H+===CO2↑+H2O,B错误;从图象知生成CO2 0.01 mol,根据方程式HCO错误!+H+===CO2↑+H2O可知消耗盐酸的物质的量为0。
01 mol,故a=0。
3,C正确;根据方程式和图象可知Na2CO3的物质的量是0。
微专题强化突破5无机化学工艺流程题专题集训1.高纯度氧化铝有广泛的用途,某研究小组用以下流程制取高纯度氧化铝:过氧化氢顺水硫酸铝溶液I啟劇液合成产品根据上述流程图填空:(1)“除杂”操作是先加入过氧化氢充分反应后,再用氨水调节溶液的pH,使硫酸钱溶液中的少量Fe'T氧化为Fe'+并进一步转化为Fe (OH)3从而除去Fe2+,则Fe^酸性条件下氧化为Fe 卄的离子方程式为___________________________________________________________ o(2)配制硫酸铝溶液时,需用硫酸酸化,酸化的目的是__________________________ 。
(3)“分离”操作的名称是________ (填字母代号)。
A.蒸馅B.分液C.过滤(4)钱明矶晶体的化学式为NH;A1(SO.)2-12H2O,钱明矶属于 ________ (填“纯净物”或“混合物”),在0.1 mol/L ®明矶的水溶液中,浓度最大的离子是___________ 。
⑸热分解中发生如下反应:6NHiAl (SO l)2^=3Al2O3+2NH3 t +2N2 t +6S02 t +6S03 t +9H20,当生成1 mol Al:心时转移电子的物质的量为molo解析:(1)氏02溶液具有强氧化性,可以氧化业铁离子生成铁离子,反应的离子方程式为2F C2++H202+2H+=2Fe3+ + 2H20 o(2)[tl于铝离子在溶液中能发生水解生成氢氧化铝,所以加入硫酸酸化,抑制铝离子的水解。
(3)把晶体从混合物中“分离”操作的名称是过滤。
(4)鞍明矶晶体的化学式为NH.iAKSO.^- 12H20,镀明矶有固定的组成,属于纯净物;在0. 1 mol/L技明矶的水溶液中,未水解前,C(A13+)=C(NH;)=0. 1 mol/L,由于钱根和铝离子均水解,水解结合水电离出的盘氧根,水解后浓度均小于0. 1 mol/L, c(S0D =0. 2 mol/L, 所以在0.1 mol/L鞍明矶的水溶液中,浓度最大的离子是S0厂。