化工热力学 2
- 格式:doc
- 大小:35.50 KB
- 文档页数:1

化工热力学马沛生第二版习题答案
第一章:热力学基本概念与性质
1.1 温度、压力、体积及变化
1.1.1 选择题
1.在0℃和85℃两个温度之间,气体体积的变化主要取决于其压强。
答案:F
解析:气体体积的变化主要取决于温度,而与压强无关。
2.如果两个金属块的温度相等,则它们的分子平均动能也相等。
答案:T
解析:温度是表示物体内分子平均动能的物理量。
3.1厘米正常气温下的气体与2厘米正常气温下的气
体在质量上相等。
答案:F
解析:在正常气温下,相同气体质量与体积成反比。
4.一个密闭容器内气体的压强是由温度决定的。
答案:T
解析:根据理想气体状态方程,PV = nRT,压强与
温度成正比。
1.1.2 填空题
1.25℃的普朗克辐射定律中的常数k等于9.5 x 10^-23。
答案:False
解析:25℃的普朗克辐射定律中的常数k等于
1.381 x 10^-23。









注册化工工程师-化工热力学(二)(总分29,考试时间90分钟)一、单项选择题1. 某体系由状态A经不可逆过程到状态B,再经可逆过程到状态C,然后回到状态A,完成一个热力学循环过程,则( )。
A. (A) 体系的焓变△H≠0,Q=W=0B. (B) 体系的焓变△H=0,Q=W=0C. (C) 体系的△H=0,Q=WD. (D) 体系的△H≠0,Q=W2. 下列说法中,正确的是( )。
A. (A) 一定压力下,混合物的泡点温度比露点温度高B. (B) 一定温度下,混合物的泡点压力低于露点压力C. (C) 一定压力下,纯物质的泡点温度和露点温度是相同的,且等于沸点D. (D) 纯物质的泡点线符合拉乌尔定律的直线3. 正辛醇(1)—水(2)液液平衡体系,在25℃时,水相中正辛醇的摩尔分数为0.00007,而醇相中水的摩尔分数为0.26,则可估算出水在水相及醇相中的活度系数分别为( )。
A. (A) 1.00007,1.351B. (B) 1.00007,3.846C. (C) 1.0,1.351D. (D) 1.0,3.8464. 已知某二元系统,则对称归一化的活度系数lnγ1是( )。
5. 关于可逆与不可逆过程,下面说法正确的是( )。
A. (A) 含有摩擦生热的过程可视为可逆过程B. (B) 实际的绝热过程都是可逆过程C. (C) 过程的不可逆性越大,则功损失越多D. (D) 所有的不可逆过程都将使环境的熵增加6. 某热机在工作中因活塞摩擦在每一循环中使环境的熵增为吸热过程熵增的10%,高温热源和环境的温度分别为T和T0,则此热机的热效率为( )。
A. (A) T/T0-1B. (B) 1-T0/TC. (C) T/(1.1T0)-1D. (D) 1-1.1T0/T7. 下列哪种说法是错误的( )。
A. (A) 理想气体混合物一定是理想溶液B. (B) 理想溶液的某一容量性质M,有C. (C) 理想溶液有D. (D) 理想溶液中所有组分的活度系数均为18. 设有一可逆机,在环境温度为298K时工作的热效率为10%,今若将该机的热效率提高到25%,则高温热源温度需增加( )。
习题:2-1.为什么要研究流体的pVT 关系?答:在化工过程的分析、研究与设计中,流体的压力p 、体积V 和温度T 是流体最基本的性质之一,并且是可以通过实验直接测量的。
而许多其它的热力学性质如内能U 、熵S 、Gibbs 自由能G 等都不方便直接测量,它们需要利用流体的p –V –T 数据和热力学基本关系式进行推算;此外,还有一些概念如逸度等也通过p –V –T 数据和热力学基本关系式进行计算。
因此,流体的p –V –T 关系的研究是一项重要的基础工作。
2-2.理想气体的特征是什么?答:假定分子的大小如同几何点一样,分子间不存在相互作用力,由这样的分子组成的气体叫做理想气体。
严格地说,理想气体是不存在的,在极低的压力下,真实气体是非常接近理想气体的,可以当作理想气体处理,以便简化问题。
理想气体状态方程是最简单的状态方程:RT pV =2-3.偏心因子的概念是什么?为什么要提出这个概念?它可以直接测量吗?答:纯物质的偏心因子ω是根据物质的蒸气压来定义的。
实验发现,纯态流体对比饱和蒸气压的对数与对比温度的倒数呈近似直线关系,即符合:⎪⎪⎭⎫ ⎝⎛-=r sr Tp 11log α 其中,c s s r p p p =对于不同的流体,α具有不同的值。
但Pitzer 发现,简单流体(氩、氪、氙)的所有蒸气压数据落在了同一条直线上,而且该直线通过r T =0.7,1log -=sr p 这一点。
对于给定流体对比蒸气压曲线的位置,能够用在r T =0.7的流体与氩、氪、氙(简单球形分子)的sr p log 值之差来表征。
Pitzer 把这一差值定义为偏心因子ω,即)7.0(00.1log =--=r s r T p ω任何流体的ω值都不是直接测量的,均由该流体的临界温度c T 、临界压力c p 值及r T =0.7时的饱和蒸气压s p 来确定。
2-4.纯物质的饱和液体的摩尔体积随着温度升高而增大,饱和蒸气的摩尔体积随着温度的升高而减小吗?答:正确。
第2章流体的p-V-T关系
主要内容
1) 流体的压力p、摩尔体积V 和温度T是物质最基
本的性质;
2)p、V、T 性质可以通过实验直接测量;
3)pVT+c p ig能推算其它不能直接从实验测量的热力
学性质如H、S、U、G等。
1
)
c
A B
对任何气体,
根据气体的临界参数,即可求出Z
计算常数需要
同时适用于汽液两相,
(1)
(2) EOS
(3)
与立方型状态方程相比,多参数状态方程的优多参数方程的基础是
能同时适用于汽、液两相
在计算和关联烃类混合物时极有价值;计算结果明显高于立方型状态方程;
该方程的数学规律性较弱,给方程的求解。
思考题3-1气体热容,热力学能和焓与哪些因素有关?由热力学能和温度两个状态参数能否确定气体的状态?答:气体热容,热力学能和焓与温度压力有关,由热力学能和温度两个状态参数能够确定气体的状态。
3-2 理想气体的内能的基准点是以压力还是温度或是两者同时为基准规定的? 答:理想气体的内能的基准点是以温度为基准规定的。
3-3 理想气体热容差R p v c c -=是否也适用于理想气体混合物?答:理想气体热容差R p v c c -=不适用于理想气体混合物,因为混合物的组成对此有关。
3-4 热力学基本关系式d d d H T S V p =+是否只适用于可逆过程? 答:否。
热力学基本关系式d d d H T S V p =+不受过程是否可逆的限制3-5 有人说:“由于剩余函数是两个等温状态的性质之差,故不能用剩余函数来计算性质随着温度的变化”,这种说法是否正确?答:不正确。
剩余函数是针对于状态点而言的;性质变化是指一个过程的变化,对应有两个状态。
3-6 水蒸气定温过程中,热力学内能和焓的变化是否为零?答:不是。
只有理想气体在定温过程中的热力学内能和焓的变化为零。
3-7 用不同来源的某纯物质的蒸气表或图查得的焓值或熵值有时相差很多,为什么?能否交叉使用这些图表求解蒸气的热力过程?答:因为做表或图时选择的基准可能不一样,所以用不同来源的某纯物质的蒸气表或图查得的焓值或熵值有时相差很多。
不能够交叉使用这些图表求解蒸气的热力过程。
3-8 氨蒸气在进入绝热透平机前,压力为2.0 MPa ,温度为150℃,今要求绝热透平膨胀机出口液氨不得大于5%,某人提出只要控制出口压力就可以了。
你认为这意见对吗?为什么?请画出T -S 图示意说明。
答:可以。
因为出口状态是湿蒸汽,确定了出口的压力或温度,其状态点也就确定了。
3-9 很纯的液态水,在大气压力下,可以过冷到比0℃低得多的温度。
假设1kg 已被冷至-5℃的液体。
现在,把一很小的冰晶(质量可以忽略)投入此过冷液体内作为晶种。
第2章P-V-T关系和状态方程一、是否题1. 纯物质由蒸汽变成固体,必须经过液相。
(错。
如可以直接变成固体。
)2. 当压力大于临界压力时,纯物质就以液态存在。
(错。
若温度也大于临界温度时,则是超临界流体。
) 3. 由于分子间相互作用力的存在,实际气体的摩尔体积一定小于同温同压下的理想气体的摩尔体积,所以,理想气体的压缩因子Z=1,实际气体的压缩因子Z<1。
(错。
如温度大于Boyle 温度时,Z >1。
) 4. 纯物质的三相点随着所处的压力或温度的不同而改变。
(错。
纯物质的三相平衡时,体系自由度是零,体系的状态已经确定。
) 5. 在同一温度下,纯物质的饱和液体与饱和蒸汽的吉氏函数相等。
(对。
这是纯物质的汽液平衡准则。
)6. 纯物质的平衡汽化过程,摩尔体积、焓、热力学能、吉氏函数的变化值均大于零。
(错。
只有吉氏函数的变化是零。
) 7. 气体混合物的virial 系数,如B ,C …,是温度和组成的函数。
(对。
) 二、选择题1. 指定温度下的纯物质,当压力低于该温度下的饱和蒸汽压时,则气体的状态为(C 。
参考P -V 图上的亚临界等温线。
) A. 饱和蒸汽 B. 超临界流体 C. 过热蒸汽2. T 温度下的过热纯蒸汽的压力P (B 。
参考P -V 图上的亚临界等温线。
)A. >()T P sB. <()T P sC. =()T P s3. 能表达流体在临界点的P-V 等温线的正确趋势的virial 方程,必须至少用到(A 。
要表示出等温线在临界点的拐点特征,要求关于V 的立方型方程)A. 第三virial 系数B. 第二virial 系数C. 无穷项D. 只需要理想气体方程4. 当0→P 时,纯气体的()[]P T V P RT ,-的值为(D 。
因()[]0lim lim ,lim 000=⎪⎭⎫⎝⎛∂∂⎪⎭⎫ ⎝⎛∂∂=-=→→→BT T P T P P P Z P Z RT P T V P RT ,又) A. 0 B. 很高的T 时为0 C. 与第三virial 系数有关D. 在Boyle 温度时为零三、填空题1. 表达纯物质的汽平衡的准则有()()()()sl sv sl sv V T G V T G T G T G ,,==或(吉氏函数)、vapvapsV T HdT dP ∆∆=(Claperyon 方程)、()⎰-=svslV V sl sv s V V P dV V T P ),((Maxwell 等面积规则)。
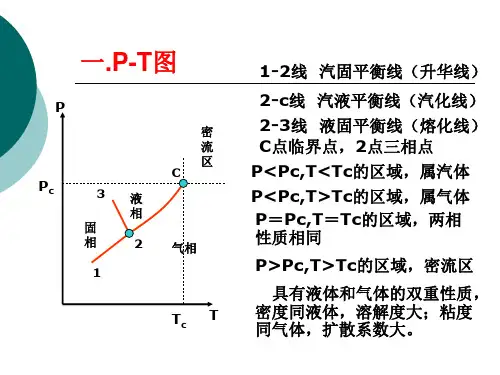
化工热力学2
一.简答题
1 写出以体积表示的维里方程的形式,并说明维里系数的含义。
2 画出理想朗肯循环的T-S 图, 并写出透平机对外做功的计算公式。
3 若采用普遍化方法估算290K 、2.5MPa 条件下
乙烷的逸度,采用图1判断使用哪种更合适?
图1 图2
4 写出临界点PVT 之间满足的数学条件,并在图2中标出一条小于临界温度的等温线 二计算题:
1 采用普遍化图表计算氮气在42.5℃、16.95MPa 时的压缩因子,摩尔体积 及剩余熵
2 用普遍化第二维里系数法计算正丁烷在460K ,1.52MPa 的摩尔体积
3 在氨的T-S 图上标出冷凝温度为30℃,蒸发温度为-20℃的理想氨压缩制冷循环示意图,并计算
该制冷机的制冷系数
本试题附公式:6
.10422.0083.0r T B -= 2.41172.0139.0r T B -=
dP T V T V dT C dH P P ])(
[∂∂-+= dP T V dT T C dS P P )(∂∂-= 或 dV T
P
dT T C dS V V )(∂∂+= 附表1 临界常数和偏心因子。