铁及其化合物
- 格式:doc
- 大小:730.09 KB
- 文档页数:16




高中化学知识点:铁及其化合物高中化学知识点:铁及其化合物铁的存在和主要性质铁是一种活泼的元素,具有较强的还原性,主要化合价为+2价和+3价。
它在自然界中广泛存在,并且在生活中有着重要的应用。
铁的化学性质铁与非金属单质的反应包括与氧气、氯气和硫的反应。
在常温下,铁会被氧气腐蚀生成铁锈,其中主要成分为Fe2O3·xH2O。
当加热时,铁会与氧气反应生成Fe3O4.铁还可以与氯气和硫反应生成FeCl3和FeS。
在与水的反应中,常温下铁不会与水反应,但在高温条件下,铁会与水蒸气反应生成Fe3O4和H2.铁还可以与酸反应,包括与非氧化性酸和氧化性酸的反应。
与非氧化性酸反应时,铁会被氢离子还原成Fe2+离子,并释放出氢气。
与氧化性酸反应时,铁会被氧化成Fe3+离子,并释放出氮氧化物和水。
铁还可以与某些盐溶液反应,包括与CuSO4溶液反应生成Cu和FeSO4,以及与FeCl3溶液反应生成Fe2+和Fe3+离子。
铁的重要化合物铁的氧化物包括FeO、Fe2O3和Fe3O4.这些化合物可以与盐酸反应生成Fe2+离子和水。
FeO还可以与硝酸反应生成Fe(NO3)3、NO和H2O。
铁的氢氧化物包括Fe(OH)2和Fe(OH)3.这些化合物可以与H+反应生成Fe2+或Fe3+离子和水。
在空气中,Fe(OH)2会迅速被氧气氧化成Fe(OH)3,现象是白色固体变成红褐色固体。
此外,氧化亚铁(FeO)、氧化铁(Fe2O3)和四氧化三铁(Fe3O4)也是铁的重要氧化物,它们分别呈黑色粉末、红棕色粉末和磁性氧化铁黑色晶体。
Fe2+、Fe3+→Fe+2Fe3+→3Fe2+、Fe+2H+→Fe2++H2↑点燃Fe→Fe3O4的两个反应:3Fe+2O2→Fe3O4高温3Fe+4H2O(g)→Fe3O4+4H2铁的三种氧化物,两种氢氧化物,两种离子的颜色:FeO与Fe3O4均为黑色,Fe2O3为红棕色;Fe(OH)2为白色,Fe(OH)3为红褐色;Fe2+为浅绿色,Fe3+为棕黄色。


铁及其化合物Δ铁是地壳中第四个丰度最大的元素,人们认为地球的核心主要是由铁构成的。
在地壳中存在的单质铁是极为少见的,但广泛以化合态出现,许多矿物由于含有铁化合物而呈现特有的颜色。
铁的最重要矿物是氧化物和碳酸盐。
铁含量最高的矿物是铁磁矿(Fe3O4),它是一种黑色有磁铁性的矿物。
赤铁矿(Fe2O3)为红棕色矿物,含铁量高达70%。
褐铁矿是氧化铁(III)矿物的一个变种,它含有可变量的水,但其近似组成往往是2Fe2O3·3H2O。
碳酸铁FeCO3出现为菱铁矿,碳酸盐矿往往与黏土和煤共生,称为铁石。
黄铁矿FeS2是一种常见的脉石矿物,但它不直接用为铁矿,因为它有很高含量的硫而被看成是一种重要的非金属化工原料矿。
在自然界中海油多种多样的硅酸盐铁矿。
ΔFe3C 在T高于1000℃炉区,铁和碳可以反应生成碳化铁ΔFe(CO)5产品名称羰基铁,[别名]增塑剂[分子量]195.90无色至黄色油状液体。
对光和热敏感;在空气中燃烧生成三氧化二铁。
易溶于乙醚,苯,石油醚,丙酮,乙酸乙酯,四氯化碳,二硫化碳等大多数有机溶剂,微溶于乙醇,几乎不溶于水和液氨。
相对密度(d420)1.46~1.52。
溶点-20℃,沸点103℃。
折光率(nD22)1.453。
闪点-15℃。
易燃,有毒。
有刺激性,晶体类型为分子晶体。
Δ穆斯堡尔波普是一种检测铁磁和反铁磁性的一种灵敏工具。
(a)自旋成单的Fe(II),FeSO4·7H2O(b)自旋成单的Fe(III),FeCl3(c)自旋成双的Fe(II),K4Fe(CN)6·3H2O(d)自旋成双的Fe(III),K3Fe(CN)6Δ铁能在高温下吸收氢生成固溶体。
在温度高于800℃时铁能与少量氮反应,但是反应速度很慢,在温度超过400℃时很容易与氨气反应,生成Fe2N。
这是钢铁表面氮化生成硬保护膜层的反应原理。
Δ铁和硫或磷反应时放出大量热,分别生成FeS和Fe3P。

高中化学:铁及其化合物高中化学:铁及其化合物在本文中,我们将了解铁的主要性质及应用,以及铁的重要化合物的主要性质及应用。
我们将以Fe2+、Fe3+的相互转化为例,理解变价金属元素的氧化还原反应。
铁的存在和主要性质铁是一种活泼的元素,具有较强的还原性,主要化合价为+2价和+3价。
铁的化学性质包括:1)与非金属单质的反应①与氧气的反应:在常温下,铁被腐蚀生成铁锈,其主要成分为Fe2O3·xH2O。
点燃铁可以生成Fe3O4.②与氯气的反应:2Fe+3Cl2→2FeCl3.③与硫的反应:Fe+S→FeS。
2)与水的反应在常温下,铁与水不反应,但在高温条件下与水蒸气反应:3Fe+4H2O(g)→Fe3O4+4H2.3)与酸的反应①与非氧化性酸反应的离子方程式:Fe+2H+→Fe2++H2↑。
②与氧化性酸反应的离子方程式:遇冷的浓硫酸或浓硝酸钝化,与稀硝酸或在加热条件下与浓硫酸、浓硝酸反应的离子方程式为Fe+4H++NO-3→Fe+NO↑+2H2O。
4)与某些盐溶液的反应①与CuSO4溶液反应的离子方程式:Fe+Cu2+→Cu+Fe2+。
②与FeCl3溶液反应的离子方程式:Fe+2Fe3+→3Fe2+。
铁的重要化合物铁的氧化物包括FeO、Fe2O3、Fe3O4,它们分别与盐酸反应的离子方程式为:XXX→Fe2++H2O、Fe2O3+6H+→2Fe3++3H2O、XXX与硝酸反应的化学方程式为:3FeO+10HNO3→3Fe(NO3)3+NO↑+5H2O。
铁的氢氧化物包括Fe(OH)2和Fe(OH)3,它们与H+反应的离子方程式为:Fe(OH)2+2H+→Fe2++2H2O、2Fe(OH)3+6H+→2Fe3++6H2O。
铁的氢氧化物有不同的色态和价态,例如氧化亚铁(FeO)、氧化铁(Fe2O3)和四氧化三铁(Fe3O4)等。
的制备方法改写为:可以将FeCl3和NaOH溶液反应得到Fe(OH)3沉淀,再将其加热分解得到Fe2O3在空气中继续加热,Fe2O3会被氧化成Fe3O44.亚铁盐和铁盐的性质改写为:1)亚铁盐含有Fe2+的溶液呈浅绿色,Fe2+既具有氧化性,也具有还原性。

第10讲铁及其化合物10.1 单质铁知识点睛一、铁的物理性质铁具有银白色金属光泽,粉末为黑色。
具有良好的导电、导热性,具有良好的延展性。
纯铁比较软,强度较低,不适合做机器零件,日常生活中见到的铁多为铁碳合金(生铁和钢)。
二、铁的化学性质1.铁与非金属反应①3Fe + 2O2点燃Fe3O 4铁丝剧烈燃烧,火星四射,生成黑色固体,放出大量的热②2Fe + 3Cl2点燃2FeCl 3生成物为铁的高价氯化物③Fe + S△FeS2.铁与水蒸气反应常温或加热的条件下,Fe与H2O基本上不反应,但在高温条件下,Fe可以与H2O(g)反应。
3Fe + 4H2O(g) △Fe3O4 + 4H23.铁与非氧化性酸(如盐酸、稀硫酸等)反应化学方程式:Fe + 2HCl= FeCl2 + H2↑Fe + H2SO4 = FeSO4 + H2↑离子方程式:Fe + 2H+=Fe2+ + H2↑4.铁与氧化性的酸(浓H2SO4、HNO3)的反应常温下,铁与稀硫酸反应会产生氢气,但是铁与稀硝酸反应产生的是NO和H2O。
常温下铁遇到冷的浓硫酸和浓硝酸会发生“钝化”现象,加热下能反应但放出的不是氢气,且一般生成铁的高价化合物。
Fe + 4HNO3(稀) Fe(NO3)3+ NO↑ + 2H2O2Fe + 6H2SO4(浓) △Fe2(SO4)3 + 3SO2↑ + 6H2OFe + 6HNO3(浓) △Fe(NO3)3 + 3NO2↑ + 3H2O5.铁与盐溶液反应Fe + CuSO 4 = FeSO 4 + Cu Fe + Cu 2+ = Fe 2+ + Cu【注意】铁与弱氧化剂(如H +、Cu 2+、S 等)反应,失去两个电子形成Fe 2+;当与强氧化剂(如Cl 2、硝酸、浓硫酸等)反应且铁粉少量时,失去三个电子形成Fe 3+。
三、 铁的存在及冶炼铁在地壳中的含量居第四位,铁在自然界中有游离态的铁(陨铁),但主要以化合态存在。

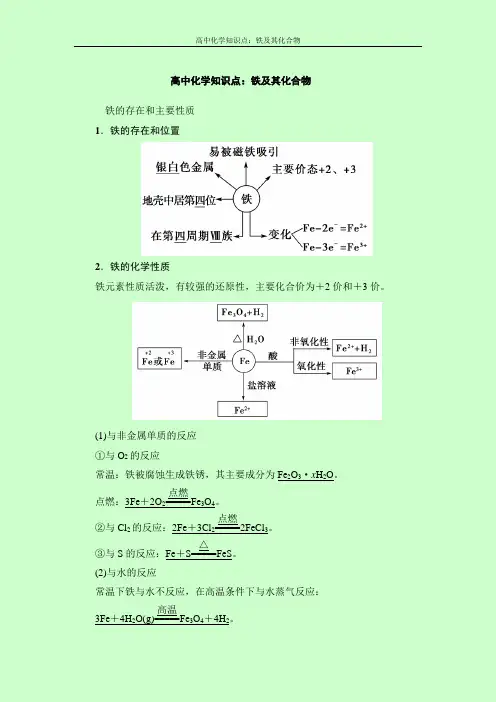
高中化学知识点:铁及其化合物铁的存在和主要性质 1.铁的存在和位置2.铁的化学性质铁元素性质活泼,有较强的还原性,主要化合价为+2价和+3价。
(1)与非金属单质的反应 ①与O 2的反应常温:铁被腐蚀生成铁锈,其主要成分为Fe 2O 3·x H 2O 。
点燃:3Fe +2O 2=====点燃Fe 3O 4。
②与Cl 2的反应:2Fe +3Cl 2=====点燃2FeCl 3。
③与S 的反应:Fe +S=====△FeS 。
(2)与水的反应常温下铁与水不反应,在高温条件下与水蒸气反应: 3Fe +4H 2O(g)=====高温Fe 3O 4+4H 2。
(3)与酸的反应①与非氧化性酸反应的离子方程式:Fe+2H+===Fe2++H2↑。
②与氧化性酸遇冷的浓硫酸或浓硝酸钝化,与稀硝酸或在加热条件下与浓硫酸、浓硝酸反应无H2产生。
Fe与足量稀HNO3反应的离子方程式为Fe+4H++NO-3===Fe3++NO↑+2H2O。
(4)与某些盐溶液的反应①与CuSO4溶液反应的离子方程式:Fe+Cu2+===Cu+Fe2+。
②与FeCl3溶液反应的离子方程式:Fe+2Fe3+===3Fe2+。
铁的重要化合物1.铁的氧化物氧化亚铁(FeO) 氧化铁(Fe2O3) 四氧化三铁(Fe3O4) 俗名铁红磁性氧化铁色态黑色粉末红棕色粉末黑色晶体铁元素价态+2 +3 +2、+3 说明:①FeO、Fe2O3、Fe3O4分别与盐酸反应的离子方程式:FeO+2H+===Fe2++H2O、Fe2O3+6H+===2Fe3++3H2O、Fe3O4+8H+===2Fe3++Fe2++4H2O。
②FeO与硝酸反应的化学方程式:3FeO+10HNO3===3Fe(NO3)3+NO↑+5H2O。
2.铁的氢氧化物Fe(OH)2Fe(OH)3色态白色固体红褐色固体与H+反应Fe(OH)2+2H+=== Fe2++2H2O Fe(OH)3+3H+=== Fe3++3H2O二者的关在空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,现象是白色絮状沉淀迅速变成灰绿色,最后变成红褐色,反应方程式为4Fe(OH)2+系O2+2H2O===4Fe(OH)3说明:Fe(OH)2、Fe(OH)3的制备可利用相应亚铁盐、铁盐与碱液反应。

高中化学知识点:铁及其化合物
铁的性质
- 铁是一种金属元素,符号为Fe,原子序数为26。
- 铁是一种有色金属,具有良好的导电性和导热性。
- 铁在常温下是固态,可以延展和变形。
铁的化合物
氧化铁
- 氧化铁是铁常见的氧化物,由铁和氧组成。
- 三种常见的氧化铁是氧化亚铁(FeO)、氧化铁(Fe2O3)和氧化铁(Fe3O4)。
- 氧化亚铁是黑色的,氧化铁是红色的,氧化铁是黑色的。
铁的酸性氧化物
- 铁还可以形成酸性氧化物,可以和酸反应生成盐和水。
- 铁的酸性氧化物有氧化铁(Fe2O3)和氧化铁(Fe3O4)。
金属铁
- 金属铁是纯铁,具有较高的熔点和延展性。
- 金属铁通常用于制造各种工具和建筑材料。
铁的应用
- 铁是常见的金属材料,在工业和日常生活中有广泛的应用。
- 铁通常用于制造建筑材料、机械、电器、车辆等。
- 铁的化合物也有一些应用,例如氧化铁可以用于制作颜料。
总结
铁是一种有色金属,具有良好的导电性和导热性。
铁的主要化合物是氧化铁。
铁及其化合物在工业和日常生活中有广泛的应用。
铁及其化合物1.铁的存在2.铁的性质(1)物理性质纯铁具有金属的共性,如具有银白色金属光泽和良好的延展性,是电和热的良导体,具有能被磁铁吸引的特性,纯铁有很强的抗腐蚀能力。
(2)化学性质铁是较活泼的金属,发生化学反应时可生成+2、+3两种价态的化合物。
①分别写出铁与O2、Cl2、S反应的化学方程式:3Fe +2O 2=====点燃Fe 3O 4; 2Fe +3Cl 2=====点燃2FeCl 3;Fe +S=====△FeS 。
②分别写出铁与HCl 、CuCl 2溶液、FeCl 3溶液、稀HNO 3(过量)反应的离子方程式:Fe +2H +===Fe 2++H 2↑; Fe +Cu 2+===Cu +Fe 2+; 2Fe 3++Fe===3Fe 2+;Fe +4H ++NO -3===Fe 3++NO ↑+2H 2O 。
3.铁的氧化物和氢氧化物 (1)铁的氧化物(2)铁的氢氧化物4.亚铁盐和铁盐(1)亚铁盐:含有Fe2+的溶液呈浅绿色,Fe2+既有氧化性,又有还原性,Fe2+与Zn、Cl2反应的离子方程式分别为Zn+Fe2+===Zn2++Fe,2Fe2++Cl2===2Fe3++2Cl-。
(2)铁盐:①氧化性:含有Fe3+的溶液呈棕黄色,Fe3+具有氧化性,Fe3+与Fe、Cu反应的离子方程式分别为2Fe3++Fe===3Fe2+,2Fe3++Cu===2Fe2++Cu2+。
②特性:含有Fe3+的盐溶液遇到KSCN时变成血红色。
③易水解:FeCl3滴入沸水中的离子方程式:Fe3++3H2O Fe(OH)3(胶体)+3H+。
按要求书写离子反应方程式(1)FeO和稀HNO3反应。
(2)Fe3O4和稀HNO3反应。
(3)Fe2O3和HI反应。
(4)Fe(OH)2和稀HNO3反应。
(5)Fe(OH)3和HI反应。
提示:(1)3FeO+10H++NO-3===3Fe3++NO↑+5H2O(2)3Fe3O4+28H++NO-3===9Fe3++NO↑+14H2O(3)Fe2O3+6H++2I-===2Fe2++I2+3H2O(4)3Fe(OH)2+10H++NO-3===3Fe3++NO↑+8H2O(5)2Fe(OH)3+6H++2I-===2Fe2++I2+6H2O友情提示1.铁元素有+2、+3等多种价态,反应环境不同,可能反应产物不同,铁与非氧化性酸生成Fe2+。
铁及其化合物1、铁和水蒸气高温下反应:3 Fe+4H2O(g)高温Fe3O4+4H2铁在纯氧燃烧:3Fe + 2O2 点燃Fe3O4铁在氯气中燃烧:2Fe+3Cl2 = 2FeCl3铁和硫粉共热:Fe+S △FeS2、铁和盐酸反应: Fe+2HCl= FeCl2+H2↑(Fe+2H+= Fe2++H2↑)3、铁和氯化铜反应:Fe+CuCl2= FeCl2+Cu (Fe+Cu2+= Fe2++Cu)4、氧化亚铁和盐酸反应:FeO+2HCl= FeCl2+H2O (FeO+2H+= Fe2++H2O)5、氧化铁和盐酸反应:Fe2O3+6HCl=2 FeCl3+3H2O(Fe2O3+6H+= 2Fe2++3H2O)6、氯化亚铁和氢氧化钠反应:FeCl2+2NaOH = Fe(OH)2↓+2NaCl (Fe2++2OH-= Fe(OH)2↓)7、氢氧化亚铁和盐酸反应:Fe(OH)2 + 2HCl= FeCl2+2H2O (Fe(OH)2+2H+= Fe2++2H2O)8、氯化铁和氢氧化钠反应:FeCl3+3NaOH = Fe(OH)3↓+3NaCl (Fe3++3OH-= Fe(OH) 3↓)9、氢氧化铁和盐酸反应 Fe(OH) 3+3HCl= FeCl3+3H2O (Fe(OH) 3+3H+=Fe3++3H2O)10、氯化亚铁和氯气反应: 2FeCl2+Cl2=2FeCl3 (2Fe2++Cl2=2 Fe3++2Cl—)11、铁和氯化铁反应: Fe+2FeCl3 = 3FeCl2(Fe +2 Fe3+=3 Fe2+)铜和氯化铁反应: Cu+2FeCl3=2FeCl2+CuCl2 (Cu+2 Fe3+=2 Fe2++Cu2+)12、氢氧化铁受热分解: 2 Fe(OH)3△Fe2O3+3H2O13、白色沉淀,然后迅速变为灰绿色,最后变为红褐色(氢氧化亚铁转化为氢氧化铁)4 Fe(OH)2+ O2 + 2 H2O ═ 4 Fe(OH) 3。
铁及其化合物性质【铁的形成】相对原子质量55.847。
铁有多种同素异形体。
铁是比较活泼的金属,在金属活动顺序表里排在氢的前面。
常温时,铁在干燥的空气里不易与氧、硫、氯等非金属单质起反应,在高温时,则剧烈反应。
铁在氧气中燃烧,生成Fe3O4,赤热的铁和水蒸气起反应也生成Fe3O4。
铁易溶于稀的无机酸和浓盐酸中,生成二价铁盐,并放出氢气。
在常温下遇浓硫酸或浓硝酸时,表面生成一层氧化物保护膜,使铁“钝化”,故可用铁制品盛装浓硫酸或浓硝酸。
铁是一变价元素,常见价态为+2和+3。
铁与硫、硫酸铜溶液、盐酸、稀硫酸等反应时失去两个电子,成为+2价。
与Cl2、Br2、硝酸及热浓硫酸反应,则被氧化成Fe3+。
铁与氧气或水蒸气反应生成的Fe3O4,可以看成是FeO·Fe2O3,其中有1/3的Fe为+2价,另2/3为+3价。
铁的+3价化合物较为稳定。
是一种光亮的银白色金属。
密度7.86克/厘米3。
熔点1535℃,沸点2750℃。
常见化合价+2和+3,有好的延展性和导热性。
也能导电。
纯铁既能磁化,又可去磁,且均很迅速。
电离能为7.870电子伏特。
化学性质比较活泼,是一种良好的还原剂。
若有杂质,在潮湿的空气中易锈蚀;在有酸气或卤素蒸气存在的湿空气中生锈更快。
易溶于稀酸。
在浓硝酸中能被钝化。
加热时均能同卤素、硫、硅、碳、磷等化合。
除生成+2和+3价氧化物外,还有复合氧化物Fe3O4(是磁性氧化物)生成。
铁是工业部门不可缺少的一种金属。
【铁的化学性质】[铁的化学性质之一]铁Fe,原子序数26,相对原子质量55.847。
铁有多种同素异形体,如铁、铁、铁、铁等。
铁是比较活泼的金属,在金属活动顺序表里排在氢的前面。
常温时,铁在干燥的空气里不易与氧、硫、氯等非金属单质起反应,在高温时,则剧烈反应。
铁在氧气中燃烧,生成Fe3O4,赤热的铁和水蒸气起反应也生成Fe3O4。
铁易溶于稀的无机酸和浓盐酸中,生成二价铁盐,并放出氢气。
铁及其化合物【学习目标】1、铁的性质;2、铁的重要化合物及其相互转化。
【要点梳理】要点一、铁铁的原子结构示意图如下:1.物理性质⑴常温下,纯铁是银白色具有金属光泽的金属(纯铁的抗蚀力相当强),易导电、导热,有延展性。
⑵铁的熔沸点都很高:熔点是1535℃,沸点是2750℃。
⑶铁能被磁体吸引,在磁场的作用下,自身也能产生磁性。
2.化学性质当跟弱氧化剂反应时:Fe-2e-=Fe2+;当跟强氧化剂反应时:Fe-3e-=Fe3+。
⑴铁与非金属的反应:3Fe+2O2 Fe3O42Fe+3Cl22FeCl3, 2Fe+3Br2=2FeBr3Fe+I2=FeI2, Fe+S FeS⑵铁和某些盐(如CuSO4)溶液的反应:Fe+Cu2+=Fe2++Cu⑶铁与酸的反应:与非氧化性酸:Fe+2H+=Fe2++H2↑⑷铁与水蒸汽的反应:3Fe+4H2O(g) Fe3O4+4H2(注意产物是Fe3O4)注意:①该实验所用铁粉为还原铁粉(即刚用还原的方法得到的铁粉)。
②实验中收集气体,并通过爆鸣实验来验证氢气的产生。
要点二、铁的化合物1.铁的氧化物(1)FeO不稳定,在空气里受热,就迅速被氧化成Fe3O4。
(2)Fe2O3常用作红色油漆和涂料,赤铁矿(主要成分是Fe2O3)是炼铁的原料。
(3)Fe的常见化合价只有+2价和+3价,Fe3O4可以看成由FeO和Fe2O3按物质的量之比1∶1组合而成的复杂氧化物,通常也可写成FeO·Fe2O3的形式。
FeO、Fe2O3属于碱性氧化物,Fe3O4不属于碱性氧化物。
2.铁的氢氧化物名称氢氧化亚铁氢氧化铁化学式Fe(OH)2Fe(OH)3分类碱碱性质色态白色固体红褐色固体水溶性不溶于水不溶于水与酸反应Fe(OH)2+2H+=Fe2+ + 2H2O Fe(OH)3+3H+=Fe3++3H2O还原性稳定性4Fe(OH)2 + O2 + 2H2O =4Fe(OH)32Fe(OH)3Fe2O3+3H2O(受热分解)制法原理Fe2+ +2OH-=Fe(OH)2↓Fe3+ +3OH-=Fe(OH)3↓现象白色絮状沉淀红褐色沉淀2①硫酸亚铁要现配(配制时,蒸馏水要煮沸,以减少蒸馏水中溶解的氧,防止亚铁离子被氧化)。
第2部分元素及其化合物第9讲铁及其化合物一、新课程标准解读:【内容要求】2.1 元素与物质认识元素可以组成不同种类的物质,根据物质的组成和性质可以对物质进行分类;同类物质具有相似的性质,一定条件下各类物质可以相互转化;认识元素在物质中可以具有不同价态,可通过氧化还原反应实现含有不同价态同种元素的物质的相互转化。
认识胶体是一种常见的分散系。
2.4 金属及其化合物结合真实情境中的应用实例或通过实验探究,了解钠、铁及其重要化合物的主要性质,了解这些物质在生产、生活中的应用。
2.6 物质性质及物质转化的价值结合实例认识金属、非金属及其化合物的多样性,了解通过化学反应可以探索物质性质、实现物质转化,认识物质及其转化在促进社会文明进步、自然资源综合利用和环境保护中的重要价值。
2.7 学生必做实验铁及其化合物的性质【教学提示】1、教学策略发挥核心概念对元素化合物学习的指导作用。
重视开展高水平的实验探究活动。
紧密联系生产和生活实际,创设丰富多样的真实问题情境。
2、学习活动建议(1)实验及探究活动:铁及其化合物的性质探究;氢氧化亚铁的制备;溶液中亚铁离子、铁离子的检验。
3、情境素材建议金属及其化合物的性质与应用:补铁剂;实验室中硫酸亚铁的保存与使用;印刷电路板的制作;打印机、复印机使用的墨粉中铁的氧化物(利用磁性性质);菠菜中铁元素的检验。
二、高考真题分析:1.【2020新课标Ⅱ】北宋沈括《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧。
挹其水熬之则成胆矾,烹胆矾则成铜。
熬胆矾铁釜,久之亦化为铜”。
下列有关叙述错误的是A.胆矾的化学式为CuSO4B.胆矾可作为湿法冶铜的原料C.“熬之则成胆矾”是浓缩结晶过程D.“熬胆矾铁釜,久之亦化为铜”是发生了置换反应【答案】A【解析】A .胆矾为硫酸铜晶体,化学式为CuSO 4 5H 2O ,A 说法错误;B .湿法冶铜是用铁与硫酸铜溶液发生置换反应制取铜,B 说法正确;C .加热浓缩硫酸铜溶液可析出胆矾,故“熬之则成胆矾”是浓缩结晶过程,C 说法正确;D .铁与硫酸铜溶液发生置换反应生成铜,D 说法正确。
综上所述,相关说法错误的是A ,故选A 。
2.【2020江苏】下列有关化学反应的叙述正确的是A .室温下,Na 在空气中反应生成Na 2O 2B .室温下,Al 与4.0 mol ﹒L -1NaOH 溶液反应生成NaAlO 2C .室温下,Cu 与浓HNO 3反应放出NO 气体D .室温下,Fe 与浓H 2SO 4反应生成FeSO 4【答案】B【解析】A .室温下,钠与空气中氧气反应生成氧化钠,错误;B .室温下,铝与NaOH 溶液反应生成偏铝酸钠和氢气,正确;C .室温下,铜与浓硝酸反应生成二氧化氮气体,错误;D .室温下,铁在浓硫酸中发生钝化,错误。
综上所述,答案为B 。
3.(2019天津) 下列有关金属及其化合物的应用不合理...的是 A .将废铁屑加入2FeCl 溶液中,可用于除去工业废气中的2ClB .铝中添加适量锂,制得低密度、高强度的铝合金,可用于航空工业C .盐碱地(含较多23Na CO 等)不利于作物生长,可施加熟石灰进行改良D .无水2CoCl 呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水【答案】C【解析】A 、铁和亚铁能将氯气还原为氯离子,从而除去工业废气中的氯气,不选;B 、根据铝合金的性质,铝合金具有密度低、强度高,故可应用于航空航天等工业,不选;C 、Na 2CO 3+Ca(OH)2=CaCO 3↓+2NaOH ,产物仍然呈碱性,不能改变土壤的碱性,反而使土壤更板结,选;D 、利用无水氯化钴和氯化钴晶体的颜色不同,故可根据颜色判断硅胶中是否能吸水,不选。
故选C 。
4.(2014·全国高考真题)下列反应中,反应后固体物质增重的是A .氢气通过灼热的CuO 粉末B .二氧化碳通过Na 2O 2粉末C .铝与Fe 2O 3发生铝热反应D .将锌粒投入Cu(NO 3)2溶液【答案】B【解析】A 、氢气通过灼热的CuO 粉末发生的反应为22ΔCuO+H Cu+H O ,固体由CuO变为Cu ,反应后固体质量减小,A 错误;B 、二氧化碳通过Na 2O 2粉末发生的反应为2Na 2O 2+2CO 2=2Na 2CO 3+O 2,固体由Na 2O 2变为Na 2CO 3,反应后固体质量增加,B 正确;C 、铝与Fe 2O 3发生铝热反应,化学方程式为2Al+Fe 2O 3Al 2O 3+2Fe ,反应前后各物质均为固体,根据质量守恒定律知,反应后固体质量不变,C 错误;D 、将锌粒投入Cu(NO 3)2溶液发生的反应为Zn + Cu(NO 3)2= Zn(NO 3)2+ Cu ,固体由Zn 变为Cu ,反应后固体质量减小,D 错误;故选B 。
5.(2020·浙江高考真题)下列说法不正确的是( )A .()344Cu NH SO ⎡⎤⎣⎦可通过4CuSO 溶液与过量氨水作用得到B .铁锈的主要成分可表示为232Fe O nH O ⋅C .钙单质可以从4TiCl 中置换出TiD .可用2H 还原MgO 制备单质Mg【答案】D【解析】A .硫酸铜溶液与氨水反应,当氨水过量时发生反应生成()344Cu NH SO ⎡⎤⎣⎦,正确;B .铁锈的主要成分可表示为232Fe O nH O ⋅,正确;C .钙还原性较强,钙单质可以从4TiCl 中置换出Ti ,正确;D .氢气的还原性弱与镁单质,故不能从氧化镁中置换出镁单质,错误;故答案为D 。
6.(2014·上海高考真题)用FeCl 3溶液腐蚀印刷电路板上的铜,所得的溶液中加入铁粉。
对加入铁粉充分反应后的溶液分析合理的是A .若无固体剩余,则溶液中一定有Fe 3+B .若有固体存在,则溶液中一定有Fe 2+C .若溶液中有Cu 2+,则一定没有固体析出D .若溶液中有Fe 2+,则一定有Cu 析出【答案】B【解析】氧化性是Fe 3+>Cu 2+>Fe 2+,还原性是Fe >Cu ,则A 、若无固体剩余,这说明铁粉完全被氧化,但此时溶液中不一定还有Fe 3+,A 不正确;B 、若有固体存在,则固体中一定有铜,可能还有铁,因此溶液中一定有Fe2+,B正确;C、若溶液中有Cu2+,则也可能有部分铜已经被置换出来,因此不一定没有固体析出,C不正确;D、若溶液中有Fe2+,但如果溶液铁离子过量,则不一定有Cu析出,D不正确;答案选B。
7.(2020·浙江高考真题)黄色固体X,可能含有漂白粉、、、、之中的几种或全部。
将X与足量的水作用,得到深棕色固体混合物Y和无色碱性溶液Z。
下列结论合理的是( )A.X中含,可能含有B.X中含有漂白粉和C.X中含有,Y中含有D.用酸化溶液Z,若有黄绿色气体放出,说明X中含有【答案】C【解析】固体X为黄色,则含有Fe2(SO4)3,溶于水后,要使溶液Z为无色碱性,则一定含有漂白粉,且漂白粉过量,得到深棕色固体混合物Y,则固体Y是Fe(OH)3和Cu(OH)2的混合物,X中一定含有,和中含有其中一种或两种都含,据此解答。
A.若X含有KI,则会与漂白粉反应生成I2,溶液不为无色,A不正确;B.由分析可知,不一定含有FeSO4,B不正确;C.由分析可知,X含有CuCl2,Y含有Fe(OH)3,C正确;D.酸化后,产生黄绿色气体,为氯气,则发生的发生反应的离子反应方程式为:Cl-+ClO-+2H+=Cl2↑+H2O,此时的Cl-有可能来自于漂白粉氧化FeSO4产生的Cl-,也有可能是漂白粉自身含有的,不能推导出含有CuCl2,D不正确;故选C。
8.(2020·全国高考真题)宋代《千里江山图》描绘了山清水秀的美丽景色,历经千年色彩依然,其中绿色来自孔雀石颜料(主要成分为Cu(OH)2·CuCO3),青色来自蓝铜矿颜料(主要成分为Cu(OH)2·2CuCO3)。
下列说法错误的是A.保存《千里江山图》需控制温度和湿度B.孔雀石、蓝铜矿颜料不易被空气氧化C.孔雀石、蓝铜矿颜料耐酸耐碱D.Cu(OH)2·CuCO3中铜的质量分数高于Cu(OH)2·2CuCO3【答案】C【解析】A.字画主要由纸张和绢、绫、锦等织物构成,为防止受潮和氧化,保存古代字画时要特别注意控制适宜的温度和湿度,A 说法正确;B .由孔雀石和蓝铜矿的化学成分可知,其中的铜元素、碳元素和氢元素均处于最高价,其均为自然界较稳定的化学物质,因此,用其所制作的颜料不易被空气氧化,B 说法正确;C .孔雀石和蓝铜矿的主要成分均可与酸反应生成相应的铜盐,因此,用其制作的颜料不耐酸腐蚀,C 说法错误;D .因为氢氧化铜中铜元素的质量分数高于碳酸铜,所以Cu(OH)2∙CuCO 3中铜的质量分数高于Cu(OH)2∙2CuCO 3,D 说法正确。
综上所述,相关说法错误的是C ,故本题答案为C 。
9.(2019江苏) 下列有关化学反应的叙述正确的是A .Fe 在稀硝酸中发生钝化B .MnO 2和稀盐酸反应制取Cl 2C .SO 2与过量氨水反应生成(NH 4)2SO 3D .室温下Na 与空气中O 2反应制取Na 2O 2 【答案】C【解析】A .常温下,Fe 在与浓硝酸发生钝化反应,错误;B .二氧化锰与浓盐酸在加热条件下反应制取氯气,错误;C .二氧化硫与过量氨水反应生成硫酸铵,正确;D .常温下,Na 与空气中的氧气反应生成Na 2O ;加热条件下,钠与氧气反应生成Na 2O 2,错误;综上所述,本题应选C 。
10.(2019·海南高考真题)我国古代典籍中有“石胆……浅碧色,烧之变白色者真”的记载,其中石胆是指() A .42CuSO 5H O ⋅B .42FeSO 7H O ⋅C .42ZnSO 7H O ⋅D .()422KAl SO 12H O ⋅【答案】A【解析】在选项给出的四种物质中只有42CuSO 5H O ⋅、42FeSO 7H O ⋅晶体有色,而42ZnSO 7H O ⋅和()422KAl SO 12H O ⋅均为无色晶体,42CuSO 5H O ⋅加热分解生成CuSO 4和H 2O ,CuSO 4呈白色;而42FeSO 7H O ⋅加热发生分解反应,生成的Fe 2O 3呈红棕色,所以符合题意的物质是42CuSO 5H O ⋅,故合理选项是A 。
11.(2018海南卷)絮凝剂有助于去除工业和生活废水中的悬浮物。
下列物质可作为絮凝剂的是A .NaFe(SO 4)2·6H 2OB .CaSO 4·2H 2OC .Pb(CH 3COO)2·3H 2OD .KAl(SO 4)2·12H 2O【答案】AD【解析】由题意知,絮凝剂有助于去除工业和生活废水中的悬浮物,因此,絮凝剂本身或与水生成的产物具有吸附性。