高中化学《金属晶体》知识点总结:高二
- 格式:doc
- 大小:23.00 KB
- 文档页数:2

高二化学《金属晶体》知识点总结
金属具有导电性、导热性和延展性的原因
延展性:当金属受到外力作用时,晶体中各原子层就会发生相对滑动,但不会改变原来的排列方式,而且弥漫在金属原子间的“电子气”可以起到类似轴承中滚球之间润滑剂的作用,即金属的离子和自由电子之间的较强作用仍然存在,因而金属都有良好的延展性。
导电性:金属内部的原子之间的“电子气”的流动是无方向性的,在外加电场的作用下,电子气在电场中定向移动形成电流。
金属的热导率随温度的升高而降低,是由于电子气中的自由电子在热的作用下与金属原子频繁碰撞的缘故。
4.影响金属熔点、硬度的因素
一般地,熔点、硬度等取决于金属晶体内部作用力的强弱。
一般来说,金属原子的价电子数越多,原子半径越小,金属晶体内部作用力越强,因而晶体熔点越高,硬度越大。
二、关于金属晶体
4.金属之最
在生活生产中使用最广泛的金属是铁;
地壳中含量最多的金属元素是铝;
自然界中最活泼的金属元素是铯;
最稳定的金属单质是金;
最硬的金属单质是铬;
熔点最高的金属单质是钨; 熔点最低的金属单质是汞; 延展性最好的是金;
导电性能最好的是银;
密度最大的是锇。

《金属晶体与离子晶体》知识清单一、金属晶体1、金属键金属原子失去部分或全部外围电子形成的金属离子与自由电子之间存在着强烈的相互作用,这种作用被称为金属键。
金属键没有方向性和饱和性,这使得金属原子趋于紧密堆积,从而形成晶体。
2、金属晶体的原子堆积模型(1)简单立方堆积这种堆积方式中,每个晶胞只有 1 个原子,空间利用率较低,只有约 52%,只有钋(Po)采取这种堆积方式。
(2)体心立方堆积在体心立方堆积中,每个晶胞含有 2 个原子,空间利用率约为 68%,碱金属(如钠、钾等)大多采用这种堆积方式。
(3)六方最密堆积每个晶胞含 2 个原子,空间利用率约为 74%,镁、锌、钛等金属常采用这种堆积方式。
(4)面心立方最密堆积每个晶胞含 4 个原子,空间利用率约为 74%,铜、银、金等金属多采用这种堆积方式。
3、金属晶体的物理性质(1)导电性金属晶体中的自由电子在外加电场的作用下定向移动形成电流,使金属具有良好的导电性。
但不同金属的导电性有所差异,其中银的导电性最好。
(2)导热性自由电子在运动时与金属离子碰撞而交换能量,从而使热量从温度高的区域传递到温度低的区域,使得金属具有良好的导热性。
(3)延展性金属键没有方向性和饱和性,当金属受到外力作用时,原子层之间容易发生相对滑动,但金属键仍然存在,不会断裂,因此金属具有良好的延展性。
二、离子晶体1、离子键阴、阳离子之间通过静电作用形成的化学键称为离子键。
离子键的本质是静电引力,包括阴、阳离子之间的静电引力以及原子核与原子核、电子与电子之间的斥力。
离子键没有方向性和饱和性。
2、离子晶体的结构(1)NaCl 型在 NaCl 晶体中,钠离子和氯离子交替排列,每个钠离子周围有 6 个氯离子,每个氯离子周围也有 6 个钠离子,它们的配位数均为 6。
(2)CsCl 型在 CsCl 晶体中,铯离子位于立方体的中心,氯离子位于立方体的 8 个顶点,铯离子的配位数为 8,氯离子的配位数也为 8。

高中化学晶体知识点高中化学教材中的晶体内容是微观分子、原子结构与宏观物质产生联系的桥梁。
为了帮助高中生掌握晶体知识点,下面店铺为高中生整理化学晶体知识点,希望对大家有所帮助。
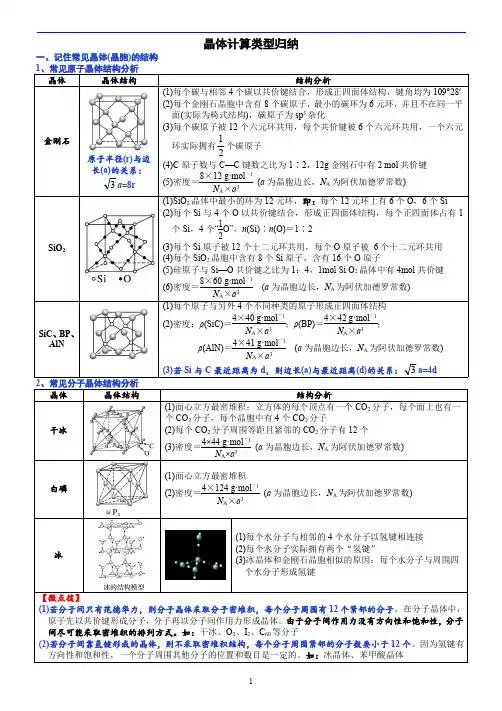
高中化学晶体知识点石墨――混合型晶体石墨晶体为层状结构,层与层之间的作用力为范德华力,每一层内C原子间以共价键形成正六边形结构(见图8)。
由于层内C原子以较强的共价键相结合,所以石墨有较高的熔点。
但由于层间的范德华力较弱,层间可以滑动,故石墨的硬度较小。
因此石墨晶体又称为过渡型晶体或混合型晶体。
石墨品体中每个C原子只拥有其所连接的3个C-C键的1/2(3/2个),因此晶体中C原子与C-C键数之比为2:3。
干冰――分子晶体干冰晶体中的CO2分布在立方体的顶点和面心上,分子间由分子间作用力结合形成晶体(见图7)。
C02分子内存在共价键,因此晶体中既有分子间作用力,又有共价键,但熔、沸点的高低由分子间的作用力决定,影响分子间作用力的主要因素是相对分子质量,从晶胞的结构可知与一个CO2分子距离最近且相等的CO2分子共有12个。
金刚石、二氧化硅――原子晶体(1) 金刚石是一种具有空间网状结构的原子晶体。
每个C原子以共价键与其他4个C原子紧邻,由5个碳子形成正四面体的结构单元,由共价键构成的最小环结构中有6个碳原子(见图4),由于每个C原子拥有所连4个C-C键的1/2(2个),所以碳原子个数与C-C键数之比为1:2。
(2) 二氧化硅晶体可以看成是金刚石结构中,C原子被Si原子代替,且在C-C键之间插入O原子后形成的,即每个硅原子与周围的四个氧原子构成一个正四面体,构成二氧化硅晶体结构的最小环是由12个原子构成椅式环,键角∠(O-Si-O)=109°28'(见图5)。
每个Si原子拥有所连4个O原子的1/2(2个)(见图6),因此si、O原子个数比为1:2,即化学式表示为SiO2。
氯化钠、氯化铯晶体——离子晶体由于离子键无饱和性与方向性,所以离子晶体中无单个分子存在。

化学金属晶体知识点总结一、金属晶体的基本概念金属晶体是由金属原子以一定规律排列组成的固体结构。
金属晶体具有一些特点,如具有金属典型的电性能、热性能和光学性能,同时还具有良好的延展性、韧性和导电性。
二、金属晶体的结构金属晶体的结构是由金属原子通过化学键相互连接而形成的。
金属晶体的结构有多种类型,其中最常见的是面心立方晶体结构和体心立方晶体结构。
金属晶体的结构对金属的性能具有重要影响,比如面心立方晶体结构使得金属具有优良的导电性和导热性,而体心立方晶体结构使得金属具有良好的韧性和延展性。
三、金属晶体的性能1. 导电性:金属晶体中的自由电子能够在晶体结构中自由传导,因此金属具有良好的导电性能。
2. 导热性:金属晶体中的自由电子能够在晶体结构中迅速传递热量,因此金属具有良好的导热性能。
3. 延展性:金属晶体中的金属原子之间的化学键相对较弱,因此金属具有良好的延展性能,可以被拉伸成细丝或者铺展成薄片。
4. 韧性:金属晶体中的金属原子之间的化学键相对较强,因此金属具有良好的韧性能,可以经受一定的外力而不易断裂。
5. 耐腐蚀性:金属晶体中的化学键特点使得金属具有一定的抗腐蚀性能,可以抵御外界腐蚀物质的侵蚀。
四、金属晶体的制备金属晶体的制备方法有多种,常见的包括熔融法、沉淀法、溶胶-凝胶法等。
熔融法是通过将金属加热至熔点后冷却凝固成固体晶体;沉淀法是通过将金属盐溶液中加入适量还原剂使金属物质析出,然后经过洗涤、干燥等处理制备金属晶体;溶胶-凝胶法是通过将金属盐加入溶液中形成凝胶后再经过热处理的方法制备金属晶体。
五、金属晶体的应用金属晶体广泛应用于工业生产中,主要包括金属材料、金属合金、金属催化剂等。
金属材料广泛用于航空航天、汽车制造、机械加工等领域;金属合金具有优异的物理性能和化学性能,用于制备高强度、高耐热、高耐腐蚀的材料;金属催化剂广泛用于化工生产中的有机合成、空气净化等领域。
总的来说,金属晶体是由金属原子组成的固体结构,在工业生产和科研领域有重要应用。

《金属晶体》讲义一、引入在我们的日常生活中,金属无处不在。
从我们使用的厨具到交通工具,从电子设备到建筑结构,金属都发挥着重要的作用。
那么,是什么赋予了金属独特的性质呢?这就不得不提到金属的晶体结构。
二、金属晶体的定义与特点金属晶体是由金属原子通过金属键结合而成的晶体。
金属键是一种特殊的化学键,它使得金属原子能够紧密地堆积在一起,形成有序的结构。
金属晶体具有以下几个特点:1、良好的导电性和导热性:由于金属原子中的价电子在整个晶体中自由移动,所以金属能够很好地传导电流和热量。
2、具有金属光泽:这是因为金属中的自由电子能够吸收并反射可见光。
3、延展性和可塑性:金属原子之间的结合没有方向性和饱和性,因此金属可以在受到外力作用时发生原子的相对滑动而不破坏金属键,从而表现出良好的延展性和可塑性。
三、金属晶体的常见结构类型1、体心立方结构(BCC)在体心立方结构中,每个晶胞包含 8 个顶角原子和 1 个体心原子。
例如,碱金属中的钠、钾等在低温时就具有这种结构。
这种结构的致密度约为 068,原子配位数为 8。
2、面心立方结构(FCC)面心立方结构的晶胞包含 8 个顶角原子和 6 个面心原子。
许多常见的金属,如金、银、铜等都具有这种结构。
面心立方结构的致密度约为 074,原子配位数为 12,是金属晶体中原子排列最紧密的结构之一。
3、密排六方结构(HCP)密排六方结构的晶胞由 12 个顶角原子、2 个面心原子和 3 个体内原子组成。
镁、锌等金属采用这种结构。
其致密度与面心立方结构相近,原子配位数也是 12。
四、金属晶体的原子堆积方式1、简单立方堆积这是最简单的一种堆积方式,每个原子都与相邻的 6 个原子接触,空间利用率很低。
2、体心立方堆积在体心立方堆积中,除了顶角的原子外,晶胞中心还有一个原子。
这种堆积方式的空间利用率比简单立方堆积要高。
3、面心立方最密堆积这是原子堆积最紧密的一种方式,原子按照ABCABC……的顺序堆积,空间利用率达到最高。


《金属晶体》讲义一、引言在我们的日常生活中,金属无处不在,从常见的金银铜铁,到高科技领域中的钛、铬等特种金属,它们都有着广泛的应用。
而要理解金属的各种性质,就需要深入探究其内部的结构——金属晶体。
二、金属晶体的定义和特点金属晶体是由金属原子通过金属键结合而成的晶体。
金属键是一种特殊的化学键,它使得金属原子能够紧密堆积在一起,形成有序的结构。
金属晶体具有以下几个显著特点:1、良好的导电性和导热性:这是由于金属晶体中的自由电子能够在晶体中自由移动,传递电荷和能量。
2、金属光泽:自由电子对可见光的吸收和反射,使金属呈现出独特的光泽。
3、延展性和可塑性:金属原子之间的相对滑动较为容易,使得金属能够被拉伸、弯曲和塑形。
三、金属晶体的结构类型1、体心立方堆积(bcc)在这种结构中,每个晶胞包含 8 个顶角原子和 1 个体心原子。
例如,碱金属中的钠、钾等就采用这种堆积方式。
其空间利用率相对较低。
2、面心立方堆积(fcc)晶胞含有 8 个顶角原子和 6 个面心原子。
像铜、银、金等金属通常采用这种堆积结构,其空间利用率较高,具有良好的延展性。
3、密排六方堆积(hcp)每个晶胞包含 12 个顶角原子和 2 个内原子。
锌、镁等金属常呈现这种结构。
四、金属晶体中原子的堆积方式为了实现最紧密的堆积,金属原子通常会采取不同的堆积方式。
1、二维平面上的密堆积有两种常见的方式,分别是“AB 型”和“ABC 型”。
2、三维空间中的密堆积就是将二维平面上的密堆积方式在三维空间中延伸。
五、金属晶体的性质与结构的关系1、导电性自由电子的存在和运动是金属能够导电的关键。
结构紧密、自由电子活动空间大的金属晶体,导电性往往更好。
2、导热性自由电子在传递能量方面发挥着重要作用,原子排列越紧密,导热性能越强。
3、延展性和可塑性原子间结合力的强弱以及原子的堆积方式,决定了金属的延展性和可塑性。
六、影响金属晶体性质的因素1、原子半径原子半径的大小会影响原子之间的距离和相互作用,从而影响晶体的结构和性质。

金属晶体结晶知识点总结一、晶体结晶概念及原子排列规律1. 晶体结晶概念:晶体是由一定种类的原子或者分子按照一定的排列顺序和规则组成的固体物质,具有周期性排列结构和明显的晶体性质。
2. 晶体的原子排列规律:晶体的结晶形式是由原子或分子的周期性排列而形成的,这种排列具有高度规则性和周期性,其排列方式受到晶体内部原子结构和晶体生长条件的影响。
二、晶体的基本结构1. 金属晶体的结构:金属晶体基本结构是由金属离子或原子经过排列而成。
在金属晶格中,金属原子之间由金属键结合,通过电子云间的共享而形成结晶结构。
2. 晶体的晶格:晶体的结构由晶格组成,晶格是由一系列平行排列的基本单元组成的。
晶格在三维空间中构成晶体的结构基础,束缚着晶体材料的原子或离子。
3. 晶体的晶胞:晶体的基本结构单元是晶胞,晶胞是晶体内可以复制整个晶体结构的最小重复单元,是晶体中基本的空间单位。
三、晶体生长1. 晶体生长的条件:晶体生长的条件包括适当的温度、压力和爆发原子。
晶体的生长过程受到物理、化学条件和材料的约束。
2. 晶体的生长方式:晶体生长方式分为固体相生长和溶液相生长两种方式,固体相生长是指晶体在固态材料中生长,溶液相生长是指晶体在溶液中生长。
3. 晶体生长的影响因素:晶体生长过程中受到多种因素的影响,包括溶液浓度、温度、溶液饱和度、晶种的形状和结构等。
四、晶体结构及其性能1. 晶体的结构类型:晶体的结构分为立方晶系、四方晶系、正交晶系、单斜晶系、三斜晶系、六方晶系六种。
2. 晶体结构对性能的影响:晶体的结构类型决定了晶体的物理、化学和机械性能,不同的结构对材料的性能有不同的影响。
3. 晶体的晶格缺陷:晶格缺陷是指晶格中原子位置的缺失、位错、夹杂等现象,这些缺陷会影响晶体的性能和行为。
五、晶体的性能1. 金属的晶体缺陷:金属晶体包括点缺陷、线缺陷、面缺陷等,这些缺陷对金属的力学性能、导电性能和腐蚀性能有重要影响。
2. 晶体的热学性能:晶体的热学性能包括热导率、线膨胀系数、比热容等,这些性能与晶体结构和晶格缺陷有关。


《金属晶体》讲义一、金属晶体的定义与基本特征在我们的日常生活中,金属制品无处不在,从厨房里的锅碗瓢盆到建筑中的钢梁铁柱,从交通工具上的零部件到电子设备中的芯片导线。
那么,是什么赋予了金属独特的性质呢?这就不得不提到金属晶体。
金属晶体是指由金属原子通过金属键结合而成的晶体。
与其他类型的晶体(如离子晶体、原子晶体和分子晶体)相比,金属晶体具有一些显著的特点。
首先,金属晶体中的金属原子通常形成紧密堆积的结构。
这意味着原子之间的空间被尽可能地填满,以实现较高的原子空间利用率。
这种紧密堆积结构使得金属具有较高的密度和良好的延展性。
其次,金属键没有方向性和饱和性。
这使得金属原子能够在一定范围内相对自由地移动,从而使金属具有良好的导电性和导热性。
二、金属晶体的结构类型1、体心立方堆积(bcc)体心立方堆积的结构中,每个晶胞包含两个原子,一个位于立方体的体心,另外八个位于立方体的八个顶点。
这种结构的金属,如钾(K)、钠(Na)等,在常温下通常比较柔软,具有一定的延展性。
2、面心立方堆积(fcc)面心立方堆积是一种更为紧密的堆积方式,每个晶胞包含四个原子,分别位于立方体的六个面的中心和八个顶点。
许多常见的金属,如铜(Cu)、银(Ag)、金(Au)等都采用这种结构。
这种结构使得金属具有良好的延展性和导电性。
3、密排六方堆积(hcp)密排六方堆积的晶胞是一个六棱柱,每个晶胞包含六个原子。
采用这种结构的金属,如镁(Mg)、锌(Zn)等,也具有一定的延展性和导电性。
三、金属晶体中的原子半径在金属晶体中,原子半径并不是一个固定的值,它会受到原子的堆积方式以及周围原子的影响。
我们通常所说的原子半径,是指在金属晶体中相邻两个原子之间距离的一半。
对于同一种金属元素,采用不同的堆积方式时,原子半径可能会有所不同。
此外,不同的金属元素,其原子半径也存在差异。
一般来说,原子序数越大,原子半径越大,但这也不是绝对的,还会受到电子构型等因素的影响。
人教版高三化学选修3第三章金属晶体知识点高三新学期大家要学习很多化学知识点,相对于其它学科来说化学知识点比较琐碎,因此在课下多进行复习巩固,下面为大家带来人教版高三化学选修3第三章金属晶体知识点,希望对大家学好高三化学知识有帮助。
1.几种化学键的比较2.金属具有导电性、导热性和延展性的原因(1)延展性:当金属受到外力作用时,晶体中各原子层就会发生相对滑动,但不会改变原来的排列方式,而且弥漫在金属原子间的电子气可以起到类似轴承中滚球之间润滑剂的作用,即金属的离子和自由电子之间的较强作用仍然存在,因而金属都有良好的延展性。
(2)导电性:金属内部的原子之间的电子气的流动是无方向性的,在外加电场的作用下,电子气在电场中定向移动形成电流。
(3)金属的热导率随温度的升高而降低,是由于电子气中的自由电子在热的作用下与金属原子频繁碰撞的缘故。
3.金属导电与电解质溶液导电的比较。
4.影响金属熔点、硬度的因素一般地,熔点、硬度等取决于金属晶体内部作用力的强弱。
一般来说,金属原子的价电子数越多,原子半径越小,金属晶体内部作用力越强,因而晶体熔点越高,硬度越大。
5.金属之最(1)在生活生产中使用最广泛的金属是铁(一般是铁与碳的合金);(2)地壳中含量最多的金属元素是铝(Al);(3)自然界中最活泼的金属元素是铯(Cs);(4)最稳定的金属单质是金(Au);(5)最硬的金属单质是铬(Cr);(6)熔点最高的金属单质是钨(3 413℃)(W);(7)熔点最低的金属单质是汞(-39℃)(Hg);(8)延展性最好的是金(Au);(9)导电性能最好的是银(Ag);(10)密度最大的是锇(22.57 gcm-3)(Os)。
以上就是为大家带来的人教版高三化学选修3第三章金属晶体知识点,希望我们能够好好掌握化学知识点,从而在考试中取的好的化学成绩。
金属晶体离子晶体【学习目标】1、知道金属键的涵义,能用金属键理论解释金属的一些物理性质;能列举金属晶体的基本规程模型——简单立方堆积、钾型、镁型和铜型;2、能说明离子键的形成,能根据离子化合物的结构特征解释其物理性质;了解离子晶体的特征;了解晶格能的应用,知道晶格能的大小可以衡量离子晶体中离子键的强弱;3、知道离子晶体、金属晶体的结构粒子、粒子间作用力的区别;4、在晶体结构的基础上进一步知道物质是由粒子构成的,并了解研究晶体结构的基本方法;敢于质疑,勤于思索,形成独立思考的能力;养成务实求真、勇于创新、积极实践的科学态度。
【要点梳理】要点一、金属键【金属晶体与离子晶体#金属键】1、金属键与电子气理论:①金属键:金属原子的电离能低,容易失去电子而形成阳离子和自由电子,阳离子整体共同吸引自由电子而结合在一起。
金属键可看成是由许多金属离子共用许多电子的一种特殊形式的共价键,这种键既没有方向性也没有饱和性,金属键的特征是成键电子可以在金属中自由流动,使得金属呈现出特有的属性。
在金属单质的晶体中,原子之间以金属键相互结合。
金属键是一种遍布整个晶体的离域化学键。
②电子气理论:描述金属键本质的最简单理论是“电子气理论”。
该理论把金属键形象地描绘成从金属原子上“脱落”下来的大量自由电子形成可与气体相比拟的带负电的“电子气”,金属原子则“浸泡”在“电子气”的“海洋”之中。
金属原子脱落下来的自由电子形成遍布整块晶体的“电子气”,被所有金属阳离子所共用,从而把所有的金属原子维系在一起。
由此可见,金属晶体跟原子晶体一样,是一种“巨分子”。
小结:要点诠释:金属晶体的一般性质及其结构根源由于金属晶体中存在大量的自由电子和金属离子(或原子)排列很紧密,使金属具有很多共同的性质。
①状态:通常情况下,除Hg外都是固体;②有自由电子存在, 是良好的导体;③自由电子与金属离子碰撞传递热量,具有良好的传热性能;④自由电子能够吸收可见光并能随时放出, 使金属不透明, 且有光泽;⑤等径圆球的堆积使原子间容易滑动, 所以金属具有良好的延展性和可塑性;⑥金属间能“互溶”, 易形成合金。
《金属晶体》讲义一、金属晶体的定义与特点金属晶体是指由金属原子通过金属键结合而成的晶体。
在金属晶体中,金属原子失去部分或全部外层电子,形成自由电子,这些自由电子在整个晶体中自由运动,与金属阳离子相互作用,将金属原子紧密地结合在一起。
金属晶体具有以下特点:1、良好的导电性和导热性:由于存在自由电子,它们能够在电场的作用下定向移动,从而形成电流,实现良好的导电性;自由电子在热的作用下也能迅速传递热能,使得金属具有良好的导热性。
2、金属光泽:自由电子能够吸收并反射可见光,使金属具有独特的金属光泽。
3、延展性:金属晶体中的原子可以相对滑动而不断裂金属键,从而使金属具有良好的延展性,可以被拉成丝或压成薄片。
4、硬度和熔点有较大差异:不同金属的晶体结构和金属键强度不同,导致其硬度和熔点差异较大。
二、金属晶体的结构类型常见的金属晶体结构有以下三种类型:1、体心立方堆积(bcc)体心立方堆积的晶胞中,每个晶胞包含 8 个位于顶角的原子和 1 个位于体心的原子。
例如,碱金属中的锂、钠、钾等在常温下采用这种堆积方式。
这种结构的空间利用率相对较低。
2、面心立方堆积(fcc)面心立方堆积的晶胞中,每个晶胞包含 8 个位于顶角的原子和 6 个位于面心的原子。
铜、银、金等金属通常采用这种堆积方式。
面心立方堆积的空间利用率较高,具有较好的延展性和塑性。
3、密排六方堆积(hcp)密排六方堆积的晶胞是一个六棱柱,每个晶胞包含 12 个位于顶角的原子和2 个位于体内的原子。
镁、锌、钛等金属采用这种堆积方式。
三、金属键的本质金属键是一种特殊的化学键,其本质是金属原子失去电子形成的正离子与自由电子之间的强烈相互作用。
金属原子的价电子数较少,原子核对价电子的束缚较弱,在一定条件下容易失去电子。
这些失去的电子不再属于某个特定的原子,而是在整个晶体中自由运动,形成“电子气”。
金属正离子沉浸在“电子气”中,它们与自由电子之间的静电吸引力使得金属原子紧密结合在一起,形成金属晶体。
《金属晶体》讲义一、金属晶体的定义和特点在我们日常生活中,金属制品无处不在,从厨房的锅碗瓢盆到交通工具的零部件,从建筑结构中的钢梁到电子设备中的芯片。
而这些金属之所以具有独特的性质,很大程度上归因于它们的内部结构——金属晶体。
金属晶体,简单来说,就是由金属原子通过金属键结合而成的晶体。
金属键是一种特殊的化学键,它使得金属原子能够紧密地堆积在一起,形成有序的结构。
金属晶体具有一些显著的特点。
首先,它们具有良好的导电性和导热性。
这是因为在金属晶体中,存在大量自由移动的电子,这些电子能够迅速传递电荷和能量。
其次,金属晶体通常具有较高的强度和延展性。
这意味着它们能够承受较大的外力而不易断裂,同时还能够被拉伸、弯曲或压制成各种形状。
二、金属晶体的结构类型常见的金属晶体结构有三种主要类型:体心立方结构(BCC)、面心立方结构(FCC)和密排六方结构(HCP)。
1、体心立方结构在体心立方结构中,每个晶胞的中心有一个原子,而八个顶点上各有一个原子。
这种结构的金属,如钨、钼等,具有较高的熔点和硬度,但延展性相对较差。
2、面心立方结构面心立方结构的晶胞,除了八个顶点上各有一个原子外,每个面的中心还有一个原子。
具有这种结构的金属,如铜、铝等,通常具有良好的延展性和导电性。
3、密排六方结构密排六方结构的晶胞由六个呈六边形排列的原子组成上下底面,在上下底面之间还有三个原子。
镁、锌等金属具有这种结构。
不同结构的金属晶体,其性能也会有所差异。
这取决于原子的排列方式以及原子间的结合强度。
三、金属晶体中的原子堆积方式为了更有效地利用空间,金属原子在形成晶体时会采用特定的堆积方式。
1、简单立方堆积这是最基本的堆积方式,每个原子都与周围的六个原子相切。
但这种堆积方式空间利用率较低,实际中较少出现。
2、体心立方堆积在体心立方堆积中,除了顶点的原子外,晶胞中心还有一个原子。
这种堆积方式的空间利用率有所提高。
3、面心立方最密堆积这是一种空间利用率很高的堆积方式,每个原子都与周围的 12 个原子相切,如金、银等金属常采用这种堆积方式。
第2节金属晶体与离子晶体第1课时金属晶体【学习目标】1.进一步熟悉金属晶体的概念和特征,能用金属键理论解释金属晶体的物理性质。
2.知道金属晶体中晶胞的堆积方式。
3.学会关于金属晶体典型计算题目的分析方法。
【新知导学】一、金属晶体及常见金属晶体的结构型式1.阅读教材填空:(1)金属原子通过________形成的晶体称为金属晶体。
(2)金属键是指__________和______之间的强相互作用。
(3)由于__________________,所以金属键______方向性和饱和性,从而导致金属晶体最常见的结构型式具有堆积密度大,原子配位数高,能充分利用空间等特点。
2.、、、、【归纳总结】组成晶体的金属原子在没有其他因素影响时,在空间的排列大都服从紧密堆积原理。
这是因为在金属晶体中,金属键没有方向性和饱和性,因此都趋向于使金属原子吸引更多的其他原子分布于周围,并以密堆积方式降低体系的能量,使晶体变得比较稳定。
【活学活用】1.有四种不同堆积方式的金属晶体的晶胞如下图所示,有关说法正确的是()A.①为简单立方堆积,②为六方最密堆积,③为体心立方密堆积,④为面心立方最密堆积B.每个晶胞含有的原子数分别为①1个,②2个,③6个,④4个C.晶胞中原子的配位数分别为①6,②8,③8,④12D.空间利用率的大小关系为①<②<③<④2.Al的晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。
若已知Al的原子半径为d,N A代表阿伏加德罗常数,Al的相对原子原子质量为M,请回答:(1)晶胞中Al原子的配位数为________,一个晶胞中Al原子的数目为________。
(2)该晶体的密度为__________(用字母表示)。
3.铜的堆积方式属于A1型紧密堆积,其晶胞示意图为______(填字母)。
晶胞中所含的铜原子数为______个。
金属铜晶胞为面心立方最密堆积,边长为a cm。
高中化学《金属晶体》知识点总结:高二
.金属具有导电性、导热性和延展性的原因
(1)延展性:当金属受到外力作用时,晶体中各原子层就会发生相对滑动,但不会改变原来的排列方式,而且弥漫在金属原子间的“电子气”可以起到类似轴承中滚球之间润滑剂的作用,即金属的离子和自由电子之间的较强作用仍然存在,因而金属都有良好的延展性。
(2)导电性:金属内部的原子之间的“电子气”的流动是无方向性的,在外加电场的作用下,电子气在电场中定向移动形成电流。
(3)金属的热导率随温度的升高而降低,是由于电子气中的自由电子在热的作用下与金属原子频繁碰撞的缘故。
4.影响金属熔点、硬度的因素
一般地,熔点、硬度等取决于金属晶体内部作用力的强弱。
一般来说,金属原子的价电子数越多,原子半径越小,金属晶体内部作用力越强,因而晶体熔点越高,硬度越大。
二、关于金属晶体
4.金属之最
(1)在生活生产中使用最广泛的金属是铁(一般是铁与
碳的合金);
(2)地壳中含量最多的金属元素是铝(Al);
(3)自然界中最活泼的金属元素是铯(Cs);
(4)最稳定的金属单质是金(Au);
(5)最硬的金属单质是铬(Cr);
(6)熔点最高的金属单质是钨(3 413℃)(W);
(7)熔点最低的金属单质是汞(-39℃)(Hg);
(8)延展性最好的是金(Au);
(9)导电性能最好的是银(Ag);
(10)密度最大的是锇(22.57 g cm-3)(Os)。