烯烃的结构和异构.共81页文档
- 格式:ppt
- 大小:6.33 MB
- 文档页数:81


【知识拓展】烯烃-----烯烃结构与命名
(一)烯烃的同分异构现象
烯烃的通式: CnH2n。
烯烃的官能团:C=C
1.构造异构
2.顺反异构
(a)反-2-丁烯(b) 顺-2-丁烯
(二)烯烃的结构
1.碳的sp2杂化及乙烯的结构
碳原子的sp2杂化过程如下:
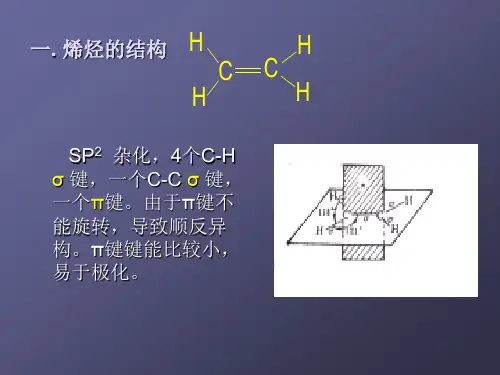
乙烯分子形成时,两个碳原子各以一个sp2杂化轨道沿键轴方向重叠形成一个C—Cσ键,并以剩余的两个sp2杂化轨道分别与两个氢原子的1s轨道沿键轴方向重叠形成四个等同的C—Hσ键,五个σ键都在同一平面内,因此乙烯为平面构型。
此外,每个碳原子上还有一个未参与杂化的p轨道,两个碳原子的p轨道相互平行,于是侧面重叠成键。
这种成键原子的p轨道侧面重叠形成的共价键叫做π键。
乙烯分子中的σ键和π键如图3-2所示。
乙烯分子的结构。

第三章烯烃和炔烃第一部分:烯烃烯烃的结构和异构烯烃的命名烯烃的物理性质烯烃的化学性质烯烃的制法烯烃当中双键碳原子的sp2杂化C: 1s22s22p2sp2杂化1s22s12p12p y12p z1x烯烃当中双键碳原子的sp2杂化.一个s轨道、两个p轨道“杂化”形成三个等同的sp2杂化轨道。
sp2杂化轨道的形状与sp3杂化轨道类似。
三个sp2杂化轨道的对称轴在同一平面上,互成120°角,大头一瓣指向正三角形的三个角顶。
碳原子上另一个未杂化的pz 轨道垂直于sp2杂化轨道对称轴所在的平面。
乙烯中的两个碳原子各以一个sp 2轨道相结合,形成一个C-C σ键:剩余的两个sp 2轨道还与H 的轨道结合形成两个C-H σ键。
乙烯分子:只表示出σ键乙烯的结构每个双键碳原子剩下的2p轨道(各有一个电子)垂直于sp2杂化轨道所在的平面,两个p轨道平行重叠形成一种新的键,称为π键π键由两部分组成:一部分电子云在原子平面的上方,另一部分在下方。
构成π键的电子云称为π电子云。
C CH HH HC CHH HHππ烯烃分子中的π键分子中的六个原子(C、H)及五个σ键都处于同一平面键角(bond angles):H-C-H = 117.5°H-C-C = 121°键长(bond distances): C—H = 0.110 nmC=C = 0.134 nm乙烯的结构乙烯分子是一个平面分子分子中六个原子及所形成的五个 键都处在同一平面,每一个碳都是sp2杂化结构已为电子衍射和光谱研究所证实每一个碳都有一个半充满的p 轨道Each carbon has a half-filled p orbital两个p轨道平行重叠,形成 键乙烯中C-C之间,除了σ键之外,还多了一个π键,键能增强,所以C-C键短另外,乙烯中碳为sp 2杂化,轨道s成分大,核对电子云的束缚紧,键能增强,键距缩短。
也会导致C-H键变短乙烯乙烷乙烯中C-C 键键长比乙烷中C-C 键长略短的原因? 乙烯中C-H 键键长比乙烷中C-H 键长略短的原因?丙烯中C-C 单键的键长(0.150nm )比乙烷中C-C 键长(0.153nm )略短。


3.1 烯烃的结构和命名烯烃的结构烯烃的异构现象和命名3.1 烯烃的结构和命名烯烃(alkene):含有碳碳双键(C=C)的不饱和烃。
单烯烃分子中只有一个碳碳双键,通式是C n H2n。
碳碳双键又叫做烯键, 是烯烃的官能团。
最简单的烯烃是乙烯:3.1 烯烃的结构和命名2p 21sp激发杂化sp sp1、sp2杂化2s2p x2p y sp2杂化轨道一. 烯烃的结构三个sp 2轨道的对称轴分布在同一平面上,以碳原子为中心指向三角形的顶点,夹角120°。
未杂化p z 轨道3.1 烯烃的结构和命名1、sp 2杂化一. 烯烃的结构未杂化的2p 轨道保持原来形状,垂直于三个sp 2轨道所在的平面。
3.1 烯烃的结构和命名一. 烯烃的结构1、sp2杂化sp2轨道比sp3轨道有效大小要小些:p轨道向外伸展离原子核较远,而s轨道则紧处于原子核周围;sp2轨道含s成分比sp3多,p成分少。
故当轨道中s成分增加时,轨道的有效大小就减小。
3.1 烯烃的结构和命名一. 烯烃的结构1、sp2杂化sp2-sp3C-C键比sp3-sp3 C-C键短。
sp2-sp2C-C键比sp2-sp3 C-C键短。
sp2-s C-H键比sp3-s C-H键短。
3.1 烯烃的结构和命名一、烯烃的结构2、双键的结构5个σ键:1个sp2-sp2C-C σ键4个sp2-s C-H σ键1个π键:两个碳的p轨道互相平行,侧面(肩并肩)重叠。
3.1 烯烃的结构和命名一、烯烃的结构π键不同于σ键, π键具有以下特点:1)π键无轴对称, 不能自由旋转。
2)π键键能比σ键键能小。
3)π电子云具有流动性C=C 键能C-C 键能611 -347 =264 kJ/mol 2、双键的结构π电子云位于成键原子的上下两层, 原子核对π电子云的束缚能力弱,因此, π键易被试剂进攻发生反应, π键比σ键更活泼。
破坏π键的能量3.1 烯烃的结构和命名一、烯烃的结构2、双键的结构物理方法证明:3)双键键长0.134nm 比单键键长0.154nm 短;1)所有碳原子和氢原子共平面;2)键角接近120°(C-C-H 键角是121.7°,H-C-H 键角是117°)键的不等同性引起的;乙烯121.7°117°0.134nm0.108nm 0.154nm0.109nm 乙烷3.1 烯烃的结构和命名1、烯烃的同分异构现象二、烯烃的异构现象和命名碳架异构顺反异构(一种构型异构,立体异构的一种)(官能团)位置异构构造异构烯烃的同分异构3.1 烯烃的结构和命名1、烯烃的同分异构现象二、烯烃的异构现象和命名CH 3-CH 2-CH=CH 2(1)CH 3-CH =CH-CH 3(2)CH 3CH 3-C=CH 2(3)顺式cis(两个相同基团处于双键同侧)反式trans(两个相同基团处于双键异侧)以丁烯为例:CH 3C CH CH 3H(4)C CCH 3HCH H(5)3.1 烯烃的结构和命名1、烯烃的同分异构现象二、烯烃的异构现象和命名产生顺反异构的条件:②每个双键或环上碳原子连接2个不相同的原子或基团;c C Cda 只有a≠b和c≠d时,才有顺反异构;顺反异构体,因几何形状(结构)不同,物理性质不同。


