膜蛋白提取方法
- 格式:pdf
- 大小:220.38 KB
- 文档页数:3
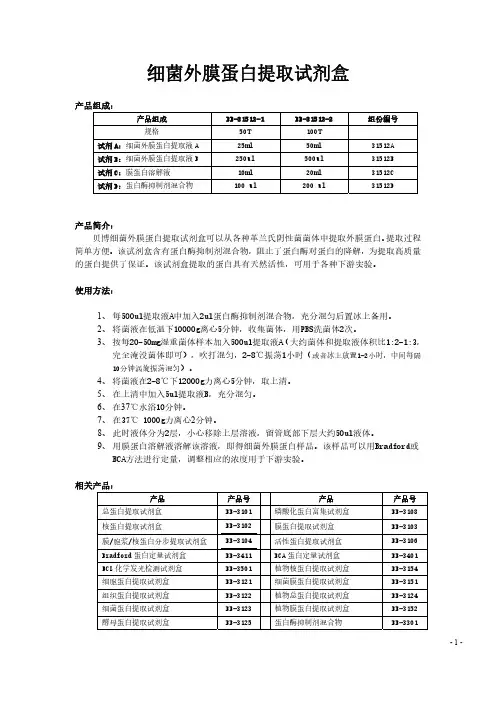
细菌外膜蛋白提取试剂盒产品组成:产品组成 BB-31512-1 BB-31512-2 组份编号规格 50T 100T试剂A:细菌外膜蛋白提取液A 25ml 50ml 31512A试剂B:细菌外膜蛋白提取液B 250ul 500ul 31512B试剂C:膜蛋白溶解液 10ml 20ml 31512C试剂D:蛋白酶抑制剂混合物 100 ul 200 ul 31512D产品简介:贝博细菌外膜蛋白提取试剂盒可以从各种革兰氏阴性菌菌体中提取外膜蛋白。
提取过程简单方便。
该试剂盒含有蛋白酶抑制剂混合物,阻止了蛋白酶对蛋白的降解,为提取高质量的蛋白提供了保证。
该试剂盒提取的蛋白具有天然活性,可用于各种下游实验。
使用方法:1、每500ul提取液A中加入2ul蛋白酶抑制剂混合物,充分混匀后置冰上备用。
2、将菌液在低温下10000g离心5分钟,收集菌体,用PBS洗菌体2次。
3、按每20-50mg湿重菌体样本加入500ul提取液A(大约菌体和提取液体积比1:2-1:3,完全淹没菌体即可),吹打混匀,2-8℃振荡1小时(或者冰上放置1-2小时,中间每隔10分钟涡旋振荡混匀)。
4、将菌液在2-8℃下12000g力离心5分钟,取上清。
5、在上清中加入5ul提取液B,充分混匀。
6、在37℃水浴10分钟。
7、在37℃ 1000g力离心2分钟。
8、此时液体分为2层,小心移除上层溶液,留管底部下层大约50ul液体。
9、用膜蛋白溶解液溶解该溶液,即得细菌外膜蛋白样品。
该样品可以用Bradford或BCA方法进行定量,调整相应的浓度用于下游实验。
相关产品:产品 产品号 产品 产品号 总蛋白提取试剂盒BB-3101 磷酸化蛋白富集试剂盒 BB-3108核蛋白提取试剂盒 BB-3102 膜蛋白提取试剂盒 BB-3103膜/胞浆/核蛋白分步提取试剂盒 BB-3104 活性蛋白提取试剂盒 BB-3106Bradford蛋白定量试剂盒 BB-3411 BCA蛋白定量试剂盒 BB-3401ECL化学发光检测试剂盒 BB-3501 植物核蛋白提取试剂盒 BB-3154细胞蛋白提取试剂盒 BB-3121 细菌膜蛋白提取试剂盒 BB-3151组织蛋白提取试剂盒 BB-3122 植物总蛋白提取试剂盒 BB-3124细菌蛋白提取试剂盒 BB-3123 植物膜蛋白提取试剂盒 BB-3152酵母蛋白提取试剂盒 BB-3125蛋白酶抑制剂混合物 BB-3301- 1 -昆虫蛋白提取试剂盒 BB-3126真菌蛋白提取试剂盒 BB-3127磷酸化蛋白提取试剂盒 BB-3105 磷酸酶抑制剂混合物 BB-3311SDS-PAGE凝胶配制试剂盒 BB-3702 SDS-PAGE上样Buffer BB-3703总蛋白提取试剂盒(2D电泳用) BB-3181 细菌蛋白提取盒(2D电泳用) BB-3182植物蛋白提取盒(2D电泳用) BB-3183 酵母蛋白提取盒(2D电泳用) BB-3185细菌膜蛋白提取盒(2D电泳用) BB-3187 线粒体蛋白提取盒(2D电泳用)BB-3191- 2 -。

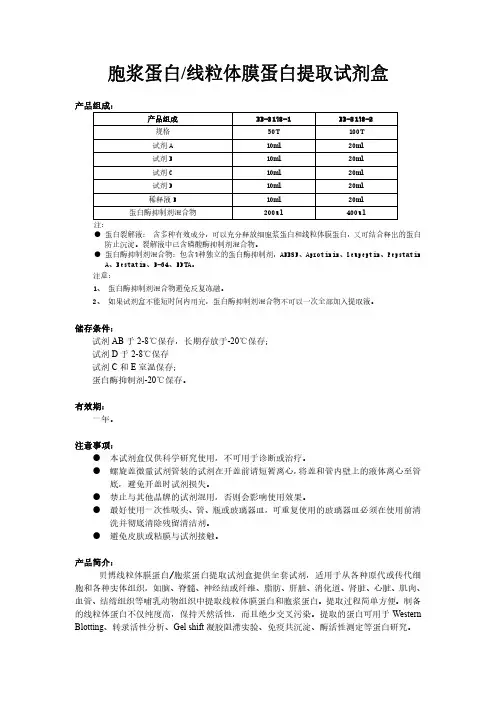

细菌总蛋白和膜蛋白提取方法一、从新鲜样品中提取总蛋白(简易法)1、自配裂解液(pH ):50 mM Tris-HCl,2 mM EDTA, 100 mM NaCl,% Triton X-100,调pH 值至备用;用前加入100 μg/ml 溶菌酶,1μl/ml 的蛋白酶抑制剂PMSF。
该裂解液用量为10-50ml 裂解液/1g湿菌体。
2、将40ml 菌液在12000g,4℃下离心15分钟收集菌体,沉淀用PBS悬浮洗涤2遍,沉淀加入1ml裂解液悬浮菌体。
3、超声粉碎,采用300w,10s超声/10s间隔,超声20min,反复冻融超声3次至菌液变清或者变色。
4、1000g离心去掉大碎片,上清可直接变性后PAGE电泳检测,或者用1% SDS溶液透析后冻存。
缺点:Western blotting结果表明,疏水性跨膜蛋白提取效率有限。
二、从Trizol裂解液中分离总蛋白1、Trizol溶解的样品研磨破碎后,加氯仿分层,2-8℃下10000g离心15min,上层水相用于RNA提取,体积约为总体积的60%。
2、用乙醇沉淀中间层和有机相中的DNA。
每使用1ml Trizol加入无水乙醇混匀,室温放置3min,2-8℃不超过2000g离心5min。
3、将上清移至新的EP管中,用异丙醇沉淀蛋白质。
每使用1ml Trizol加入异丙醇,室温放置10min,2-8℃下12000g离心10min,弃上清。
4、用含有0.3M 盐酸胍的95%乙醇洗涤。
每1ml Trizol加入2ml洗液,室温放置20min,2-8℃下7500g离心5min,弃上清,重复洗涤2次。
最后加入2ml无水乙醇,涡旋后室温放置20min,2-8℃下7500g离心5min,弃上清。
5、冷冻干燥5-10min,1%SDS溶液溶解,反复吹打,50℃温浴使其完全溶解,2-8℃下10000g 离心10min去除不溶物。
6、替代方案:将3中的酚醇上清液移至小分子量透析袋中,在2-8℃的1% SDS溶液中透析3次,1000g离心10min去除沉淀,上清可直接用于蛋白实验。

膜蛋白的提取:用冰浴1×PBS洗两次,加入细胞裂解液(step⌝ 1),刮下细胞;用27-Gauge针头吹吸5次,冰上静置5min;⌝4℃,3000g,离心10min,取上清进行下一步离心,沉淀保留(其中含有细胞碎片和细胞核);⌝4℃,12000g,离心10min,取上清进行下一步离心,沉淀保留(其中含有线粒体,内质网等细胞浆成分);⌝4℃,130000g,离心30min,将上清收集至另一Eppendorf管内(其中含有其它胞浆蛋白);⌝用膜蛋白裂解液(step⌝ 2)溶解沉淀(其中含有细胞膜蛋白);于95℃变性5min,将所有样品(各步沉淀)保存于-80℃。
⌝1 细胞质膜资料1895年,Overton从研究细胞透性得出"细胞膜由连续的脂类物质组成"。
1925年Gorter&Grendel:用脂单分子膜技术测定细胞膜中脂分子的总面积,提出:"细胞膜是由双层脂分子组成"。
1935年Danielli&Davson:从测定膜的表面张力得出细胞膜的"三明治结构模型",即蛋白质-脂-蛋白质。
1959年Robertson:用电镜观察生物膜提出"单位膜模型",将膜的分子结构与超微机构统一起来厚度:2(暗)+3.5(亮〕+2(暗)=7.5细胞质膜的主要功能概括如下:(1) 为细胞的生命活动提供相对稳定的内环境;(2) 选择性的物质运输,包括代谢底物的输入与代谢产物的排除,其中伴随着能量的传递;(3) 提供细胞识别位点,并完成细胞内外信息跨膜传递;(4) 为多种酶提供结合位点,使酶促反应高效而有序地进行;(5) 介导细胞与细胞、细胞与基质之间的连接;质膜参与形成具有不同功能的细胞表面特化结构。
2 膜蛋白虽动物细胞主要有9种膜脂,而膜蛋白的种类繁多,多数膜蛋白分子数目较少,但却赋予细胞膜非常重要的生物学功能。
根据膜蛋白分离的难易及其与脂分子的结合方式,膜蛋白可分为两大类型:外在膜蛋白、内在膜蛋白。

提取蛋白质的4种方法
1. 离子交换:离子交换是最常用的蛋白质提取方法,它使用含有
有机硫酸盐的磷酸盐溶液来提取pH4-9之间的膜蛋白。
它使用有机硫
酸盐作为极性试剂,使蛋白质从其离子溶液中沉淀出来并固定到树脂上,从而被提取。
2. 垂直层析:垂直层析是蛋白质提取的另一种方法,它使用流动
相来垂直运动横穿膜,从而把低浓度的蛋白质从其结晶盐溶液中提取
出来。
它是一种有效的后处理方法,能有效地改善提取的蛋白质的细节、稳定性和纯度。
3. 高通量流精密:高通量流精密设备可以将流体和分散体相分离,包括沉淀物和蛋白质。
它使用高压水流将杂质和悬浮物从蛋白质溶液
中清除,然后用不同的层析方法将蛋白质从其分散体中提取出来。
4. 柱单柱层析:柱单柱层析是另一种蛋白质提取技术,它使用多
种不同的树脂来分离蛋白质从其离子溶液中。
它将溶液通过固定式柱,并使用柱中所含的不同类型的树脂来把具有不同电荷性质的蛋白质从
溶液中提取出来。

TritonX-114去污剂法提取大肠杆菌膜蛋白摘要】目的:建立一种快速方便提取大肠杆菌膜蛋白的方法。
方法:收集临床分离的大肠杆菌,利用TritonX-114去污剂法提取大肠杆菌膜蛋白,Bradford法测定蛋白浓度,运用表面增强激光解析电离飞行时间质谱(SELDI-TOF-MS)进行质谱分析,采用CiphergenProteinchip软件采集数据。
重复测定20次大肠杆菌的混合标本,评价TritonX-114去污剂法提取大肠杆菌膜蛋白的重复性。
结果:TritonX-114去污剂法成功提取出了大肠杆菌膜蛋白。
重复测定20次大肠杆菌的混合标本,蛋白峰的分子量变异系数均小于0.05%。
结论:TritonX-114去污剂法可以快速方便的提取大肠杆菌膜蛋白,并具有很好的重复性,这不仅对大肠杆菌耐药机制和治疗方法的研究起着重要作用,也为膜蛋白的快速提取提供了新的思路。
【关键词】大肠杆菌;膜蛋白;TritonX-114;表面增强激光解析电离飞行时间质谱【中图分类号】R446 【文献标识码】A 【文章编号】2095-1752(2017)12-0059-03MEMBRANE PROTEINS OF ESCHERICHIA COLI WERE EXTRACTED BY USING TRITON- X-114 Wang Qin, Xu Jian, LIiu Chenggui.Clinical Laboratory of Chengdu Women and Children Center Hospital, Chengdu, Sichuan, 610091, China【Abstract】Objective To establish a rapid and convenient extracted method of membrane proteins from Escherichia coli. Methods The clinical isolates of E. coli were collected, membrane proteins of E. coli were extracted by using Triton X-114 detergent, and protein concentrations were detected by Bradford method. The membrane proteins of E. coli were analyzed by surface enhanced laser desorption /ionizationtime-of-flight mass spectrometry (SELDI-TOF- MS), and the data was collected by Ciphergen Proteinchip software. The mixed proteins of E. coli were measured for twenty times to evaluate the repeatability. Results The membrane proteins of E. coli were successfully extracted by using Triton X-114 detergent. The mixed samples of E. coli were measured for twenty times, and the results showed that the CV of protein in molecular weight was less than 0.05%. Conclusion The membrane protein of E. coli can be extracted quickly and easily by using Triton X-114 detergent. This method has good repeatability, which provides a new idea for the extraction of membrane protein, this study not only make an important role in the research of E. coli resistance mechanisms and treatment, but also is beneficial to the further study of membrane proteomics.【Key words】Escherichia coli; Membrane protein; Triton X-114; SELDI-TOF- MS 大肠杆菌(E.coli)是引起临床感染最常见的革兰阴性杆菌,该菌易产生超广谱B-内酰胺酶(ESBL),从而导致对第三代头孢菌素耐药,甚至引起严重的院内感染暴发[1]。

细胞膜蛋白的提取方法
生物侠们,还在实验室奋战吗?还在为科研经费不够发愁吗?今天我就给各位通宵达旦的大侠们带来一个福音。
下面就让我替他给你讲讲,抓紧时间啊!
首先你需要一株需要提前膜蛋白的细胞、NP40、氯化钠、Tris-Hcl、SDS、脱氧胆酸钠和PMSF,东西齐全了,就开始配裂解液吧。
下面是配方哦!
RIPA Buffer For100ml:
150mM NaCl5ml3M NaCl
50mM TrisHCl pH8.05ml1M TrisHCl pH8.0
1mM EDTA pH8.00.2ml0.5M EDTA pH8.0
1%NP-405ml20%NP-40
0.1%SDS1ml10%SDS
0.1%Deoxycholate100mg Deoxycholate
那东西都齐全了,那么来开始讲步骤吧!
1.收集细胞,将1000转离心收集的(最好低温哦)细胞悬于裂解液中20分钟;
2.就12000离心吧,收集沉淀哦;
3.在加入裂解液;
4.然后超声10-15次,每次2秒,间隔15秒;
5.再12000低温离心,收集上清,开始做实验咯!。

细菌总蛋白和膜蛋白提取方法一、从新鲜样品中提取总蛋白(简易法)1、自配裂解液(pH 8.5-9.0):50 mM Tris-HCl,2 mM EDTA, 100 mM NaCl,0.5% Triton X-100,调pH值至8.5-9.0备用;用前加入100 μg/ml 溶菌酶,1μl/ml 的蛋白酶抑制剂PMSF。
该裂解液用量为10-50ml 裂解液/1g湿菌体。
2、将40ml 菌液在12000g,4℃下离心15分钟收集菌体,沉淀用PBS悬浮洗涤2遍,沉淀加入1ml裂解液悬浮菌体。
3、超声粉碎,采用300w,10s超声/10s间隔,超声20min,反复冻融超声3次至菌液变清或者变色。
4、1000g离心去掉大碎片,上清可直接变性后PAGE电泳检测,或者用1% SDS溶液透析后冻存。
缺点:Western blotting结果表明,疏水性跨膜蛋白提取效率有限。
二、从Trizol裂解液中分离总蛋白1、Trizol溶解的样品研磨破碎后,加氯仿分层,2-8℃下10000g离心15min,上层水相用于RNA提取,体积约为总体积的60%。
2、用乙醇沉淀中间层和有机相中的DNA。
每使用1ml Trizol加入0.3ml无水乙醇混匀,室温放置3min,2-8℃不超过2000g离心5min。
3、将上清移至新的EP管中,用异丙醇沉淀蛋白质。
每使用1ml Trizol加入1.5ml异丙醇,室温放置10min,2-8℃下12000g离心10min,弃上清。
4、用含有0.3M 盐酸胍的95%乙醇洗涤。
每1ml Trizol加入2ml洗液,室温放置20min,2-8℃下7500g离心5min,弃上清,重复洗涤2次。
最后加入2ml无水乙醇,涡旋后室温放置20min,2-8℃下7500g离心5min,弃上清。
5、冷冻干燥5-10min,1%SDS溶液溶解,反复吹打,50℃温浴使其完全溶解,2-8℃下10000g 离心10min去除不溶物。

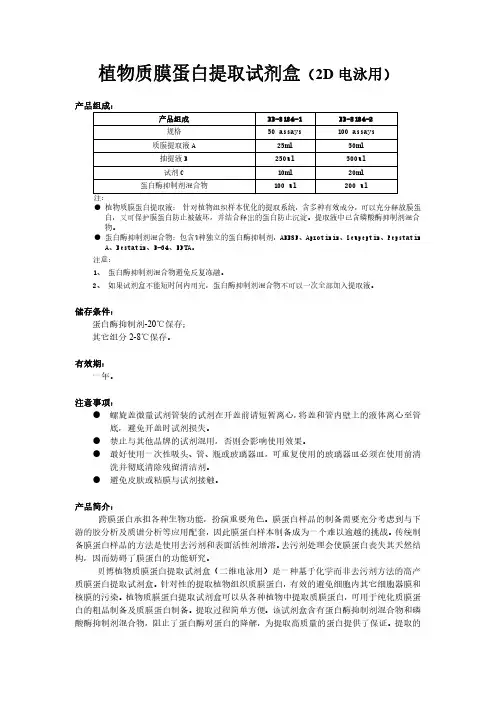
膜蛋白提取试剂盒Membrane Protein Extraction Kit产品编号:C500049 包装规格:50 Assays 产品简介本试剂盒提供独特的组份提取细胞及组织中的膜蛋白。
特殊的提取Buffer 在裂解细胞的同时,经过特殊处理,还可以选择性地分离提取细胞膜蛋白和胞器质膜蛋白。
提取方法简单,可靠,快速。
获得的膜蛋白纯度高,可用于SDS-PAGE 、Western Blot 、免疫共沉淀或细胞信号传导等后续研究,每次可以提取107个培养细胞或200 mg 动物组织,本试剂盒可以使用50次。
产品特点1. 整个操作过程只需要60 min 左右。
2. 即可以用于培养细胞(50x107个),有可以用于动物组织(50 x 200 mg )蛋白质的提取。
3. 避免蛋白酶对蛋白质的降解,保持膜蛋白质的完整性和天然活性。
4.提取的膜蛋白纯度高,不需要超速度离心,可以同时处理多个样品。
运输和保存条件在常温下运输,收到后,将蛋白酶抑制剂、Loading Buffer 、DTT 于在-20°C 的环境中保存,其余4°C 保存,保质期一年。
产品组成成分 C500049 洗涤液 10×50 mL 提取Buffer 50 mL 蛋白酶抑制剂 50 μL Loading Buffer 1 mLDTT50 μL操作步骤 1. 对于悬浮培养或用细胞刮子刮下的贴壁培养的细胞,离心收集不少于1×107细胞,再用预冷的双蒸水稀释的一倍浓度的洗涤液洗涤细胞三次,每次3000 rpm (800 g )离心5 min 。
2. 组织样本(200 mg )尽量去除脂肪组织和结缔组织等非目的组织,冰上剪碎,再用预冷的一倍浓度的洗涤液洗涤细胞三次。
3.在上述细胞或组织样本中加入1 mL 提取Buffer (使用前,每mL 提取Buffer 加入1 μL 蛋白酶抑制剂和1 μL DTT ),4°C 下玻璃匀浆器上下手动匀浆30~50次。
膜蛋白的提取与分离膜蛋白的分离一、简介:1细胞质膜资料1895年,Overton从研究细胞透性得出"细胞膜由连续的脂类物质组成"。
1925年Gorter&Grendel:用脂单分子膜技术测定细胞膜中脂分子的总面积,提出:"细胞膜是由双层脂分子组成"。
1935年Danielli&Davson:从测定膜的表面张力得出细胞膜的"三明治结构模型",即蛋白质-脂-蛋白质。
1959年Robertson:用电镜观察生物膜提出"单位膜模型",将膜的分子结构与超微机构统一起来厚度:2(暗)+3.5(亮)+2(暗)=7.5细胞质膜的主要功能概括如下:(1)为细胞的生命活动提供相对稳定的内环境;(2)选择性的物质运输,包括代谢底物的输入与代谢产物的排除,其中伴随着能量的传递;(3)提供细胞识别位点,并完成细胞内外信息跨膜传递;(4)为多种酶提供结合位点,使酶促反应高效而有序地进行;(5)介导细胞与细胞、细胞与基质之间的连接;质膜参与形成具有不同功能的细胞表面特化结构。
2膜蛋白虽动物细胞主要有9种膜脂,而膜蛋白的种类繁多,多数膜蛋白分子数目较少,但却赋予细胞膜非常重要的生物学功能。
根据膜蛋白分离的难易及其与脂分子的结合方式,膜蛋白可分为两大类型:外在膜蛋白、内在膜蛋白。
(1)外在膜蛋白为水溶性蛋白,靠离子键或其它较弱的键与膜表面的蛋白质分子或脂分子结合,因此只要改变溶液的离子强度甚至提高温度就可以从膜上分离下来,膜结构并不被破坏。
(2)内在膜蛋白与膜结合非常紧密,一般讲只有用去垢剂(detergent)使膜解后才可分离出来。
获得大量有生物学活性的质膜蛋白对我们显得非常的重要。
附注:使用分级抽提方法获得的“膜蛋白”中只有很少一部分是具备多跨膜区的整和膜蛋白,膜蛋白,到目前为止,仍然是蛋白组学的一个瓶颈,不管采用2-D技术也好,ICAT乃至proein microarray都还不能有效解决这一问题。
鉴定膜蛋白的实验方法及步骤
鉴定膜蛋白的实验方法有多种,包括免疫印迹(Western blotting)、免疫共沉淀(Co-immunoprecipitation)、流式细胞
术(Flow cytometry)、质谱分析(Mass spectrometry)等。
下面
我将从这些方法中选择两种来详细介绍。
免疫印迹(Western blotting)是一种常用的蛋白质检测方法,用于检测特定蛋白在混合蛋白物质中的存在。
其步骤包括,1. 蛋白
样品制备,将膜蛋白从细胞或组织中提取;2. 蛋白电泳,将蛋白样
品进行SDS-PAGE电泳分离;3. 膜转移,将分离的蛋白转移到膜上;
4. 免疫染色,用特异性抗体结合目标蛋白,再用二抗结合酶标记抗
体识别一抗结合的蛋白;5. 显色,通过底物显色来检测蛋白的存在。
另一种方法是免疫共沉淀(Co-immunoprecipitation),用于
检测蛋白与其他蛋白的相互作用。
其步骤包括,1. 细胞提取,将细
胞裂解得到蛋白混合物;2. 免疫沉淀,将特定抗体与蛋白混合物共
沉淀,形成抗体-蛋白复合物;3. 洗涤,用洗涤缓冲液洗涤复合物,去除非特异性结合的蛋白;4. 举例,将复合物从磁珠上洗脱,进行Western blotting或质谱分析。
这些方法能够有效地鉴定膜蛋白的存在和相互作用,但在实验
过程中需要严格控制实验条件,避免干扰因素对结果的影响。
同时,选择合适的阳性和阴性对照样品也是非常重要的。
总的来说,这些
方法在膜蛋白鉴定中发挥着重要作用,并且可以根据实验目的选择
合适的方法进行应用。