高中化学知识点总结氧化还原反应(精选课件)
- 格式:doc
- 大小:243.00 KB
- 文档页数:5

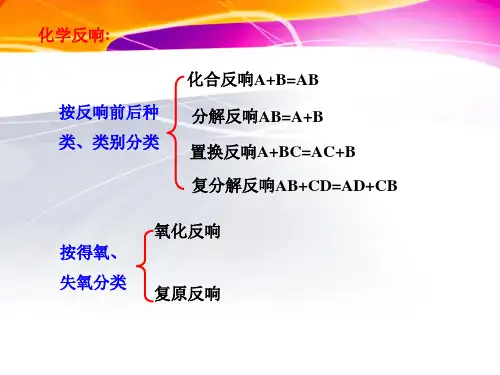
三、氧化還原反應1、準確理解氧化還原反應の概念1.1 氧化還原反應各概念之間の關係(1)反應類型:氧化反應:物質所含元素化合價升高の反應。
還原反應:物質所含元素化合價降低の反應。
氧化還原反應:有元素化合價升高和降低の反應。
(2)反應物:氧化劑:在反應中得到電子の物質還原劑:在反應中失去電子の物質(3)產物:氧化產物:失電子被氧化後得到の產物還原產物:得電子被還原後得到の產物(4)物質性質:氧化性:氧化劑所表現出得電子の性質還原性:還原劑所表現出失電子の性質(5)各個概念之間の關係如下圖例題1:下列變化過程屬於還原反應の是( D )→MgCl2→Na+→CO2 D. Fe3+→Fe例題2:下列化學反應不屬於氧化還原反應の是( C )A、3Cl2 + 6KOH =5KCl + KClO3 + 3H2OB、2NO2 + 2NaOH =NaNO3 +NaNO2 +H2OC、SnCl4 + 2H2O = SnO2 + 4HClD、3CCl4 + 2K2Cr2O7 = 2CrO2Cl2 + 3COCl2 +2KCl1.2 常見の氧化劑與還原劑(1)物質在反應中是作為氧化劑還是作為還原劑,主要取決於元素の化合價。
①元素處於最高價時,它の原子只能得到電子,因此該元素只能作氧化劑,如+7價のMn 和+6價のS②元素處於中間價態時,它の原子隨反應條件不同,既能得電子,又能失電子,因此該元素既能作氧化劑,又能作還原劑,如0價のS和+4價のS③元素處於最低價時,它の原子則只能失去電子,因此該元素只能作還原劑,如-2價のS(2)重要の氧化劑①活潑非金屬單質,如F2、Cl2、Br2、O2等。
②元素處於高價時の氧化物、高價含氧酸及高價含氧化酸鹽等,如MnO2,NO2;濃H2SO4,HNO3;KMnO4,KClO3,FeCl3等。
③過氧化物,如Na2O2,H2O2等。
(3)重要の還原劑①金屬單質,如Na,K,Zn,Fe等。
②某些非金屬單質,如H2,C,Si等。


在此输入标题内容从思政角度——认识氧化还原反应在此输入标题内容01.通过对化合价升降及得失电子的认识,由表及里地学习氧化还原反应的有关概念,培养宏观辨识与微观探析的能力02.从微观角度认识表示氧化还原反应的两种常见方法——双线桥法和单线桥法,培养电子守恒观念建立模型认知的核心素养素养目标小游戏:真假魔术师?在此输入标题内容碘伏与维C发生了什么神奇的反应?探秘环节在此输入标题内容探秘一:小魔术中化学反应是什么类型探秘二:碘水褪色碘单质发生了什么反应探秘三:小魔术中化学反应的实质是什么探秘四:用简笔画(线条)揭示谜底在此输入标题内容探秘一:小魔术中化学反应是什么类型?碘伏与维C反应方程式:C 6H 8O 6+I 2=C 6H 6O 6+2HI+1-2+1 +2+6–2 +2 –2+1 +1 +6-2 0 +2 0 +10 +2 0 +20 0 +2-2H 2 +CuO === Cu + H 2 O △Fe + CuSO 4 === Cu + FeSO 4O 2 +Cu === CuO 2NaOH + CuSO 4 === Cu(OH)2 + Na 2SO 4△置换反应 分解反应 化合反应 复分解反应任务1:标出各元素的化合价,并从中找出含铜元素的物质,画出铜元素的价类二维图。
体会前三个反应特征是什么。
氧化还原反应0 -1在此输入标题内容探秘一:小魔术中化学反应是什么类型问题线知识线素养线谜底一:氧化还原反应宏观辨识在此输入标题内容D 下列反应既属于氧化还原反应,又属于置换反应的是( )A.2Fe+3Cl2===2FeCl3B.Fe2O3+3CO===2Fe+3CO2C.CaO +CO2===CaCO3D.2Na+2H2O===2NaOH+H2↑在此输入标题内容探秘二:碘水褪色碘单质发生了什么反应?C 6H 8O 6+I 2=C 6H 6O 6+2HI 0-1-氧化反应:反应物所含某种(某些)元素化合价升高的反应还原反应:反应所含某种(某些)元素化合价降低的反应在此输入标题内容探秘一:小魔术中化学反应是什么类型问题线知识线素养线探秘二:碘水褪色碘单质发生什么反应谜底一:氧化还原反应宏观辨识谜底二:还原反应宏观辨识在此输入标题内容探秘二:碘水褪色碘单质发生了什么反应?-0 +2 0 +10 +2 0 +20 0 +2-2H2 +CuO === Cu + H2 O△Fe + CuSO4 === Cu + FeSO4 O2 +Cu === CuO△对立统一小试牛刀在此输入标题内容D在此输入标题内容探秘三:小魔术中化学反应的实质是什么?+17287+11281NaCl+1128Na ++17288Cl -失电子数=得电子数=电子转移数点燃-e -+e -Na +Cl -2Na+Cl 2 2NaCl钠原子和氯原子是怎样变化为Na + 、Cl - 并进而形成氯化钠?+1-1理论分析实践验证Fe与CuSO溶液组成的原电池4实践结论任务2:Fe+CuSO4=FeSO4+Cu①碳棒上有Cu析出,说明谁得了电子?②谁失了电子?Cu2+得电子生成Cu Fe失电子生成Fe2+电子转移指针偏转产生电流在此输入标题内容探秘一:小魔术中化学反应是什么类型问题线知识线素养线探秘二:碘水褪色碘单质发生了什么反应谜底一:氧化还原反应宏观辨识谜底二:还原反应宏观辨识探秘三:小魔术中化学反应的实质是什么谜底三:电子转移微观辨析在此输入标题内容探秘四:用简笔画(线条)揭示谜底?任务2:①碳棒上有Cu析出,说明谁得了电子?②谁失了电子?Cu2+得电子生成Cu Fe失电子生成Fe2+任务3:根据任务2写出铁与CuSO4溶液反应的离子方程式,打开脑洞,用简笔画(线条)表示出电子转移的方向、转移电子数在此输入标题内容Fe + Cu 2+ ==== Fe 2+ + Cu+20+20化合价升高,失2e -,氧化反应化合价降低,得2e -,还原反应Fe + Cu 2+ ==== Fe 2+ + Cu+20+202e -探秘四:用简笔画(线条)揭示谜底?双线桥法单线桥法注意事项①箭头、箭尾指向化合价变化的同种元素。





三、氧化还原反应1、准确理解氧化还原反应的概念1.1 氧化还原反应各概念之间的关系(1)反应类型:氧化反应:物质所含元素化合价升高的反应。
还原反应:物质所含元素化合价降低的反应。
氧化还原反应:有元素化合价升高和降低的反应。
(2)反应物:氧化剂:在反应中得到电子的物质还原剂:在反应中失去电子的物质(3)产物:氧化产物:失电子被氧化后得到的产物还原产物:得电子被还原后得到的产物(4)物质性质:氧化性:氧化剂所表现出得电子的性质还原性:还原剂所表现出失电子的性质(5)各个概念之间的关系如下图例题1:下列变化过程属于还原反应的是( D )A.HCl→MgCl2B.Na→Na+C.CO→CO2D. Fe3+→Fe例题2:下列化学反应不属于氧化还原反应的是( C )A、3Cl2 + 6KOH =5KCl + KClO3 + 3H2OB、2NO2 + 2NaOH =NaNO3 +NaNO2 +H2OC、SnCl4 + 2H2O = SnO2 + 4HClD、3CCl4 + 2K2Cr2O7 = 2CrO2Cl2 + 3COCl2 +2KCl1.2 常见的氧化剂与还原剂(1)物质在反应中是作为氧化剂还是作为还原剂,主要取决于元素的化合价。
①元素处于最高价时,它的原子只能得到电子,因此该元素只能作氧化剂,如+7价的Mn和+6价的S②元素处于中间价态时,它的原子随反应条件不同,既能得电子,又能失电子,因此该元素既能作氧化剂,又能作还原剂,如0价的S和+4价的S③元素处于最低价时,它的原子则只能失去电子,因此该元素只能作还原剂,如-2价的S(2)重要的氧化剂①活泼非金属单质,如F2、Cl2、Br2、O2等。
②元素处于高价时的氧化物、高价含氧酸及高价含氧化酸盐等,如MnO2,NO2;浓H2SO4,HNO3;KMnO4,KClO3,FeCl3等。
③过氧化物,如Na2O2,H2O2等。
(3)重要的还原剂①金属单质,如Na,K,Zn,Fe等。


高中化学知识点总结氧化还原反应
三、氧化还原反应
1、准确理解氧化还原反应的概念
1.1 氧化还原反应各概念之间的关系
(1)反应类型:
氧化反应:物质所含元素化合价升高的反应。
还原反应:物质所含元素化合价降低的反应。
氧化还原反应:有元素化合价升高和降低的反应.
(2)反应物:
氧化剂:在反应中得到电子(化合价降低)的物质—----表现氧化性
还原剂:在反应中失去电子(化合价升高)的物质---——表现还原性
(3)产物:
氧化产物:失电子被氧化后得到的产物-—---具有氧化性
还原产物:得电子被还原后得到的产物-—---具有还原性(4)物质性质:
氧化性:氧化剂所表现出得电子的性质
还原性:还原剂所表现出失电子的性质
注意:a.氧化剂还原剂可以是不同物质,也可以是同种物质
b氧化产物、还原产物可以是不同物质,也可以是同种物质
C。
物质的氧化性(或还原性)是指物质得到(或失去)电子的能力,与物质得失电子数目的多少无关
(5)各个概念之间的关系如下图
1。
2 常见的氧化剂与还原剂
(1)物质在反应中是作为氧化剂还是作为还原剂,主要取决于元素的化合价。
①元素处于最高价时,它的原子只能得到电子,因此该元素只能作氧化剂,如+7价的Mn和+6价的S
②元素处于中间价态时,它的原子随反应条件不同,既能得电子,又能失电子,因此该元素既能作氧化剂,又能作还原剂,如0价的S和+4价的S...文档交流仅供参考...
③元素处于最低价时,它的原子则只能失去电子,因此该元素只能作还原剂,如-2价的S
(2)重要的氧化剂
①活泼非金属单质,如F2、Cl2、Br2、O2等。
②元素处于高价时的氧化物、高价含氧酸及高价含氧化酸盐等,如MnO2,NO2;浓H2SO4,HNO3;KMnO4,KClO3,FeCl3等。
...文档交流仅供参考...
③过氧化物,如Na2O2,H2O2等。
(3)重要的还原剂
①金属单质,如Na,K,Zn,Fe等.
②某些非金属单质,如H2,C,Si等。
③元素处于低化合价时的氧化物,如CO,SO2等。
④元素处于低化合价时的酸,如HCl(浓),HBr,HI,H2S等。
⑤元素处于低化合价时的盐,如Na2SO3,FeSO4等。
1.3 电子转移的表示方法
电子转移的表示方法有双线桥法和单线桥法
(1)双线桥法
要点:a.箭头由反应物中化合价变化元素指向生成物中化合价已经变化了的同一元素。
(升高、降低各一根箭头,越过方程式中间的等号)...
文档交流仅供参考...
b.电子转移数目:化合价升高、失电子;化合价降低、得电子。
化
合价改变元素的原子个数m ×每个原子得到(或失去)电子的个数
ne-, 即m ×ne-...文档交流仅供参考...
如:
(2)单线桥法
要点:a。
线桥从反应物中化合价升高的元素出发,指向反应物中化合价降低的元素,箭头对准氧化剂中化合价降低的元素,箭头不过“=”
b.在线桥上标明转移电子总数,不写得到或失去....文档交流仅供参考... 如:
2、氧化还原反应的基本规律
2。
1 氧化还原反应的反应规律
2。
1.1 价态规律
同种元素,处于最高价态时只具有氧化性。
处于最低价态时只具有还原性。
处于中间价态时既有氧化性又有还原性。
...文档交流仅供参考...
2。
1.2歧化和归中规律
价态归中规律:同种元素不同价态之间发生氧化还原反应时,价态的变化“只靠拢,可相交,不相叉"。
2.1.3 反应先后规律
在浓度相差不大的溶液中:
(1)同时含有集中还原剂时,加入氧化剂后,还原性强的优先被氧化。
(2)同时含有集中氧化剂时,加入还原剂后,氧化性强的优先被还原。
2。
1.4 守恒规律
在任何氧化还原反应中:化合价升高总数 = 化合价降低总数,还原剂失电子总数=氧化剂得电子总数。
并且反应前后电荷数相等。
...文档交流仅供参考...
2.2 氧化性与还原性的强弱判断规律(自己总结)
(1)根据氧化还原反应方程式的判断
氧化性:氧化剂〉氧化产物
还原性:还原剂>还原产物
可总结为:比什么性,找什么剂,产物之性弱于剂.
(2)根据金属活动性顺序判断
K Ca NaMg Al Zn Fe SnPb (H)Cu Hg Ag Pt Au 从左向右还原性逐渐减弱,对应离子的氧化性逐渐增强
(3)根据非金属活动性顺序判断:
F2 Cl2Br2 I2 S
从左向右氧化性逐渐减弱,对应离子的还原性逐渐增强
(3)根据反应条件和反应的剧烈程度
反应条件要求越低,反应越剧烈,对应物质的氧化性或还原性越强。
(4)根据氧化性还原反应的程度
相同条件下:a.不同氧化剂作用于同一种还原剂,氧化产物价态高的氧化性强.
b.不同还原剂作用于同一种氧化剂,还原产物价态低的还原性强。