高一化学金属的化学性质1-P
- 格式:pdf
- 大小:457.91 KB
- 文档页数:10



高一化学金属的化学性质金属是化学中一类重要的物质,具有独特的化学性质。
本文将介绍高一化学中金属的常见化学性质,包括金属的导电性、导热性、金属与酸的反应、金属与氧的反应以及金属与水的反应。
一、导电性金属具有优良的导电性。
这是因为金属中的电子可以自由地在金属中移动,形成电流。
金属中存在着大量的自由电子,它们在金属晶体中自由运动,所以金属能够良好地导电。
导电性的强弱与金属的物理结构和晶体缺陷有关。
二、导热性金属具有良好的导热性。
金属中的自由电子可以通过碰撞传递能量,从而实现热量的传导。
金属中的自由电子的运动是导致金属热导率高的原因之一。
三、金属与酸的反应金属能够与酸发生反应,通常产生盐和氢气。
金属与酸反应的一般化学方程式为:金属 + 酸→ 盐 + 氢气。
其中,金属被氧化失去电子,而酸则被还原。
例如,锌与盐酸反应产生氯化锌和氢气的化学方程式为:Zn + 2HCl → ZnCl2 + H2。
四、金属与氧的反应金属能够与氧气发生反应,产生金属氧化物。
金属与氧气的反应是金属氧化的过程。
金属氧化的化学方程式为:金属 + 氧气→ 金属氧化物。
例如,铁与氧气反应产生的化学方程式为:4Fe + 3O2 → 2Fe2O3。
五、金属与水的反应金属与水反应的结果通常是生成金属氢氧化物和氢气。
金属与水反应的一般化学方程式为:金属 + 水→ 金属氢氧化物 + 氢气。
例如,钠与水反应产生氢气和氢氧化钠的化学方程式为:2Na + 2H2O → 2NaOH + H2。
结论金属具有独特的化学性质,如导电性、导热性以及与酸、氧、水的反应。
金属的导电性和导热性使其在电器、导线等领域有着广泛的应用。
金属与酸、氧、水的反应是金属化学反应的基础,这些反应不仅有实际应用价值,也对我们了解金属的性质具有重要意义。
通过本文的介绍,我们对高一化学金属的化学性质有了更深入的了解。
金属的导电性、导热性以及与酸、氧、水的反应等性质是金属在实际应用中发挥重要作用的基础。


高一金属的化学性质知识点在高一化学教材中,金属的化学性质是一个重要的学习内容。
金属是一类物质,具有特定的性质和行为。
下面将介绍金属的几个重要的化学性质。
1. 金属的活泼性金属的活泼性是指金属与酸、水、氧等物质发生化学反应的能力。
活泼性较高的金属具有较强的化学反应能力,而活泼性较低的金属则反应相对较弱。
例如,铁是活泼性较高的金属,当铁与盐酸反应时,会生成氯化铁和氢气的反应:Fe + 2HCl → FeCl2 + H2↑而铝是活泼性较低的金属,和盐酸反应时,产生的反应较弱:2Al + 6HCl → 2AlCl3 + 3H2↑2. 金属的氧化性金属的氧化性是指金属与氧气反应的能力。
大部分金属可以与氧气反应生成相应的金属氧化物。
例如,铜与氧气反应生成铜氧化物:2Cu + O2 → 2CuO铁与氧气反应生成铁氧化物:4Fe + 3O2 → 2Fe2O33. 金属的还原性金属的还原性是指金属在化学反应中,能够失去电子从而被氧化物还原为金属的能力。
例如,当铜氧化物与氢气反应时,氧化物中的氧被还原为纯铜:CuO + H2 → Cu + H2O铁氧化物与一些金属还原剂反应时,也可以发生类似的还原反应。
4. 金属的腐蚀性金属的腐蚀性是指金属在与环境中的氧、水等物质接触时,发生的自然氧化反应。
金属的腐蚀会导致金属表面产生氧化层,并且会逐渐损耗金属的质量和性能。
例如,银在空气中容易被硫化物腐蚀,产生黑色的硫化银:2Ag + S → Ag2S铁的腐蚀叫做生锈,当铁表面与氧气和水接触时,会生成氧化铁:4Fe + 3O2 + 6H2O → 4Fe(OH)35. 金属的导电性和热导性金属具有良好的导电性和热导性,这是由于金属中大量自由电子的存在。
自由电子可以在金属中自由移动,形成电流和热传导。
因此,金属是良好的导电体和热导体。
这些是高一化学中金属的几个重要的化学性质。
通过了解金属的化学性质,我们可以更好地理解金属的行为和应用。
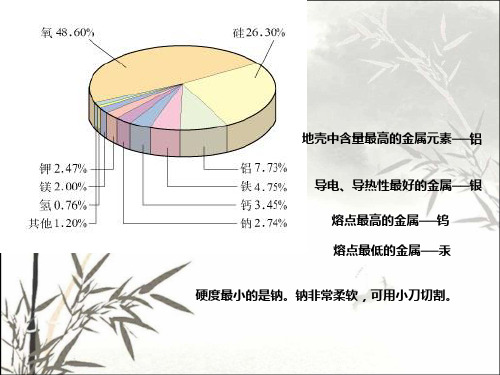


高一化学必修一第三章知识点总结归纳高一化学必修一(一)金属的化学性质一金属的通性1.金属的存在(1)金属元素的存在绝大多数金属以化合态的形式存在于自然界中,如Al、Fe等,极少数化学性质不活泼的金属以游离态的形式存在于自然界中,如Au。
在地壳中的含量较多的为O、Si、Al、Fe、Ca。
2.金属单质的物理通性①状态:常温下,大部分为固体,唯一呈液态的是汞。
②色泽:除Cu、Au外,大多数金属为银白色,有金属光泽。
③三性:良好的导电性、导热性、延展性。
3.单质的化学性质(1)与非金属的反应常温下,镁在空气中跟氧气反应,生成一层致密的氧化物薄膜,能够阻止内部金属继续被氧化。
镁在空气中燃烧,产生耀眼的白光,生成白色固体,反应的化学方程式为:2Mg+O2点燃=====2MgO。
镁还可以和氮气点燃,反应方程式为:3Mg+N2点燃=====Mg3N2。
(2)与酸的反应Fe与稀H2SO4反应的离子方程式:Fe+2H+===Fe2++H2↑。
(3)与盐溶液的反应Cu与AgNO3溶液反应的离子方程式:Cu+2Ag+===Cu2++2Ag。
归纳金属的通性(1)金属化学性质特点(2)金属还原性的强弱取决于其失去电子的难易程度,而不是失去电子个数的多少。
【活学活用】1.判断下列说法是否正确,正确的划“√”,错误的划“×”(1)金属具有良好的导热、导电性()(2)金属单质在氧化还原反应中总是作还原剂()(3)钠原子在氧化还原反应中失去1个电子,而铝原子失去3个电子,所以铝比钠活泼()(4)金属在加热条件下均易与O2反应()答案(1)√(2)√(3)×(4)×解析(3)错误,金属的活泼性与原子失去电子个数无关,与失电子能力有关,钠比铝易失电子,钠比铝活泼;(4)错误,Au、Pt等金属不与O2反应。
二钠与氧气的反应按表中要求完成实验,并将观察到的实验现象及其原因解释填入表中。
[归纳总结]钠与氧气的反应(1)钠的性质及其保存钠是一种硬度小、熔点低的银白色的金属,具有金属光泽。

高中化学必修1金属的化学性质在我们的日常生活中,金属无处不在,从厨房的锅碗瓢盆到交通工具的零部件,从建筑结构到电子设备,金属材料的应用广泛而多样。
而要深入理解这些金属材料的用途和性质,就需要我们掌握金属的化学性质。
金属的化学性质首先体现在它们与氧气的反应上。
大多数金属在常温下就能与氧气发生缓慢的氧化反应,比如铁在潮湿的空气中会生锈,表面生成红褐色的铁锈(主要成分是氧化铁)。
而有些金属则比较活泼,在点燃或加热的条件下能与氧气剧烈反应,例如镁条在空气中燃烧,发出耀眼的白光,生成白色的氧化镁。
金属与酸的反应也是其重要的化学性质之一。
位于氢前面的金属能够置换出酸中的氢,生成相应的盐和氢气。
比如锌和稀硫酸反应,会产生硫酸锌和氢气,我们可以观察到有气泡产生。
但位于氢后面的金属则不能与酸发生这样的反应。
金属还能与某些盐溶液发生置换反应。
例如,铁能把硫酸铜溶液中的铜置换出来,生成硫酸亚铁和铜,我们会看到溶液颜色由蓝色逐渐变为浅绿色,同时有红色的固体析出。
这一性质在工业上有着广泛的应用,比如湿法炼铜。
钠是一种非常活泼的金属。
它在常温下就能与水剧烈反应,生成氢氧化钠和氢气。
这个反应十分剧烈,钠会在水面上迅速游动,发出“嘶嘶”的响声,并且溶液会变成碱性。
铝是我们生活中常见的金属之一,它具有良好的抗腐蚀性。
这并不是因为铝不活泼,而是因为铝在空气中与氧气反应,会在表面生成一层致密的氧化铝薄膜,这层薄膜能够阻止内部的铝继续被氧化。
不同的金属化学性质的活泼程度不同,我们可以通过金属活动性顺序来判断。
常见金属的活动性顺序为:钾、钙、钠、镁、铝、锌、铁、锡、铅、(氢)、铜、汞、银、铂、金。
在这个顺序中,排在前面的金属比排在后面的金属更活泼。
金属的化学性质在实际生活和工业生产中有着重要的应用。
比如,利用铁与硫酸铜溶液的反应进行湿法炼铜;利用金属与酸的反应制取氢气;利用铝的抗腐蚀性来制作门窗等。
在实验室中,我们通过实验来探究金属的化学性质。


