细胞生物学笔记-第三章细胞生物学研究方法
- 格式:doc
- 大小:57.00 KB
- 文档页数:10




细胞生物学研究方法细胞生物学是研究细胞结构、功能和过程的科学学科,主要研究对象是细胞的组成、分裂、分化、代谢、运动、增殖和死亡等。
为了深入研究细胞相关问题,细胞生物学采用了多种研究方法。
第一,显微镜观察法。
显微镜是细胞生物学中最常用的工具之一。
通过显微镜观察,可以观察到细胞的形态、结构和各种细胞器的分布情况。
常用的显微镜有光学显微镜和电子显微镜。
光学显微镜适用于观察活细胞,电子显微镜适用于观察细胞内部细节,如细胞核、线粒体和内质网等。
第二,细胞培养法。
细胞培养是指将细胞在无菌条件下培养于含有营养物质的培养基中,使其持续生长和繁殖。
通过细胞培养,可以研究细胞的生长特性、分裂过程以及对外界刺激的反应。
常用的细胞培养方法有原代培养、细胞株培养和三维培养等。
第三,细胞分离和纯化法。
细胞分离和纯化是将不同类型的细胞从混合细胞群中分离出来,以便对某种细胞进行独立的研究。
常用的方法有细胞悬浮液经过离心分离、细胞表面标记技术以及细胞排序等。
第四,分子生物学技术。
分子生物学技术可以用于研究细胞的基因表达、代谢等分子机制。
其中,PCR技术可以复制DNA序列,用于检测细胞内特定基因的存在和表达水平。
原位杂交技术可以检测细胞内特定mRNA的定位和表达情况。
第五,蛋白质分析技术。
蛋白质分析技术主要用于研究细胞内蛋白质的分布、结构和功能。
常用的方法有蛋白质电泳、质谱分析、免疫印迹等。
第六,遗传学方法。
遗传学方法可以用于研究细胞的遗传特征和突变。
如基因敲除和基因敲入技术可以研究基因在细胞中的作用;细胞杂交技术可以研究细胞核酸的互补性和杂交情况。
细胞生物学研究方法的不断更新和发展,使我们对细胞的理解越来越深入。
这些方法的应用使得我们能够更好地揭示细胞的机制和功能,为解决许多重大疾病和生物学问题提供了有力的工具。

第三章细胞生物学研究方法一. 名词解释:1.细胞株从原代培养物中接种出来的一群不均一的细胞群(染色体数目不变,不能无限长期传代、繁衍)。
2.细胞系细胞系一般都是转化细胞,可以无限传代长期繁衍下去,每种细胞系都具有特殊的遗传标志特征,3.接触抑制当贴壁生成单层细胞且细胞达到一定密度相互接触时,造成细胞表面许多反应受到遮蔽,从而细胞的生长和繁殖受到抑制。
4.电融合技术将悬浮细胞在低压交流电场中聚集成串珠状细胞群或相互接触的单层培养细胞,加高压电泳冲促使融合的技术。
5.密度梯度离心离心操作如果在一种连续密度梯度介质中进行,6.差速离心装有不均一粒子的离心管在离心机中高速旋转时,大小、密度不同的粒子将以各自的沉降速率移向离心管底部7.细胞克隆由单个细胞培养繁殖而成的一群遗传性状完全相同的细胞群体。
二. 简答题:1.透射电镜、扫描电镜、扫描隧道显微镜的原理2.细胞及细胞器分离提纯方法细胞:采用流式细胞术;细胞器:超速离心术,差速离心术,密度梯度离心术,蔗糖密度梯度离心术,氧化铯密度梯度离心。
3.动物细胞培养方法液体悬浮培养,平板培养,回转玻璃管培养。
4.单克隆抗体技术及优点单克隆抗体技术是细胞杂交技术的成功应用,正常的淋巴细胞具有分泌抗体的能力,但不能在体外长期培养,瘤细胞可以在体外长期培养,但不能分泌抗体,将两细胞融合成杂交瘤细胞这样既能合成抗体,又能在体外无限繁殖,优点:永久性产生,特异性强,5.如何利用细胞杂交技术由不纯的抗原制备纯的抗体6.免疫荧光技术及应用7.相差显微镜的原理其基本原理是吧透过标本的可见光的光程差变成振幅差,从而提高了各种结构中的对比度,使各种构造变得清晰可见。
第四章细胞质膜与细胞表面● 1. 成斑现象. 2. 成帽现象.● 3. 连接子. 4. 化学突触. 4.“多莉”克隆羊的问世对细胞生物学研究有何意义?1、首次证明了哺乳动物成体细胞的细胞核仍保持有细胞全能性;2、首次证明了哺乳动物特化细胞的发育潜能是有可能在人为条件下发生逆转的,;3、证明了动物克隆并不是100%的复制。


细胞生物学教案. 第一章绪论第一节细胞生物学研究内容与现状一、细胞生物学是现代生命科学的重要基础学科1.细胞学(Cytology):是研究细胞的结构、功能和生活史的科学2.细胞生物学(Cell Biology):运用近代物理学和化学的技术成就以及分子生物学的概念与方法,从显微水平、亚显微水平和分子水平三个层次上,研究细胞的结构、功能及各种生命活动规律。
二、细胞生物学的主要研究内容1. 细胞核、染色体及基因表达基因表达与调控是目前细胞生物学、遗传学和发育生物学在细胞和分子水平相结合的最活跃领域。
2.生物膜与细胞器的研究膜及细胞器的结构与功能问题(“膜学”)。
3. 细胞骨架体系的研究胞质骨架、核骨架的装配调节问题和对细胞行使多种功能的重要.性。
4. 细胞增殖及调控控制生物生长和发育的机理是研究癌变发生和逆转的重要途径(“再教育细胞”)。
5. 细胞分化及调控一个受精卵如何发育为完整个体的问题。
(细胞全能性)6 .细胞衰老、凋亡及寿命问题。
7. 细胞的起源与进化。
8. 细胞工程改造利用细胞的技术。
生物技术是信息社会的四大技术之一,而细胞工程又是生物技术的一大领域。
目前已利用该技术取得了重大成就(培育新品种,单克隆抗体等),所谓21世纪是生物学时代,将主要体现在细胞工程方面。
三、当前细胞生物学研究的总趋势与重点领域1. 染色体DNA与蛋白质相互作用关系;2. 细胞增殖、分化、凋亡的相互关系及其调控;3 .细胞信号转导的研究;4 .细胞结构体系的装配。
第二节细胞生物学发展简史一细胞生物学研究简史1.细胞学创立时期 19世纪以及更前的时期(1665—1875),是以形态描述为主的生物科学时期;2. 细胞学经典时期 20世纪前半世纪(1875—1900),主要是实验细胞学时期;3. 实验细胞学时期(1900—1953);4. 分子细胞学时期(1953至今)。
总过程概括为:细胞发现→细胞学说建立→细胞学形成→细胞生物学的发展(1665)(1838—1839)(1892)(1965)R.Hooke Schleiden、Schwann Hertiwig DeRobertis二、细胞的发现(discovery of cell)以及细胞学说的建立及其意义(The cell theory)1.1838年,德国植物学家施莱登(J.Schleiden)关于植物细胞的工作,发表了《植物发生论》一文(Beitrage zur Phytogenesis).2.1839年,德国动物学家施旺(T.Shwann)关于动物细胞的工作,发表了《关于动植物的结构和生长一致性的显微研究》一文,论证了所有动物体也是由细胞组成的,并作为一种系统地科学理论提出了细胞学说。

第三章细胞生物学研究方法一.名词解释1.福尔根反应:特异显示DNA分布的反应。
酸水解可除去RNA,仅保留DNA,冰出去DNA 上嘌呤脱氧核糖核苷键上的嘌呤,使脱氧核糖的醛基暴露。
所暴露的自由醛基与西夫试剂反应呈紫红色。
2.负染色:用重金属盐(如磷钨酸钠、醋酸铀等)对铺展在载网上的样品进行染色,使整个载网都铺上一层重金属盐,而有凸出颗粒的地方则没有染料沉积。
染色后,在电镜下观察时,被观察的对象为亮的,背景为暗的,反衬出样品中的生物大分子及其复合物的形态。
3.原位杂交:用标记的核酸探针通过分子杂交确定特意核苷酸序列在染色体上火细胞中的位置的方法。
4.原代培养:直接从动物体内获取细胞进行首次培养,称原代培养。
5.传代培养:原代培养的细胞在一个容器中增殖到一定的密度后,将细胞分散到多个容器中继续培养的方式称传代培养。
6.细胞株:从原代培养细胞群中筛选出的具有特定性质或标志的细胞群,一般可顺利地传40-50代次,它保持染色体二倍体的数量及接触抑制行为。
7.细胞系:从肿瘤组织培养建立的细胞群或培养过程中发生突变或转化的细胞,使其获得“不死性”特征,从而无限增殖,从正常组织或胚胎组织也可以建立细胞系,这是一个含有多个细胞谱系的混杂细胞群体。
8.探针:带有放射性同位素、生物素或其他活性物质标记的某种特定的DNA或RNA片段,用于核酸分子杂交技术以检出标本中待测核酸分子。
9.超薄切片:是一种主要的透射电子显微镜制样技术,利用超薄切片机将样品切成40-50nm 左右,穿透很弱的电子束才能透过。
其主要步骤为:固定、脱水、包埋、切片、染色。
二.填空1、细胞生物学常用的光镜有相差显微镜、微分干涉显微镜、和荧光显微镜。
2、利用超速离心机对细胞组分进行分级分离的常用方法有差速离心和密度梯度离心。
3、单克隆抗体技术是将B淋巴细胞与无限繁殖的肿瘤细胞杂交的技术。
4、对电镜观察的生物样品有_要求样品很薄和保持样品的精细结构5、贴壁生长的细胞具有三个特点:单侧生长、形态多变、接触抑制。

第三章细胞生物学研究方法一、是非判断1.提高显微镜的分辨率,可通过缩短波长,或给标本染色。
2.光学显微镜和电子显微镜的差别在于后者的放大倍数远远大于前者,所以能看到更小的细胞结构。
3.亚显微结构就是超微结构。
4.电子显微镜的镜筒中是真空的,其目镜与光学显微镜的目镜也有很大区别。
5.在电子显微镜下观察细胞核时用碱性品红染色,染色质被染成红色。
6.为了使光学显微镜或电子显微镜标本的反差增大,可用化学染料对标本进行染色。
7.生物样品的电子显微镜分辨率通常是超薄切片厚度的十分之一,因而切得越薄,照片中的反差越强,分辨率也越高。
8.透射或扫描电子显微镜不能用于观察活细胞,而相差或倒置显微镜可以用于观察活细胞。
9.CsCl密度梯度离心法分离纯化样品时,样品要和CsCl混匀后分装,离心时,样品中不同组分的重力不同,停留在不同区带中。
10.用免疫荧光技术可显示与酶解过程有关的酶是否结合在微管上。
11.用带有标记的特定核酸分子作探针,测定与之互补的染色体DNA区段的位置,称为原位杂交。
12.Western blotting是体外分析RNA的技术。
13.进行流式细胞术时,所用的细胞需染色,而且还需对组织块中的细胞进行分散处理。
二、选择1.要观察肝组织中的细胞类型及排列,应先制备该组织的( )。
A.滴片B.切片 C.涂片 D.印片2.小鼠骨髓细胞染色体标本一般制备成细胞的( )。
A.滴片B.切片 C.涂片 D.印片3.观察血细胞的种类和形态一般制备成血液( )。
A.滴片D.切片 C.涂片 D.印片4.提高一般光学显微镜的分辨能力,常用的方法有( )。
A.利用高折射率的介质(如甘油) B.调节聚光镜,加红色滤光片C.用荧光抗体示踪D.将标本染色5.下列( )与显微镜能达到的分辨率无关。
A.光波波长B.物镜的放大倍数C.标本和透镜之间的物质的折射率D.透镜的数值孔径6.适于观察培养瓶中活细胞的显微镜是( )。
A.扫描电镜B.荧光显微镜C.相差显微镜D.倒置显微镜7.用于观察活细胞的显微镜是( )。
第三章细胞生物学研究方法
如何学习细胞生物学?
•抽象思维与动态观点
•结构与功能统一的观点
•同一性(unity)和多样性(diversity)的问题
•细胞生物学的主要内容:
结构与功能(动态特征);
细胞的生命活动;
•实验科学与实验技术——细胞真知源于实验室
——What we know//How we know.
第三章细胞生物学研究方法 细胞形态结构的观察方法
细胞组分的分析方法
细胞培养、细胞工程与显微操作技术
第一节细胞形态结构的观察方法 光学显微镜技术(light microscopy)
电子显微镜技术(Electro microscopy)
扫描探针显微镜(Scanning Probe Microscope)
扫描遂道显微镜(scanning tunneling microscope )
第二节细胞组分的分析方法
离心分离技术
细胞内核酸、蛋白质、酶、糖与脂类等的显示方法
特异蛋白抗原的定位与定性
细胞内特异核酸的定位与定性
放射自显影技术
定量细胞化学分析技术
第三节细胞培养、细胞工程与显微操作技术
细胞的培养
细胞工程
一、光学显微镜技术(light microscopy)
普通复式光学显微镜技术
荧光显微镜技术(Fluorescence Microscopy)
激光共焦扫描显微镜技术(Laser Confocal Microscopy)
相差显微镜(phase-contrast microscope)
微分干涉显微镜
(differential interference contrast microscope, DIC)
录像增差显微镜技术(video-enhance microscopy)
二、电子显微镜技术
电子显微镜的基本知识
电镜与光镜的比较
电镜与光镜光路图比较
电子显微镜的基本构造
主要电镜制样技术
负染色技术
冰冻蚀刻技术
超薄切片技术
电镜三维重构技术
扫描电镜(Scanning electron microscope,SEM)
SPM(Scanning probe microscope)
三、扫描遂道显微镜
Scanning Probe Microscope,SPM
(80年代发展起来的检测样品微观结构的仪器)
包括:STM、AFM、磁力显微镜、摩擦力显微镜等
原理:扫描探针与样品接触或达到很近距离时,即产生彼此间相互作用力,如
量子力学中的隧道效应(隧道电流)、原子间作用力、磁力、摩擦力等,
并在计算机显示出来,从而反映出样品表面形貌信息、电
特性或磁特性等。
装置:扫描的压电陶瓷,逼近装置,电子学反馈控制系统和数据采集、处理、显示系统。
特点:(1)可对晶体或非晶体成像,无需复杂计算,且分辨本领高。
(侧分辨率为0.1~0.2nm,纵分辨率可达0.01nm);
(2)可实时得到样品表面三维图象,可测量厚度信息;
(3)可在真空、大气、液体等多种条件下工作;非破坏性测量。
(4)可连续成像,进行动态观察
用途:纳米生物学研究领域中的重要工具,在原子水平上揭示样本表面的结构。
普通复式光学显微镜技术
光镜样本制作
分辨率是指区分开两个质点间的最小距离
荧光显微镜技术(Fluorescence Microscopy)
原理与应用
直接荧光标记技术
间接免疫荧光标记技术
在光镜水平用于特异蛋白质
等生物大分子的定性定位:
如绿色荧光蛋白(GFP)的应用
激光共焦扫描显微镜技术
(Laser Scanning Confocal Microscopy)
原理
应用:
排除焦平面以外光的干扰,增强
图像反差和提高分辨率(1.4—1.7),
可重构样品的三维结构。
相差显微镜(phase-contrast microscope)
将光程差或相位差转换成振幅差,可用于观察活细胞
微分干涉显微镜(differential-interference microscope)偏振光经合成后,使样品中厚度上的微小区别转化成
明暗区别,增加了样品反差且具有立体感。
适于研究
活细胞中较大的细胞器
录像增差显微镜技术(video-enhance microscopy)
计算机辅助的DIC显微镜可在高分辨率下研究活
细胞中的颗粒及细胞器的运动
电镜与光镜的比较
主要电镜制样技术
超薄切片技术用于电镜观察的样本制备示意图
负染色技术(Negative staining)与金属投影
染色背景,衬托出样品的精细结构
冰冻蚀刻技术(Freeze etching)(技术示意图)
冰冻断裂与蚀刻复型:主要用来观察膜断裂面的蛋白质颗粒和膜表面结构。
快速冷冻深度蚀刻技术(quick freeze deep etching) 电镜三维重构技术
电子显微术、电子衍射与计算机图象处理相结合而形成的
具有重要应用前景的一门新技术。
电镜三维重构技术与X-射线晶体衍射技术及核磁共振
分析技术相结合,是当前结构生物学(Structural Biology)
——主要研究生物大分子空间结构及其相互关系的主要实验手段。
扫描电镜
原理与应用:
电子“探针”扫描,激发样品表面放出二次电子,探测器收集二次电子成象。
CO 2临界点干燥法防止引起样品变形的表面张
力问题
一、离心分离技术
用途:于分离细胞器与生物大分子及其复合物 差速离心:分离密度不同的细胞组分
密度梯度离心:精细组分或生物大分子的分离
二、细胞内核酸、蛋白质、
酶、糖与脂类等的显示方法
原理:利用一些显色剂与所检测物质中一些
特殊基团特异性结合的特征,通过显
色剂在细胞中的定位及颜色的深浅来
判断某种物质在细胞中的分布和含量。
Feulgen Staining
三、特异蛋白抗原的定位与定性
免疫酶标技术
免疫胶体金 免疫荧光技术:
快速、灵敏、有特异性,但其分辨率有限(图) 蛋白电泳(SDS-PAGE)
与免疫印迹反应(Western-Blot)
免疫电镜技术:
免疫铁蛋白技术
技术
应用:通过对分泌蛋白的定位,可以确定某种蛋白的分泌动
态;胞内酶的研究;膜蛋白的定位与骨架蛋白的定位等
四、细胞内特异核酸的定位与定性
光镜水平的原位杂交技术
(同位素标记或荧光素标记的探针)
电镜水平的原位杂交技术
(生物素标记的探针与抗生物素抗体相连的胶体金标记结合)
PCR技术
五、放射自显影技术
原理及应用:
利用同位素的放射自显影,对细胞内生物大分子进行
定性、定位与半定量研究;
实现对细胞内生物大分子进行动态和追踪研究。
步骤:
前体物掺入细胞(标记:持续标记和脉冲标记)
———放射自显影
六.定量细胞化学分析技术
细胞显微分光光度术(Microspectrophotometry) 利用细胞内某些物质对特异光谱的吸收,测定这些物质(如核酸与蛋白质等)在细胞内的含量。
包括:
紫外光显微分光光度测定法
可见光显微分光光度测定法
流式细胞仪(Flow Cytometry)
主要应用:
用于定量测定细胞中的DNA、RNA或某一特异蛋白的含量;
测定细胞群体中不同时相细胞的数量;
从细胞群体中分离某些特异染色的细胞;
分离DNA含量不同的中期染色体。
一、细胞的培养
动物细胞培养
类型:原代培养细胞(primary culture cell)
继代培养细胞(sub-culture cell)
细胞株(cell strain)正常二倍体,接触抑制
细胞系(cell line)亚二倍体,接触抑制丧失 植物细胞
类型:原生质体培养(体细胞培养)
单倍体细胞培养(花药培养)
非细胞体系(cell-free system)
二、细胞工程
细胞融合(cell fusion)与细胞杂交(cell hybridization)技术 单克隆抗体(monoclone antibody)技术图
细胞拆合与显微操作技术
物理法结合显微操作技术(图1、图2)
化学法结合离心技术
制备核体(karyoplast)和胞质体(cytoplast)。
其它技术
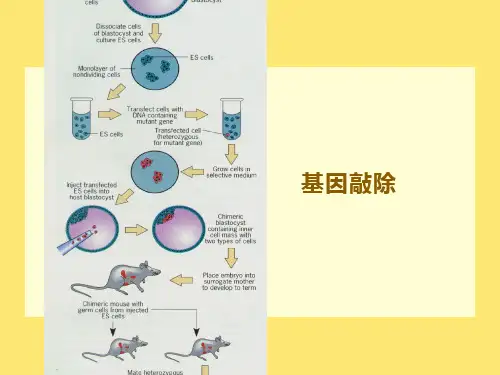
遗传分析(mutant, knock out, knock in)
对细胞生命活动的研究成为当今生命科学发展的瓶颈
对细胞生命活动的研究成为当今生命科学发展的瓶颈。