酸、碱、盐八圈图
- 格式:ppt
- 大小:59.00 KB
- 文档页数:1

初三化学八圈图Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】无机反应关系八圈图的用途 对于书写化学方程式来说,将物质分为七类为好:金属、非金属、碱性氧化物、酸性氧化物、碱、酸、盐。
因此,无机物即单质、氧化物和碱、酸、盐的相互关系图,一般把它叫做“八圈图”。
表物质反应的相互关系表物质的相互关系即是物质的性质,即反应规律,要牢固掌握!!无机物的相互关系表即八圈图有以下五个用途:1表示物质间的纵横衍变关系,如从金属或非金属如何衍变成盐;例1:完成下列反应:①MgMgOMgCl 2Mg(OH)2MgSO 4②CCO 2CaCO 3Ca(HCO 3)2CaCO 3CO 22表示16个基本反应规律;⑴金属+氧气碱性氧化物⑵碱性氧化物+水碱 ⑶非金属+氧气酸性氧化物⑷酸性氧化物+水含氧酸⑸金属+非金属无氧酸盐⑹酸性氧化物+碱性氧化物含氧酸盐⑺非金属+氢气酸⑻金属+酸盐+氢气⑼金属+盐盐+金属⑽非金属+盐盐+非金属⑾酸+碱性氧化物盐+水⑿酸+碱盐+水⒀碱+盐盐+碱⒁酸+盐盐+酸⒂盐+盐盐+盐 ⒃碱+酸性氧化物盐+水3表示物质的性质;例如,除了跟指示剂反应的这一性质在图中无法表示外,图中酸的没有打箭头的4根线表示的就是酸的性质:酸与碱作用生成盐和水,酸与碱性氧化物反应生成盐和水,酸与活泼金属反应生成盐和氢气,酸与盐反应生成新盐和新酸;图中碱的没有打箭号的3根线表示的就是碱的性质:碱与酸反应生成盐和水,碱与酸性氧化物反应生成盐和水,碱与盐反应生成新盐和新碱。
盐有4根没打箭头的线表示了盐的4种性质:盐与酸反应生成新盐和新酸,盐与碱反应生成新盐和新碱,盐与盐反应生成两种新盐,盐与非金属反应生成一种新盐和一种新非金属。
4表示基本反应类型:①—⑦表示化合反应;⑧—⑩表示置换反应;—表示复分解反应;化合反应能逆向进行的就是分解反应;5表示物质(特别是盐)的制法。

2012届高考复习高三备考13434233N aO H H PON a PO H O +=+22442()2C u O H H SO C uSO H O +=+33N aC l AgN O N aN O AgC l +=+↓2442H SO C uO C uSO H O +=+3C aC O ====高温2C aO C O +↑2C uO C O +↑3C uC O ∆专题 元素及其化合物专题复习指导化合可溶碱水可溶金属氧化物碱氧金属氧化物金属点⎭⎬⎫→+−−→−+∆)()()2()()1(/2OO Na O Na 2224=+ CuOO Cu 222∆+ 3Fe+2O 2点燃Fe 3O 4))9(()()()3(/同水盐酸碱分解水难溶碱氧难溶碱高温+→++−−→−∆2()(4)()5)(,)O ⎫+−−→⎪⎪⎬⎪+→⎪⎭点含氧酸非金属非金属氧化物酸氧化(酸氧水酸大多数难溶酸氧除外))9(()6(同水盐碱酸分解水酸氧酸+→++→NaOHO H O Na 222=+∆Cu 2223C O H O H C O +=2523432P O H O H PO +=2322H C O H O C O =+↑2322H SiO H O SiO ∆+2()Fe OH ∆==2323F e O H O+(9)(10)(11)+→+⎫⎪+→⎬⎪+→+⎭酸碱盐水盐盐两种新盐复分解酸碱氧盐水(12)+→+碱酸氧盐水22322N aO H C O N a C O H O+=+42422()N aO H C uSO N a SO C u O H +=+↓(13)(14)+→+⎫⎬+→+⎭酸盐新酸新盐复分解碱盐新碱新盐24232423H SO N a C O N a SO H C O +=+2322H C O H O C O =+↑2442()Z n H SO Z nSO H +=+↑稀44Zn C uSO C u ZnSO +=+2(15)(16)H ⎫+→+↑⎪⎬+→+⎪⎭金属酸盐置换反应金属盐新盐新金属(17)→+含氧酸盐酸氧碱氧(分解反应)。

无机反应关系(八圈图)的用途对于书写化学方程式来说,将物质分为七类为好:金属、非金属、碱性氧化物、酸性氧化物、碱、酸、盐。
因此,无机物(即单质、氧化物和碱、酸、盐)的相互关系图,一般把它叫做“八圈图”。
表物质反应的相互关系表物质的相互关系即是物质的性质,即反应规律,要牢固掌握!!无机物的相互关系表(即八圈图)有以下五个用途:(1)表示物质间的纵横衍变关系,如从金属或非金属如何衍变成盐;例1:完成下列反应:①Mg → MgO →MgCl2→ Mg(OH)2→ MgSO4②C → CO2→ CaCO3→ Ca(HCO3)2→ CaCO3→ CO2(2)表示16个基本反应规律;⑴金属+氧气→碱性氧化物⑵碱性氧化物+水→碱⑶非金属+氧气→酸性氧化物⑷酸性氧化物+水→含氧酸⑸金属+非金属→无氧酸盐⑹酸性氧化物+碱性氧化物→含氧酸盐⑺非金属+氢气→酸⑻金属+酸→盐+氢气⑼金属+盐→盐+金属⑽非金属+盐→盐+非金属⑾酸+碱性氧化物→盐+水⑿酸+碱→盐+水⒀碱+盐→盐+碱⒁酸+盐→盐+酸⒂盐+盐→盐+盐⒃碱+酸性氧化物→盐+水(3)表示物质的性质;例如,除了跟指示剂反应的这一性质在图中无法表示外,图中酸的没有打箭头的4根线表示的就是酸的性质:酸与碱作用生成盐和水,酸与碱性氧化物反应生成盐和水,酸与活泼金属反应生成盐和氢气,酸与盐反应生成新盐和新酸;图中碱的没有打箭号的3根线表示的就是碱的性质:碱与酸反应生成盐和水,碱与酸性氧化物反应生成盐和水,碱与盐反应生成新盐和新碱。
盐有4根没打箭头的线表示了盐的4种性质:盐与酸反应生成新盐和新酸,盐与碱反应生成新盐和新碱,盐与盐反应生成两种新盐,盐与非金属反应生成一种新盐和一种新非金属。
(4)表示基本反应类型:①—⑦表示化合反应;⑧—⑩表示置换反应;—表示复分解反应;化合反应能逆向进行的就是分解反应;(5)表示物质(特别是盐)的制法。
盐是无机物相互关系图中的大动脉,很多反应都可以制取盐。

酸碱盐氧化物知识小结—八圈图学法指导收集于网络,如有侵权请联系管理员删除3434233NaOH H PO Na PO H O +=+22442()2Cu OH H SO CuSO H O+=+33NaCl AgNO NaNO AgCl +=+↓2442H SO CuO CuSO H O +=+2H 2 + O 2点燃 2H 2O S + O 2 点燃 SO 2 N 2 + O 22NO 专题 元素及其化合物专题复习指导盐和金属金属非金属碱性氧化物酸性氧化物碱酸盐盐盐(无氧酸盐)盐(含氧酸盐)盐和水碱和盐酸和盐两种新盐盐和氢气+酸+碱(16)(1)+O 2(7)(17)+O 2(4)(17)(8)(2)+H 2O-H 2O(3)(11)(12)(5)+H 2O-H 2O(6)(15)(9)(14)(13)(10)记忆口诀:两条纵线通到底(6条规律) 四条横线相联系(5条规律) 六条交叉成网络(6条规律) 17条规律要牢记(横、纵各有1条重复6+5+6=17)1、规律:化合可溶碱水可溶金属氧化物碱氧金属氧化物金属点⎭⎬⎫→+−−→−+∆)()()2()()1(/2O O Na O Na 2224=+ CuO O Cu 222∆+ 3Fe+2O 2点燃Fe 3O 4 ))9(()()()3(/同水盐酸碱分解水难溶碱氧难溶碱高温+→++−−→−∆2()(4)()5)(,)O ⎫+−−→⎪⎪⎬⎪+→⎪⎭点含氧酸非金属非金属氧化物酸氧化合(酸氧水酸大多数难溶酸氧除外 ))9(()6(同水盐碱酸分解水酸氧酸+→++→NaOHO H O Na 222=+∆Cu O H CuO 2+22C O CO +点燃225452P O P O +点燃2223CO H O H CO +=2523432P O H O H PO +=2322H CO H O CO =+↑2322H SiO H O SiO ∆+32()Fe OH ∆==2323Fe O H O+(9)(10)(11)+→+⎫⎪+→⎬⎪+→+⎭酸碱盐水盐盐两种新盐复分解酸碱氧盐水(12)+→+碱酸氧盐水22322NaOH CO Na CO H O+=+42422()NaOH CuSO Na SO Cu OH +=+↓(13)(14)+→+⎫⎬+→+⎭酸盐新酸新盐复分解碱盐新碱新盐24232423H SO Na CO Na SO H CO +=+2322H CO H O CO =+↑2442()Zn H SO ZnSO H +=+↑稀44Zn CuSO Cu ZnSO +=+2(15)(16)H ⎫+→+↑⎪⎬+→+⎪⎭金属酸盐置换反应金属盐新盐新金属收集于网络,如有侵权请联系管理员删除2CuO CO +↑3CuCO∆3CuCO ====高温2CuO CO +↑(17)→含氧酸盐酸氧碱氧(分解反应)。

一、八圈图两条纵线通到底(七条规律)(1)~(7) 四条横线相联系(四条规律)(8)~(11) 六条交叉成网络(六条规律)(12)~(17)O Na ONa 2224=+ CuO O Cu 222+==2)(OH Cu O H CuO 2+OH PO Na 243433+= O H CuSO SO H OH Cu2)(+=+22CO O C 点燃+522254O P O P 点燃+32224325223PO H O H O P =+↑+=2232CO O H CO H2232SiO O H SiO H +∆从纵向来看: 金属→碱性氧化物→碱→盐,其中金属元素相同非金属→酸性氧化物→酸→盐,其中非金属元素相同NaCl Cl Na 22点燃+3CaSiO SiO CaO 高温+↑+2CO CaO CaCO 高温↓+=+AgCl NaNO AgNO NaCl33O H 24+O H CO Na 2322+32423242CO H SO Na +↑+=2232CO O H CO H↓+=+242)(2OH Cu SO Na CuSO NaOH↑+=+24)(H ZnSO SO H Zn 稀44二、八圈图的应用1、可知某物质的性质。
2、可知某物质(特别是盐)的制法。
(4)、(8)、(9)、(11)-(17)为盐的十种制法3、可知反应规律。
注意事项:<1> 既要掌握八圈图表明的物质及其变化的通性,又要注意其特性。
(1)、(2)、(5)、(6)、(8)、(9)。
属于分解反应的有:(3)、(7)、(10)。
属于置换反应的有:(16)、(17)。
属于复分解反应的有:(4)、(11)、(12)、(14)、(15)。
规律(13)不属于任何一种基本反应类型<3> 复分解反应规律条件:弱、淀、气① 相对强酸→相对弱酸↑++=+22232CO O H CaCl HCl CaCO ↓+=+323222SiO H NaCl HCl SiO Na ②高沸点酸→低沸点酸↑+∆+HCl SO Na NaCl SO H 2)(2)(4242固浓<4> 金属间置换反应规律的条件:金属活动顺序强换弱 ① 金属与酸反应:H 前金属,酸不能用硝酸、浓硫酸 ② 金属与盐反应:可溶性盐,排在前面的金属三、各物质的通性。

八圈
图
1. 各类物质相同转化关系图(俗称八圈图)
两条纵线通到底(七条规律)(1)~(7)
O H CuO 2+
O H PO Na 243433+=
O H CuSO SO H OH Cu
CO O C 点燃
+ 52254O P O P 点燃+
CO H O H CO =+ 23PO H O H O P =+
↑+=2232CO O H CO H 2232SiO O H SiO H +
从纵向来看,金属→碱性氧化物→碱→盐,其中金属元素相同。
非金属→酸性氧化物→酸(含氧酸)→盐,其中非金属元素相同。
点燃
对于盐+酸→新盐+新酸,有如下规律:
① 强酸弱酸
如:↑++=+22232CO O H CaCl HCl CaCO
② 稳定的(不易分解的)酸→不稳定的(另分解的)酸。
如:↑++=+22232CO O H CaCl HCl CaCO
③ 高沸点(不易挥发的)酸→低沸点(易挥发的)酸。
如:↑+∆+HCl SO Na NaCl SO H 2)
(2)(4242固浓
④ 可溶性酸→难溶性酸。
如:↓+=+3222SiO H NaCl HCl SiO Na
5)、(6)、(8)、(9)。
属于分解反应的有:规律(3)、(7)、(10)。
属于置换反应的有:规律(16)、(17)。
属于复分解反应的有:规律(4)、(11)、(12)、(14)、(15)。
规律(13)不属于任何一种基本反应类型。


1、两条纵线
(1)金属单质→碱性氧化物→碱→盐
(2)非金属单质→酸性氧化物→酸→盐
2、四条横线
(1)金属单质+非金属单质→盐
(2)碱性氧化物+酸性氧化物→盐
(3)碱+酸→盐+水
(4)盐+盐→新盐+新盐
3、四条交叉线
(1)碱性氧化物+酸→盐+水
(2)酸性氧化物+碱→盐+水
(3)碱+盐→新盐+新碱
(4)酸+盐→新盐+新酸
4、两条弯线
(1)金属+盐→新金属+新盐
(2)金属+酸→盐+氢气
注意:
1、熟记金属活动顺序表:
K Ca Na Mg Al Zn Fe Sn Pb (H)Cu Hg Ag Pt Au (1)金属活动顺序表中,排在氢前面的金属能从酸中置换出氢。
(2)铁在溶液中发生置换时,生成+2价的亚铁化合物。
(3)在金属活动顺序表中,活泼性较强的金属可以从盐溶液中置换出活泼性
较弱的金属。
2、复分解反应发生的条件:生成物中有沉淀析出或有气体放出或有水生成。
酸、碱、盐的溶解性规律
钾钠铵盐硝酸盐,都能溶于水中间;
盐酸难溶银亚汞,硫酸盐中除钡铅;
碳酸磷酸亚硫酸,可溶只有钾钠铵;
溶碱钡加钾钠铵,氢氧化钙是微溶。
练习
1、按下列要求写出四个制取氯化镁的化学方程式:
(1)金属与盐的反应;
(2)氧化物与酸的反应:
(3)酸与碱的反应:
(4)酸与盐的反应:
2、下列各组物质混合后,不能发生化学反应的是()
A. 碳酸钠溶液与盐酸
B. 氯化钡溶液与硫酸
C. 氢氧化钾溶液与硝酸
D. 硝酸钾溶液与氯化钠溶液。




无机反应关系(八圈图)的用途对于书写化学方程式来说,将物质分为七类为好:金属、非金属、碱性氧化物、酸性氧化物、碱、酸、盐。
因此,无机物(即单质、氧化物和碱、酸、盐)的相互关系图,一般把它叫做“八圈图”。
表物质反应的相互关系表物质的相互关系即是物质的性质,即反应规律,要牢固掌握!!无机物的相互关系表(即八圈图)有以下五个用途:(1) 表示物质间的纵横衍变关系,如从金属或非金属如何衍变成盐;例1:完成下列反应:① Mg → MgO →MgCl2 → Mg(OH)2 → MgSO4② C → CO2 → CaCO3 → Ca(HCO3)2 → CaCO3 → CO2(2) 表示16 个基本反应规律;⑴ 金属+氧气→ 碱性氧化物⑵ 碱性氧化物+水→ 碱⑶ 非金属+氧气→ 酸性氧化物⑷ 酸性氧化物+水→ 含氧酸⑸ 金属+非金属→ 无氧酸盐⑹ 酸性氧化物+碱性氧化物→ 含氧酸盐⑺ 非金属+氢气→ 酸⑻ 金属+酸→ 盐+氢气⑼ 金属+盐→ 盐+金属⑽ 非金属+盐→ 盐+非金属⑾ 酸+碱性氧化物→ 盐+水⑿ 酸+碱→ 盐+水⒀ 碱+盐→ 盐+碱⒁ 酸+盐→ 盐+酸⒂ 盐+盐→ 盐+盐⒃ 碱+酸性氧化物→ 盐+水(3) 表示物质的性质;例如,除了跟指示剂反应的这一性质在图中无法表示外,图中酸的没有打箭头的4 根线表示的就是酸的性质:酸与碱作用生成盐和水,酸与碱性氧化物反应生成盐和水,酸与活泼金属反应生成盐和氢气,酸与盐反应生成新盐和新酸;图中碱的没有打箭号的3 根线表示的就是碱的性质:碱与酸反应生成盐和水,碱与酸性氧化物反应生成盐和水,碱与盐反应生成新盐和新碱。
盐有4 根没打箭头的线表示了盐的4种性质:盐与酸反应生成新盐和新酸,盐与碱反应生成新盐和新碱,盐与盐反应生成两种新盐,盐与非金属反应生成一种新盐和一种新非金属。
(4) 表示基本反应类型:①—⑦表示化合反应;⑧—⑩表示置换反应;—表示复分解反应;化合反应能逆向进行的就是分解反应;(5) 表示物质(特别是盐)的制法。

物质间的相互转化初中化学所涉及的元素化合物知识主要包括以O 2、H 2、C 、S 、P 等为代表的非金属单质,以Fe 为代表的金属单质,以CO 、CO 2等为代表的非金属氧化物,以Fe 2O 3 、CuO 等为代表的金属氧化物,以及酸、碱、盐等。
这些物质之间的相互关系可以通过物质间相互转化关系图(即八圈图)。
1. 各类物质相同转化关系图(俗称八圈图)在上图中所涉及的反应规律可简记为:两条纵线通到底(七条规律)(1)~(7)四条横线相联系(四条规律)(8)~(11)六条交叉成网络(六条规律)(12)~(17)17条规律须牢记反应规律示例纵向:(1)金属+−−−→−∆/2点燃O 金属氧化物(碱性氧化物) O Na O Na 2224=+ C u O O Cu 222∆+(2)碱性氧化物(可溶)+水→碱(可溶)NaOH O H O Na 222=+(3)碱(难溶)−−−→−∆高温/碱氧(难溶) + 水∆==2)(OH Cu O H CuO 2+(4)酸+碱→盐+水 O H PO Na PO H NaOH 2434333+=+O H C u S O SO H OH Cu 244222)(+=+ (5)非金属+−−→−点燃2O 非金属氧化物(酸性氧化物) 22CO O C 点燃+ 522254O P O P 点燃+ (6)酸性氧化物(易溶)+水→酸(易溶)3222CO H O H CO =+ 4325223PO H O H O P =+(7)酸(易挥发 / 难溶)→酸氧+水(易挥发 / 难溶)↑+=2232CO O H CO H 2232S i O O H S i O H +∆从纵向来看,金属→碱性氧化物→碱→盐,其中金属元素相同。
非金属→酸性氧化物→酸(含氧酸)→盐,其中非金属元素相同。
横向:(8)金属+非金属→(无氧酸)盐NaCl Cl Na 222点燃+(9)碱氧+酸氧→(含氧酸)盐 32CaSiO SiO CaO 高温+(10)含氧酸盐→碱氧+酸氧↑+23CO CaO CaCO 高温(11)盐+盐→两种新盐↓+=+AgCl NaNO AgNO NaCl 33交叉:(12)酸+碱氧→盐+水O H CuSO CuO SO H 2442+=+(13)碱+酸氧→盐+水O H CO Na CO NaOH 23222+=+(14)酸+盐→新酸+新盐32423242CO H SO Na CO Na SO H +=+↑+=2232CO O H CO H(15)碱+盐→新碱+新盐↓+=+2424)(2OH Cu SO Na CuSO NaOH(16)金属+酸→盐+↑2H↑+=+2442)(H ZnSO SO H Zn 稀(17)金属+盐→新盐+新金属44ZnSO Cu CuSO Zn +=+以上十七条规律的应用:(1)可知某物质的性质。

八圈图
1.各类物质相同转化关系图俗称八圈图
两条纵线通到底七条规律1~7
四条横线相联系四条规律8~11 六条交叉成网络六条规律12~17
17条规律须牢记
;
非金属→酸性氧化物→酸含氧酸→盐,其中非金属元素相同;
2可知某物质的制法;如:4、8、9、11~17为盐的十种制法;
对于盐+酸→新盐+新酸,有如下规律:
① 强酸→弱酸
如:↑++=+22232CO O H CaCl HCl CaCO
②稳定的不易分解的酸→不稳定的另分解的酸;
如:↑++=+22232CO O H CaCl HCl CaCO ③高沸点不易挥发的酸→低沸点易挥发的酸; 如:↑+∆+HCl SO Na NaCl SO H 2)
(2)(4242固浓 ④可溶性酸→难溶性酸;
如:↓+=+322SiO H NaCl HCl SiO Na
6、8、9; 属于分解反应的有:规律3、
7、10;
属于置换反应的有:规律16、17;
属于复分解反应的有:规律4、11、12、14、15; 规律13不属于任何一种基本反应类型;。
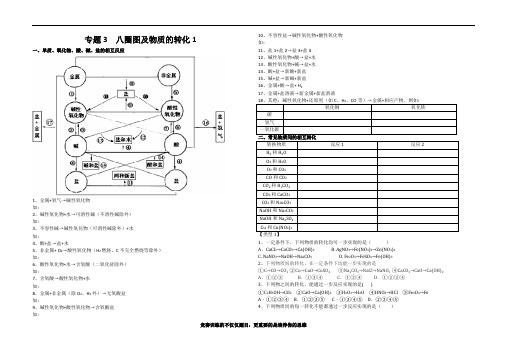
专题3 八圈图及物质的转化1一、单质、氧化物、酸、碱、盐的相互反应1、金属+氧气→碱性氧化物如:2、碱性氧化物+水→可溶性碱(不溶性碱除外)如:3、不容性碱→碱性氧化物(可溶性碱除外)+水如:4、酸+盐→盐+水5、非金属+ O2→酸性氧化物(H2燃烧、C不完全燃烧等除外)如:6、酸性氧化物+水→含氧酸(二氧化硅除外)如:7、含氧酸→酸性氧化物+水如:8、金属+非金属(除O2、H2外)→无氧酸盐如:9、碱性氧化物+酸性氧化物→含氧酸盐如:10、不容性盐→碱性氧化物+酸性氧化物如:11、盐1+盐2→盐3+盐412、碱性氧化物+酸→盐+水13、酸性氧化物+碱→盐+水14、酸+盐→新酸+新盐15、碱+盐→新碱+新盐16、金属+酸→盐+ H217、金属+盐溶液→新金属+新盐溶液1、一定条件下,下列物质的转化均可一步实现的是()A.CaCl2→CaCO3→Ca(OH)2 B. AgNO3→Fe(NO3)2→Zn(NO3)2C. NaNO3→NaOH→Na2CO3D. Fe2O3→FeSO4→Fe(OH)32、下列物质间的转化,在一定条件下均能一步实现的是①C→CO→CO2 ②Cu→CuO→CuSO4 ③Na2CO3→NaCl→NaNO3 ④CaCO3→CaO→Ca(OH)2 A.①②③B.①③④C.①②④ D.①②③④3、下列物之间的转化,能通过一步反应实现的是( )①C2H5OH→CO2②CaO→Ca(OH)2③H2O2→H2O④HNO3→HCl⑤Fe3O4→Fe A.①②③④ B.①②③⑤ C.①③④⑤ D.②③④⑤4、下列物质间的每一转化不能..都通过一步反应实现的是()A.CuO→Cu→CuO B.NaOH→H2O→NaOH C.O2→Fe3O4→O2D.Fe→FeCl2→Fe5、下列物质间的每一转化不能都通过一步反应实现的是()A.Ca→CaO→CaCl2B.NaOH→Na2CO3→NaClC.O2→CuO→Cu(OH)2D.C→CO2→Na2CO36、下列转化能一步完成的()① CH4→CO2 ②HNO3→HCl ③CaO→Ca(OH)2 ④Ba(OH)2→NaOH ⑤C→CuA.①③④⑤ B.②③④⑤ C.①②④⑤ D.①②③④7、下列转化能一步完成的是()①CaCO3→CO2②HCl→NaCl③CaO→Ca(OH)2④Ca(OH)2→NaOH⑤CuO→Cu.A.①②③④⑤B.②③④⑤C.①②④⑤D.①②③④8、下列转化能一步完成的是()①Ba(OH)2→NaOH②CuO→Cu(OH)2 ③HNO3→HCl④SO2→Na2SO3.A.①④ B.②③ C.③④ D.只有④9、下列物质之间的转化能够实现的是()10、下列物质间的转化关系正确的是()A.①②B.②③ C.①③ D.①②③【类型2】1、现有Fe、CuO、MgCl2、Ca(OH)2、稀H2SO4等五种物质,在常温下它们两两相互发生的化学反应有()A.7个B.6个C.5个D.4个2、现有氧化铁、稀硫酸、氢氧化钠溶液、氯化钡溶液和碳酸钾溶液五种物质,在常温下它们两两相互发生的化学反应有()A.4个B.5个C.6个D.7个3、现有Zn、Fe2O3、MgCl2、Cu(OH)2、稀H2SO4等五种物质,在常温下它们两两相互发生的化学反应有()A.3个B.4个C.5个D.6个4、对于化学反应X + Na2CO3 == 2Y+ CaCO3↓的分析错误的是()A.该反应属于复分解反应B.Y中一定含有钠元素C.X一定是熟石灰D.X中阴离子化合价是—1价5、对于复分解反应:X+2NaOH2Y+Cu(OH)2↓,下列分析中正确的是()A.X一定是CuCl2B.相对分子质量大小:X>Y C.Y可能是H2O D.Y可能是Na2SO4【类型3】1、下列各组变化中,每一转化在一定条件下均能一步实现的是()A.①和② B.②和③ C.①和③ D.①②③2、下列各组物质间通过一步反应就能实现如图所示的转化,则甲、乙、丙可能分别是()A.NaOH、NaCl、NaNO3B.CO、CO2、H2 CO3C.CaO、Ca(OH)2、CaCO3D.H2O2、H2O、O23、(2013•徐州一模)下列各组中物质间的转化不都是通过一步反应实现的是()4、下列各组物质间通过一步反应就能实现如右图转化,则甲、乙、丙可能是()A.KOH KCl KNO3B.CuO CuCl2Cu(OH)2C.C CO2COD.H2O2H2O O25、(2014·宿迁)下列物质的三角转化关系中都能按箭头方向一步实现的是( )A.① B.①② C.①②③ D.②③6、下列各组转化中,一定条件下均能一步实现的组合是()A.①②B.②③C.①③D.①②③专题3 八圈图及物质的转化2【类型3】7、下列有关说法正确的是( ) A .实现CO CO 2的相互转化,都只有一种途径B .Al 可以实现单质氧化物碱C .实现C CO 的转化,都利用了碳的可燃性D .实现H 2OO 2相互转化,化学反应的基本类型不同8、比较归纳是化学学习中常用的一种方法.以下是C 、CH 4、CO 三种物质转化为CO 2的转化关系,即:①C→CO 2②CH 4→CO 2③CO→CO 2,对它们的比较归纳正确的是( )A .三种转化发生的都是化合反应B .三种物质都只能跟氧气反应转化为二氧化碳C .三种物质都可以在点燃条件下转化为二氧化碳D .三种转化所有的生成物在常温下都是气体 9、(2014黄冈市)已知甲、乙、丙、丁是初中化学中的四种常见物质,丁是甲与乙、乙与丙反应的生成物之一(反应条件均已略去),转化关系如图:(1)常温下,若乙为红色粉末,甲为黑色粉末,则丙的化学式是______,甲与乙反应的化学方程式为______。

高中化学酸碱盐氧化物知识小结—八圈图学法指导盐和金属金属非金属碱性氧化物酸性氧化物碱酸盐盐盐(无氧酸盐)盐(含氧酸盐)盐和水碱和盐酸和盐两种新盐盐和氢气+酸+碱(16)(1)+O2(7)(17)+O2(4)(17)(8)(2)+H2O-H2O(3)(11)(12)(5)+H2O-H2O(6)(15)(9)(14)(13)(10)记忆口诀:两条纵线通到底(6条规律)四条横线相联系(5条规律)六条交叉成网络(6条规律)17条规律要牢记(横、纵各有1条重复6+5+6=17)规律:化合可溶碱水可溶金属氧化物碱氧金属氧化物金属点⎭⎬⎫→+−−→−+∆)()()2()()1(/2O))9(()()()3(/同水盐酸碱分解水难溶碱氧难溶碱高温+→++−−→−∆化合难溶酸氧除外大多数酸水酸氧酸氧非金属氧化物非金属含氧酸点⎪⎭⎪⎬⎫→+−→−+),()5()()4()(2O))9(()6(同水盐碱酸分解水酸氧酸+→++→复分解水盐碱氧酸两种新盐盐盐水盐碱酸⎪⎭⎪⎬⎫+→+→++→+)11()10()9(水盐酸氧碱+→+)12(复分解新盐新碱盐碱新盐新酸盐酸⎭⎬⎫+→++→+)14()13(置换反应新金属新盐盐金属盐酸金属⎭⎬⎫+→+↑+→+)16()15(2H碱氧酸氧含氧酸盐+→)17(高温====3CaCO ↑+2CO CaO高温====3BaCO ↑+2CO BaO以上规律的应用:① 可知某物质性质 ② 某物质制法(箭尾) (箭头指向) ③ 各类物质间相互关系从上述规律中可以总结出制盐的十种方法,包括:(2)~(16) 【典型例题】[例1] 现有石灰石、水、碳酸钠,怎样制取烧碱(不能引入其他物质),写出化学方程式。
解析:此题是物质的制备题。
在具备单质、氧化物、酸、碱、盐的相互关系,各种物质的制备规律和条件时,还要掌握酸、碱、盐的溶解性,就可以考虑解题方法了。
本题应采用倒推法,即从产品烧碱出发向原料推。
在考虑过程中应注意烧碱是一种可溶性碱,制备时应用盐+碱—新盐+新碱这一规律,此规律的条件是反应物都是可溶于水的物质且生成物必有一种物质是难溶于水时,此复分解反应才能发生,而且能把烧碱分离出来。