材料科学基础第二章 固体材料的结构
- 格式:doc
- 大小:14.02 MB
- 文档页数:43


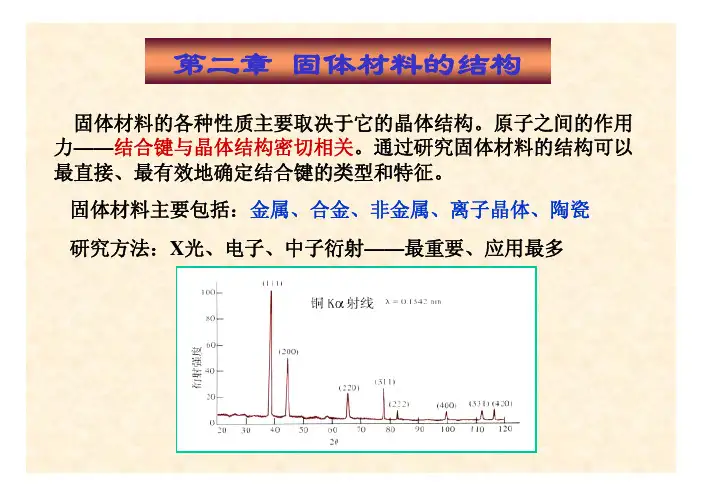
第二章固体材料的结构固体材料的各种性质主要取决于它的晶体结构。
原子之间的作用结合键与晶体结构密切相关。
通过研究固体材料的结构可以最直接、最有效地确定结合键的类型和特征。
固体材料主要包括:金属、合金、非金属、离子晶体、陶瓷研究方法:X光、电子、中子衍射——最重要、应用最多§2-1 结合键结合键——原子结合成分子或固体的结合键决定了物质的物理、化学、力学性质。
一切原子之间的结合力都起源于原子核与电子间的静电交互作用(库仑力)。
不同的结合键代表了实现结构)的不同方式。
一、离子键典型的金属与典型的非金属元素就是通过离子键而化合的。
从而形成离子化合物或离子晶体由共价键方向性特点决定了的SiO2四面体晶体结构极性共价键非极性共价键五、氢键含有氢的分子都是通过极性共价键结合,极性分子之间结合成晶体时,通过氢键结合。
例如:H 2O ,HF ,NH 3等固态冰液态水§2-2 金属原子间的结合能一、原子作用模型固态金属相邻二个原子之间存在两种相互作用:a) 相互吸引——自由电子吸引金属正离子,长程力;b) 相互排斥——金属正离子之间的相互排斥,短程力。
平衡时这二个力相互抵消,原子受力为0,原子处于能量最低状态。
此时原子间的距离为r0。
§2-3 合金相结构基本概念♦合金——由两种或两种以上的金属或金属非金属元素通过化学键结合而组成的具有金属特性的材料。
♦组元、元——组成合金的元素。
♦相——具有相同的成分或连续变化、结构和性能的区域。
♦组织——合金发生转变(反应)的结果,可以包含若干个不同的相,一般只有一到二个相。
♦合金成分表示法:(1) 重量(质量)百分数A-B二元合金为例m B——元素B的重量(质量m A——元素A的重量(质量合金中的相分为:固溶体,化合物两大类。
固溶体金属晶体(溶剂)中溶入了其它元素(溶质)后,就称为固溶体。
一、固溶体的分类:♦按溶质原子在溶剂中的位置分为:置换固溶体,间隙固溶体♦按溶解度分为:有限固溶体,无限固溶体♦按溶质原子在溶剂中的分布规律分为:有序固溶体,无序固溶体置换固溶体:溶质原子置换了溶剂点阵中部分溶剂原子。



第2章 固体材料的结构一、选择题1.空间电子的意义为()。
[浙江大学2006研]A.晶体中杂质原子的分布规律B.晶体中原子或分子的空间规则排列C.晶体中与原子或分子的电荷空间分布规律【答案】B2.间隙相和间隙固溶体的区别在于()。
[东南大学2005研]A.间隙相的结构比间隙固溶体简单B.间隙相中原子结合符合化合价规律,间隙固溶体不符合化合价规律C.间隙固溶体中间隙原子在溶剂晶格的间隙中,间隙相中原子在正常原子位上D.间隙相中有点阵畸变,间隙固溶体中没有点阵畸变【答案】C3.离子晶体通常借助表面离子的极化变形和重排来降低其表面能,对于下列离子晶体的表面能,最小的是()。
[南京工业大学2008研]A.CaF2B.PbF2C.Pbl2D.BaSO4E.SrSO4【答案】C二、填空题1.材料的结合键决定其弹性模量的高低。
氧化物陶瓷材料以______键为主,结合键______故其弹性模量______;金属材料以______键为主,结合键______故其弹性模量______;高分子材料的分子链上是______键,分子链之间是______键,故其弹性模量______。
【答案】离子;较强;较高;金属;较弱;较低;共价;分子;最低2.固溶体中,当溶质原子和溶剂原子分别占据固定位置,且每个晶胞中溶质原子和溶剂原子数之比一定时,这种有序结构被称为______。
[北京工业大学2009研]【答案】超点阵3.形成有序固溶体的必要条件是:______、______、______。
[中南大学2003研]【答案】异类原子之间相互吸引力大于同类原子之间吸引力;一定的化学成分;较慢的冷却速度4.无序固溶体转变为有序固溶体时,合金性能变化的一般规律是:强度和硬度______,塑性______,导电性______。
[中南大学2003研]【答案】升高;降低;降低三、判断题1.固溶体是一种溶解了杂质组分的非晶态固体。
[中南大学2004研]【答案】×2.形成连续固溶体的最主要条件是溶质和溶剂的晶体结构要一致,例如,银和铝都具有面心立方结构。



第二章固体材料的结构固体材料的宏观使用性能(包括力学性能、物理性能和化学性能)和工艺性能(如铸造性能、压力加工性能、机加工性能、焊接性能、热处理性能等)取决于其微观的化学成分、组织和结构,化学成分不同的材料具有不同的性能,而相同成分的材料经不同处理使其具有不同的组织、结构时,也将具有不同的性能。
而在化学成分、组织和结构中,晶体结构又是最关键的因素。
因此,要正确地选择性能符合要求的材料或研制具有更好性能的材料,首先要熟悉和控制其晶体结构。
除了实用意义外,研究固体材料的结构还有很大的理论意义。
§2.1 基础知识原子结构影响原子结合的方式,而根据原子结合方式又可以将材料分成金属、陶瓷和聚合物,并得出关于这三种材料的宏观物理性能、化学性能及力学性能的一些普遍性结论。
2.1.1原子结构大家都知道原子是由电子及其所围绕的原子核组成的。
原子核内有中子和带正电的质子,因此原子核带正电荷。
通过静电吸引,带负电荷的电子被牢牢地束缚在原子核周围。
每26个电子和质子所带的电荷q为l.6×10-19C。
因为原子中电子和质子的数目相等,所以从整体说来,原子是电中性的。
元素的原子序数等于原子中的电子或质子数。
因此,有26个电子和26个质子的铁原子,其原子序数为26。
原子的大部分质量集中在原子核内。
每个质子和中子的质量大致为l.67×10-24g,但是每个电子的质量只有9.11×10-28 g。
原子质量M等于原子中质子和中子之和的平均数,是原子数量为阿伏伽德罗数N A的质量。
N A=6.02×1023/ mol是一摩尔物质内原子或分子的数目。
因此,原子质量的单位是g / mol。
原子质量的另一个单位是原子质量单位,它是碳12质量的1/12。
原子核内含有不同中子数的相同元素的原子称为同位素,它们有着不同的原子质量。
这种元素的原子质量是一些不同同位素质量的平均值,因此原子质量可能不是一个整数。
第二章固体材料的结构固体材料的宏观使用性能(包括力学性能、物理性能和化学性能)和工艺性能(如铸造性能、压力加工性能、机加工性能、焊接性能、热处理性能等)取决于其微观的化学成分、组织和结构,化学成分不同的材料具有不同的性能,而相同成分的材料经不同处理使其具有不同的组织、结构时,也将具有不同的性能。
而在化学成分、组织和结构中,晶体结构又是最关键的因素。
因此,要正确地选择性能符合要求的材料或研制具有更好性能的材料,首先要熟悉和控制其晶体结构。
除了实用意义外,研究固体材料的结构还有很大的理论意义。
§2.1 基础知识原子结构影响原子结合的方式,而根据原子结合方式又可以将材料分成金属、陶瓷和聚合物,并得出关于这三种材料的宏观物理性能、化学性能及力学性能的一些普遍性结论。
2.1.1原子结构大家都知道原子是由电子及其所围绕的原子核组成的。
原子核内有中子和带正电的质子,因此原子核带正电荷。
通过静电吸引,带负电荷的电子被牢牢地束缚在原子核周围。
每26个电子和质子所带的电荷q为l.6×10-19C。
因为原子中电子和质子的数目相等,所以从整体说来,原子是电中性的。
元素的原子序数等于原子中的电子或质子数。
因此,有26个电子和26个质子的铁原子,其原子序数为26。
原子的大部分质量集中在原子核内。
每个质子和中子的质量大致为l.67×10-24g,但是每个电子的质量只有9.11×10-28 g。
原子质量M等于原子中质子和中子之和的平均数,是原子数量为阿伏伽德罗数N A的质量。
N A=6.02×1023/ mol是一摩尔物质内原子或分子的数目。
因此,原子质量的单位是g / mol。
原子质量的另一个单位是原子质量单位,它是碳12质量的1/12。
原子核内含有不同中子数的相同元素的原子称为同位素,它们有着不同的原子质量。
这种元素的原子质量是一些不同同位素质量的平均值,因此原子质量可能不是一个整数。
2.1.2能级图和原子的电子结构电子在原子内部占据着不同的能级。
每个电子具有一个特定的能量,而每个电子的能级可由四个量子数决定,可能的能级数由前三个量子数决定。
(一)量子数1.主量子数n为正整数1、2、3、4、5…,它表示电子所处的量子壳层,如图2-1所示。
量子壳层往往用一个字母而不是用一个数表示。
n=1的壳层命名为K,n=2的壳层用L表示,而n=3时则用M表示等等。
2.每个量子壳层内的能级数由角量子数l和磁量子数m l决定。
角量子数也可用数l和m 字表示:l=0、1、2、… n-1。
假如n=2,那么就有两个角量子数l=0和l=1。
角量子数往往用英文小写字母表示。
图 2-1 钠(原子序数为11)原子结构中K﹑L、M量子壳层的电子分布状况图2-2 钠元素11个电子中每个电子的全部量子数l=0 s能级l=1 p能级l=2 d能级l=3 f能级磁量子数m l给出每个角量子数的能级数和轨道数。
每个l下的磁量子数的总数为2l+1。
-l和+l之间的整数给出m l值。
对于l=2的情况,磁量子数为2×2+1=5,其值为-2、-1、0、+1、+2。
3.泡利不相容原理规定,在每一轨道上只允许存在两个电子,且它们的自旋方向相反。
自旋量子数m s规定为+1/2和-1/2,以反映不同的自旋方向。
图2-2显示了钠原子内每个电子的量子数和能级数。
(二)原子轨道近似能级图我们知道,在氢原子中,原子轨道的能级只与主量子数n有关,n越大的轨道能级越高,n相同的轨道能级相同。
所以各轨道的能级顺序应为:1s<2s=2p<3s=3p=3d<4s…。
但在多电子原子中,各轨道的能级不仅与主量子数有关,还与角量子数l有关。
其原因是由于存在着电子间的相互作用。
鲍林(L.Pauling)根据光谱实验结果,总结出了多电子原子的原子轨道近似能级图,如图2-3所示。
图中小圆圈表示原子轨道,每个方框中的各轨道能量相近,合称为一个能级组。
例如 1s轨道为第一能级组;5s,4d和 5p轨道合称为第五能级组。
图2-3 原子轨道近似能级图从图中可以看到,对于角量子数l相同而主量子数n不同的各轨道,总是n越大能级越高。
例如 1s<2s<3s<4s…;3d<4d<5d…。
对于主量子数n相同而角量子数l不同的各轨道,总是l越大能级越高。
即ns<np<nd<nf…,例如3s<3p<3d。
对于主量子数和角量子数都不同的轨道,情况要复杂得多,有能级交错现象,如5s<4d 、6s<4f<5d等等。
上述结果是从光谱实验得到的,理论上则可以由屏蔽效应和钻穿效应给予解释。
(三)原子核外电子分布多电子原子的结构就是原子核外的电子如何分布的问题。
这一问题主要是靠光谱实验的结果来解决的。
这里要介绍的则是根据光谱实验的结果所总结出的一些规律。
主要有泡利( W.Pauli)不相容原则、能量最低原则和洪特(F.Hund)规则。
1.泡利不相容原则一个原子轨道最多只能容纳二个电子,且这二个电子自旋方向必须相反,这就是泡利不相容原则。
其实质就是一个原子中不可能有两个电子具有完全相同的运动状态,也就是不可能有两个电子具有完全相同的四个量子数。
对于一个原子轨道来说,n、l和m l都是相同的,因此这个轨道中的各个电子其m s必须不相同,而m s的取值只有两个,即+1/2和-1/2。
所以,这一轨道中最多只能容纳自旋方向相反的两个电子。
2.能量最低原则要解决原子核外电子如何分布的问题,只知道每个轨道可能容纳的电子数还不够,还得解决电子先分布在什么轨道,后分布在什么轨道的问题。
自然界有一条普遍的规律:体系能量越低的状态相对越稳定。
这一规律也适用于原子结构。
电子优先占据能级较低的原子轨道,使整个原子体系能量处于最低,这就叫做能量最低原则,当然,前提是不违背泡利不相容原则。
有了能量最低原则和前面介绍的原子轨道近似能级图,电子在原子轨道中的填充顺序就可以确定为:首先是填充 ls轨道,然后依次填充2s、2p、3s、3p、4s、3d、4p、5s、4d、5p、6s、4f、5d、6p、7s、5f、6d等轨道。
利用图2-4将更容易掌握这一填充顺序。
图 2-4 核外电子填充顺序图3.洪特规则能量最低原则解决了电子在能级不同的各轨道中的分布问题。
n和l都相同的三个p轨道,其能级是相同的。
这种能级相同的一组轨道称为等价轨道。
在等价轨道中电子又是如何分布的呢?洪待根据光谱数据总结出了电子在等价轨道中的分布规律,即洪待规则:电子在等价轨道中分布时,应尽可能分占不同的轨道,而且自旋方向相同(或者说自旋平行)。
例如,若np轨道上有两个电子,那么这两个电子的分布应为↑↑而不是↑↓(表示原子轨道;↑↓表示两个电子自旋方向相反;↑↑表示两个电子自旋方向平行)。
此外,作为洪特规则的补充,当等价轨道处于半充满、全充满状态时体系相对较稳定,也是电子分布的一条规律。
有了上述原则和填充顺序,大多数原子基态时的电子分布式(也称电子组态)就可以正确简便地写出来。
例如,Z=10的Ne原子,核外有10个电子,首先在1s轨道上填充两个电子,然后在2p轨道上填充两个电子,最后在2p轨道上填充剩下的6个电子,所以Ne 原子的电子组态应为:1s22s22p6轨道符号右上角的数值表示轨道中的电子数。
26号的Fe原子,其电子的填充情况应为:1s22s22p63s23p64s23d6而其电子组态则要重新改写,把主量子数相同的原子轨道写在一起。
因此Fe原子的电子组态应为:1s22s22p63s23p63d64s2有些原子因考虑全充满、半充满的要求,在最外层常出现一个电子转移到另一个轨道。
如Z=24的Cr原子和Z= 29的Cu原子,若按一般情况,其电子填充情况应分别为:Cr:1s22s22p63s23p64s23d4Cu:1s22s22p63s23p64s23d9但为满足全充满、半充满的要求,Cr 的1个 4 s 电子转移到3d轨道,Cu的1个4 s电子也转移到3d轨道,这样Cr和Cu的电子实际填充情况分别为:Cr:1s22s22p63s23p64s13d5Cu:1s22s22p63s23p64s13d10它们的电子组态分别为:Cr:1s22s22p63s23p63d54s1 Cu:1s22s22p63s23p63d104s1(四)原子价原子价是指一种原子与其它元素化合的能力,因此往往由最外层的杂化sp能级中的电子数决定。
例如:Mg:1s22s22p63s2原子价=2Al:1s22s22p63s23p1原子价=3Ge:1s22s22p63s23p63d104s24p2原子价=4原子价也取决于化学反应的性质。
磷的电子结构为:1s22s22p63s23p3磷与氧化合时,为5价,与正常价数相符。
但是当磷与氢反应时,它只有3价——因为起作用的是3p能级中的电子。
(五)原子稳定性假如原子的价数是0。
即没有电子参与化学反应,则该元素是惰性的。
氩就是一个例子,它的电子结构为:1s22s22p63s23p6其它原子也倾向于或者填满其外壳层sp能级,使之具有8个电子,或者让它们完全空着。
铝的电子结构是在外壳层sp能级中有3个电子,即1s22s22p63s23p1因此,铝原子很容易放弃它的3个外层电子,使3sp能级空出来。
这3个外层电子与周围原子的相互作用机制决定了铝的原子键合本质和化学行为。
另一方面,外层3sp能级具有7 个电子的氯元素的电子结构为:1s22s22p63s23p5氯的活泼性在于它要接受电子以填充它的外层能级。
2.1.3周期表与周期性已发现的100多种元素被排列成元素周期表,周期表中各元素的性质呈现出周期性的递变规律。
事实上,这都是由于原子结构即原子核外电子的分布呈周期性的变化所造成的。
(一)原子结构与元素周期表1869年,门捷列夫将当时已发现的元素按其化学性质及物理性质的相似性和周期性分组分周期排列成表,称为元素周期表。
后来又不断地把新发现的元素排入表中,发展成为现在较通用的长式周期表。
各元素排列成七横行和十八纵行,每一横行就是一个周期。
另外还有二横行位于周期表的下面,由镧系和锕系元素组成,实际上是分别从第六、七周期中抽出来的,目的只是为了编排的方便。
每一纵行就是一个族。
从左至右,第一、二纵行和第十三至十八纵行为主族元素,分别用ⅠA─ⅧA表示,ⅧA又称为零族;第三至第十二纵行为副族元素,分别用ⅠB─ⅧB表示,其中第八、九、十这三个纵行合称ⅧB族。
随着对原子结构的认识不断深入,人们发现元素周期表与原子核外电子的分布有着直接的关系。
例如元素在周期表中的周期数、族数以及周期表的分区等都是由核外电子的分布所决定的。
各元素在周期表中的周期数等于该元素原子的最大主量子数即电子层数。
例如He原子,其电子组态为ls2,原子轨道的最大主量子数也就是电子层数,为l。