2重要金属化合物的性质及其应用
- 格式:docx
- 大小:503.30 KB
- 文档页数:8


课题2 金属的化学性质在课题1介绍金属的物理性质的基础上,本课题重点介绍金属的化学性质:①金属与氧气反应;②金属活动性顺序。
在氧气的化学性质的学习中,已做过镁带、铝箔、铁丝等在氧气中反应的实验,基于学生已有的基础知识,教材采用实验事实——归纳的编写方法,重点说明大多数金属都能与氧气反应,但反应的难易和剧烈程度不同,这在一定程度上反映金属的活泼程度。
教材的重点放在对金属活动性顺序的探究上,采用实验——讨论的探究模式,通过对实验事实的分析,归纳得出置换反应的特点,并通过对某些金属活动性的比较,进而导出金属活动性顺序。
通过练习,使学生能应用置换反应和金属活动性顺序解释一些日常生活有关的化学问题。
第1课时金属与氧气、酸的反应【教学目标】1.知识与技能(1) 知道Fe、Al、Cu等常见金属与氧气反应。
(2) 初步认识常见金属与盐酸、稀硫酸的置换反应。
2.过程与方法(1) 认识科学探究的基本过程,能进行初步的探究活动。
(2) 初步学会运用观察、实验等方法获取信息,并能用图表和化学语言表达有关信息。
(3)初步学会运用比较、归纳、概括等方法对获取的信息进行加工。
3.情感态度与价值观(1) 培养勤于思考、严谨求实、勇于实践的科学精神。
(2) 关注化学与日常生活及生产的密切关系。
【教学重点】1.金属的化学性质。
2.对置换反应的理解。
【教学难点】金属的活动性。
【教具准备】试管(若干)、铁片、铝片、镁片、铜片、稀盐酸、稀硫酸、小木条、砂纸、试管(若干)等。
【问题情景】黄铜和黄金的外观很相似,我们可以用什么方法来鉴别它们呢?请同学讨论分析是否能用上节课知识来解决这一问题。
【交流回答】1.可利用密度不同测量它们的密度即可区别。
2.可利用硬度不同,把它们相互刻画,硬度大的为黄铜,小的为黄金。
【导入新课】同学们找出了一些合理的鉴别方法,但是都是利用金属的物理性质,那么我们能否利用金属的化学性质进行鉴别呢?要想更好地使用金属,就需要了解金属的各种性质,上节课我们学习了金属的物理性质,本节课我们来学习金属的化学性质吧!【复习回忆】金属与氧气反应1.常温下能反应:镁、铝2. 点燃或加热条件下能反应:Fe、Cu3.高温下也不能反应:金、银【提出问题】为什么金属与氧气反应中存在能否反应,及反应剧烈程度不同的差异呢?【交流回答】金属与氧气反应的剧烈程度与金属的活泼程度有关(即金属活动性)。


金属活动性顺序的规律及应用1. 在金属活动性顺序表里,金属的位置越靠前,它的活动性就越强。
2. 在金属活动性顺序表里,位于氢前的金属能置换出稀盐酸、稀硫酸中的氢,位于氢后的金属则不能。
3. 在金属活动性顺序表里,位于前面的金属能把位于后面的金属从他们化合物的溶液里置换出来。
注:①置换时如有铁参与,铁在生成的化合物中显+2价,例②很活泼的金属(如K、Ca、Na)与盐溶液反应时,金属先与溶液中的水反应生成碱,碱再与盐溶液反应,一般不会生成金属。
例:钠投入硫酸铜溶液中发生的化学反应为:,③若盐溶液中含有许多溶质,而某金属又能同时置换此盐溶液中的多种金属时,按金属的活动性由弱到强依次置换。
例:当把铁投入到含有溶质AgNO3和的溶液中时,由于银的金属活动性比铜弱,因此铁先置换银,把银置换完后再置换铜。
考点1:判断金属是否能与酸溶液或盐溶液发生反应判断下列物质之间能否发生反应,不能发生反应的说明原因,发生反应的写出化学方程式。
(1)铁和稀硫酸_________________________(2)铜和稀盐酸_________________________(3)铜和氯化锌溶液_________________________(4)铁和氯化铜溶液_________________________答案:(1);(2)由于在金属活动性顺序表中,铜位于氢的后面,因此,铜不能与稀硫酸反应。
(3)由于在金属活动性顺序表中,铜位于锌的后面,因此铜不能和氯化锌反应。
(4)。
考点 2. 根据几种不同金属与酸溶液、盐溶液反应的现象,判断金属的活动顺序例:现有X、Y、Z三种金属,只有X能与稀硫酸反应产生氢气,Y、Z则不能,但有下列反应关系:,则X、Y、Z三种金属的活动性顺序由强到弱的是()A. Z>Y>XB. X>Z>YC. X>Y>ZD. Z>X>Y解析:只有金属X能与稀硫酸反应,说明只有金属X的活动性位于氢前。

化学高二金属的性质及其应用知识点
1、Al易拉罐的主要成分
(1)与氧气常温下生成氧化膜抗腐蚀能力
(2)与CuSO4反应2Al+3CuSO4==Al2(SO4)3+3Cu
(3)与碱反应2Al+2NaOH+2H2O==NaAlO2+3H2↑
(4)常温下与浓硫酸或浓硝酸钝化
二、合金
1、定义:将两种或多种金属(或金属与非金属)熔合而成的具有金属活性的物质
2、具有较好的物理化学性能
纯铝和纯铁质地软,强度小无法制造承载负荷的结构零件
三、金属腐蚀
1、化学腐蚀:金属跟接触到的物质直接发生化学反应而引起的腐蚀
2、电化学腐蚀:不纯的金属或合金与电解质溶液接触,会发生原电池反应,比较活泼的金属失电子被氧化的腐蚀
3、Fe-2e-→Fe2+→Fe(OH)2→Fe(OH)3→Fe2O3?XH2O
4、金属防护的几种重要方法
①在金属表面覆盖保护层。
(烤蓝、油漆等)
②改变金属内部的组织结构,制成合金。
(不锈钢)
③电化学保护法,即将金属作为原电池的正极或与电源负极相连。
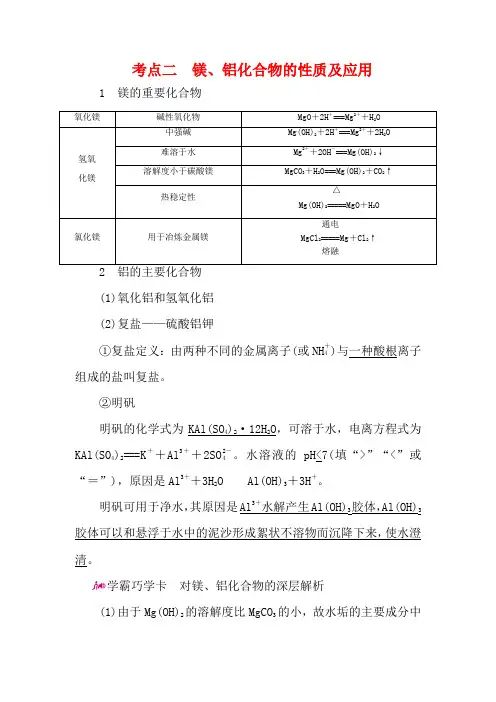
考点二 镁、铝化合物的性质及应用1 镁的重要化合物 氧化镁 碱性氧化物 MgO +2H +===Mg 2++H 2O 氢氧化镁 中强碱Mg(OH)2+2H +===Mg 2++2H 2O 难溶于水 Mg 2++2OH -===Mg(OH)2↓ 溶解度小于碳酸镁MgCO 3+H 2O===Mg(OH)2+CO 2↑ 热稳定性 Mg(OH)2=====△MgO +H 2O氯化镁 用于冶炼金属镁 MgCl 2=====通电熔融Mg +Cl 2↑2 铝的主要化合物(1)氧化铝和氢氧化铝(2)复盐——硫酸铝钾①复盐定义:由两种不同的金属离子(或NH +4)与一种酸根离子组成的盐叫复盐。
②明矾明矾的化学式为KAl(SO 4)2·12H 2O ,可溶于水,电离方程式为KAl(SO 4)2===K ++Al 3++2SO 2-4。
水溶液的pH<7(填“>”“<”或“=”),原因是Al 3++3H 2O Al(OH)3+3H +。
明矾可用于净水,其原因是Al 3+水解产生Al(OH)3胶体,Al(OH)3胶体可以和悬浮于水中的泥沙形成絮状不溶物而沉降下来,使水澄清。
学霸巧学卡 对镁、铝化合物的深层解析(1)由于Mg(OH)2的溶解度比MgCO 3的小,故水垢的主要成分中是Mg(OH)2,而非MgCO3。
(2)Al2O3、Al(OH)3只与强酸、强碱溶液反应,与氨水和碳酸溶液不反应。
(3)Al3+只能存在于酸性溶液中,AlO-2只能存在于碱性溶液中。
若将分别含Al3+和AlO-2的盐溶液混合,发生反应:Al3++3AlO-2+6H2O===4Al(OH)3↓。
(4)Al2O3、Al(OH)3是中学阶段接触的唯一与碱反应的金属氧化物和氢氧化物,经常应用到除杂、计算题中,所以一定要熟记这两个反应的离子方程式。
(5)明矾净水只能除去水中的悬浮杂质,不能杀菌消毒,与氯气消毒原理不同。
1.思维辨析(1)在加热情况下利用氢气还原氧化铝的方法得到金属铝。

二价钯空间结构-概述说明以及解释1.引言1.1 概述二价钯是指钯的+2氧化态,是一种重要的过渡金属元素。
它具有许多独特的特性和化学性质,使其在催化领域具有广泛的应用。
本文旨在探讨二价钯的空间结构及其在催化领域的应用。
通过深入研究二价钯的特性和化学性质,探讨其在催化反应中的作用机制和影响因素,以及展望未来二价钯在催化领域的发展前景。
1.2 文章结构本文主要分为三个部分进行阐述:引言、正文和结论。
在引言部分,我们将对二价钯进行概述,介绍其基本特性和化学性质,同时明确本文的目的,为读者提供一个整体的了解和认识。
在正文部分中,将详细讨论二价钯的特性、化学性质以及在催化领域的应用。
通过对这些方面的探讨,读者可以更深入地了解二价钯的重要性及其在不同领域的应用情况。
最后,在结论部分,我们将对本文所述内容进行总结,强调二价钯的重要性,并展望其在未来的发展趋势。
同时,我们也将就本文所述内容进行简要的结论,为读者提供一个完整的思考和观点。
整体上,通过这个清晰的文章结构,我们希望能够为读者呈现一个系统且全面的二价钯空间结构的概念。
1.3 目的本文旨在深入探讨二价钯的空间结构特性,并分析其在催化领域中的重要应用。
通过对二价钯的特性、化学性质以及应用进行全面的介绍和分析,旨在进一步加深对二价钯的理解,促进相关领域的研究和应用,推动其在未来的发展。
同时,通过对二价钯空间结构的研究,也可以为设计和开发更高效的催化剂提供重要的参考和指导,为绿色、高效的化学合成和工业生产做出贡献。
2.正文2.1 二价钯的特性二价钯是钯的一种氧化态,具有许多独特的特性。
首先,二价钯是一种具有高度稳定性的化合物,具有良好的热稳定性和化学稳定性。
其次,二价钯在常温下呈固体形态,具有金属光泽。
另外,二价钯的电子结构特性使其在催化反应中具有良好的活性和选择性。
此外,二价钯还具有较高的熔点和热导率,使其在高温环境下表现出色。
总的来说,二价钯具有独特的物理和化学性质,使其在许多领域具有广泛的应用前景。

第2讲 铁及其重要化合物[课程标准]1.结合真实情境中的应用实例或通过实验探究,了解铁及其重要化合物的主要性质,了解这些物质在生产、生活中的应用。
2.结合实例认识铁及其化合物的多样性,了解通过化学反应可以探索物质性质、实现物质转化,认识物质及其转化在促进社会文明进步、自然资源综合利用和环境保护中的重要价值。
考点一 铁的单质、氧化物和氢氧化物1.铁的单质(1)原子结构铁位于元素周期表第四周期第Ⅷ族,原子结构示意图为,化学反应中易失去2个或3个电子而表现为+2价或+3价。
铁在地壳中的含量居第四位。
(2)物理性质纯铁具有银白色的金属光泽和良好的延展性,是电和热的良导体,具有能被磁体吸引的特性;纯铁有很强的抗腐蚀能力。
(3)化学性质铁元素性质活泼,有较强的还原性,主要化合价为+2价和+3价。
①Fe 与Cl 2、S 反应的化学方程式:2Fe +3Cl 2=====△2FeCl 3;Fe +S=====△FeS 。
②Fe 与水蒸气反应的化学方程式:3Fe +4H 2O(g)=====高温Fe 3O 4+4H 2。
③Fe 与氧化性酸(如HNO 3)的反应(写离子方程式,下同)Fe 与过量稀HNO 3的反应:Fe +NO -3+4H +===Fe 3++NO↑+2H 2O ;F e 与少量稀HNO 3的反应:3Fe +2NO -3+8H +===3Fe 2++2NO↑+4H 2O 。
④Fe 与FeCl 3溶液的反应:Fe +2Fe 3+===3Fe 2+。
[点拨] ①铁分别与氯气和盐酸反应所得的产物中铁元素的价态不同,Fe 与Cl 2反应无论用量多少都生成FeCl 3,而Fe 与盐酸反应生成FeCl 2。
②铁在潮湿的空气中生成的铁锈的主要成分是Fe 2O 3,而铁在纯氧中燃烧的产物是Fe 3O 4。
2.铁的氧化物(1)物理性质 化学式 FeO Fe 2O 3 Fe 3O 4 俗称— 铁红 磁性氧化铁 色、态黑色粉末 红棕色粉末 黑色晶体 铁的价态+2价 +3价 +2价、+3价 (2)化学性质①FeO、Fe 2O 3、Fe 3O 4分别与盐酸反应的离子方程式:FeO +2H +===Fe 2++H 2O ;Fe 2O 3+6H +===2Fe 3++3H 2O ;Fe 3O 4+8H +===2Fe 3++Fe 2++4H 2O 。


第2讲 铝及其重要化合物[考纲要求] 理解铝及其重要化合物的主要性质和应用。
1.铝的结构和存有铝位于元素周期表第三周期ⅢA 族,原子结构示意图为。
铝元素在地壳中含量丰富,仅次于硅。
自然界中的铝全部以化合态存有。
2.金属铝的物理性质银白色有金属光泽的固体,有良好的延展性、导电性和传热性等,密度较小,质地柔软。
3.金属铝的化学性质写出图中相关反应的化学方程式或离子方程式:①Al O2⎪⎪⎪⎪――→ 常温 形成致密的氧化膜――→ 点燃 4Al +3O2=====点燃2Al2O3②2Al +3Cl2=====点燃2AlCl3 ③Al 酸⎪⎪⎪⎪――→氧化性酸遇冷的浓硫酸或浓硝酸钝化――→非氧化性酸2Al +6HCl===2AlCl3+3H2↑④2Al +2NaOH +2H2O===2NaAlO2+3H2↑⑤2Al +Fe2O3=====高温Al2O3+2Fe(铝热反应)4铝 镁 与非金属反应能被Cl2、O2氧化 2Mg +O2=====点燃2MgO 3Mg +N2=====点燃Mg3N2 与水反应 反应很困难 能与沸水反应Mg +2H2O=====△Mg(OH)2+H2↑与碱反应能溶于强碱溶液 不反应 与某些氧化物反应 能与Fe2O3、MnO2、Cr2O3等金属氧化物发生铝热反应 能在CO2中燃烧:2Mg +CO2=====点燃2MgO +C5.铝的用途纯铝用作导线,铝合金用于制造汽车、飞机、生活用品等。
深度思考1.铝的化学性质活泼,为什么日常生活中广泛使用的铝制品通常具有较好的抗腐蚀性能? 答案 铝在常温下迅速被氧气氧化,形成一层致密的氧化膜,保护铝不再被氧化,因而铝制品通常具有较强的抗腐蚀性能。
2.金属铝是活泼的金属,能与酸反应,为什么能用铝槽储运浓H2SO4或浓HNO3?答案 常温下浓H2SO4、浓HNO3能使铝钝化(在表面形成一层致密的氧化膜),阻止反应继续实行。
3.实验室能否用硫化物与铝盐溶液混合制取Al2S3?用离子方程式说明原因。

第10讲 镁、铝及其重要化合物考点一 镁、铝单质的性质与应用[知识梳理]一、镁及其重要化合物的性质与应用1.镁的性质(1)物理性质:银白色、具有金属光泽的固体,密度、硬度均较小,熔点较低,有良好的导电性、导热性和延展性。
(2)化学性质①与N 2反应:3Mg +N 2=====点燃Mg 3N 2;②与CO 2反应:2Mg +CO 2=====点燃2MgO +C ;③与热水反应:Mg +2H 2O=====△Mg(OH)2+H 2↑;④与稀硫酸反应:Mg +H 2SO 4===MgSO 4+H 2↑。
Mg 在CO 2中能燃烧,所以Mg 着火时不能用二氧化碳灭火器和泡沫灭火器灭火。
2.海水提镁从MgCl2溶液中得到无水MgCl2固体需要两步。
第一步:将MgCl2溶液用浓盐酸酸化,经蒸发浓缩、冷却结晶、过滤后得到MgCl2·6H2O;第二步:在干燥的HCl气流中加热MgCl2·6H2O晶体使其脱水得到无水MgCl2。
3.镁的用途生产合金,冶金工业上用作还原剂和脱氧剂。
4.镁的重要化合物物质主要性质及反应方程式氧化镁碱性氧化物MgO+2H+===Mg2++H2O氢氧化镁中强碱Mg(OH)2+2H+===Mg2++2H2O溶解度小于碳酸镁MgCO3+H2O=====△Mg(OH)2+CO2↑氮化镁盐Mg3N2+6H2O=== 3Mg(OH)2+2NH3↑二、铝单质的性质与应用1.铝的结构和存在形式(1)铝位于元素周期表的第三周期ⅢA族,原子结构示意图为(2)铝是地壳中含量最多的金属元素,自然界中的铝全部以化合态的形式存在。
2.铝的物理性质铝是银白色、具有金属光泽的固体,硬度较小,具有良好的导电性、导热性和延展性。
3.铝的化学性质根据上图写出以下序号对应的有关反应的方程式(能写离子方程式的写离子方程式):4.铝的用途纯铝可用作导线,铝合金可用于制造汽车、飞机、生活用品等。
[自主检测]1.判断正误(正确的打“√”,错误的打“×”)。
专题2-2主族金属-铍及其化合物(解析版)铍(Be)是主族金属中的一个成员,具有轻巧、硬度高、熔点低、导热性能好等特点,因此在多个领域中都有广泛的应用。
本文将对铍及其化合物进行详细的解析,从组成、性质、应用等方面展开探讨。
第一部分:铍的基本介绍铍是一种较为稀有的元素,在自然界中很少以纯态形式存在,主要以铍矿石的形式存在于大理石、硅酸盐矿物等中。
铍具有灰白色,外观类似于铝的金属,具有良好的导电性和导热性。
它是一种轻巧的金属,密度约为1.85克/立方厘米,熔点约为1287摄氏度,同时也具有很高的硬度。
第二部分:铍的性质及反应铍具有一系列独特的性质和反应。
首先,铍是一种相对稳定的金属,可以与氧气反应形成氧化铍(BeO)。
氧化铍是一种白色结晶固体,具有高熔点、高热稳定性和优异的绝缘性能,在电子行业中具有重要应用。
此外,铍还可以与非金属元素如氮、硫等反应,形成各种化合物,如硝酸铍(Be(NO3)2)和硫酸铍(BeSO4)等。
这些化合物在化工工业中有广泛的用途。
第三部分:铍的应用领域由于铍具有独特的性质和良好的机械特性,因此在多个领域中得到了广泛的应用。
首先,铍在航天航空领域中具有重要地位。
铍具有轻巧、硬度高的特点,可用于制造卫星和航天飞机的结构件、液体火箭发动机的喷嘴等。
其次,铍具有良好的导热性能,被广泛应用于电子工业中的散热器、传热板等产品中。
另外,铍还可以用于制造反应堆中的中子反射材料,以及医疗领域中的X射线窗口等。
第四部分:铍化合物的应用除了铍本身的应用外,铍化合物也具有一定的应用价值。
例如,氧化铍广泛应用于陶瓷工业中,用于制造陶瓷材料、陶瓷触媒等;硝酸铍则用作玻璃工业中的增亮剂和着色剂;硫酸铍可用于制造染料、涂料等领域;氯化铍用作金属表面处理和电镀工艺中的添加剂等。
这些铍化合物在不同领域中发挥着重要的作用。
总结:本文对铍及其化合物进行了全面的解析。
铍是一种稀有的主族金属,具有轻巧、硬度高、导热性能好等优点。
蒽醌-2-羧酸金属全文共四篇示例,供读者参考第一篇示例:蒽醌-2-羧酸金属是一种重要的有机金属化合物,具有广泛的应用价值。
它通常用于有机合成、药物与材料科学领域。
本文将从蒽醌-2-羧酸金属的结构、性质、合成方法以及应用领域等方面进行详细介绍。
蒽醌-2-羧酸金属分子的结构由蒽醌-2-羧酸分子与金属离子构成,金属离子通常为过渡金属如镍、铁、铂等,通过金属与蒽醌-2-羧酸分子之间的配位键形成。
在这种结构中,金属离子起到了催化剂或者配体的作用,使蒽醌-2-羧酸金属具有特殊的化学性质。
蒽醌-2-羧酸金属具有多种重要的性质,例如其在有机合成中可以作为催化剂参与复杂有机分子的合成反应。
蒽醌-2-羧酸金属还具有优异的电化学性能,可以应用于电化学传感器、电池等领域。
蒽醌-2-羧酸金属还具有一定的发光性能,可用于有机发光二极管(OLED)的制备等方面。
蒽醌-2-羧酸金属的合成方法多种多样,通常可以通过有机合成化学方法将蒽醌-2-羧酸与金属离子进行配位反应得到。
比较常用的合成方法包括金属离子溶液法、固态反应法、溶剂热法等。
在合成过程中,除了金属离子的选择外,反应条件与溶剂的选择也会对产物的结构和性质产生影响。
蒽醌-2-羧酸金属在各个领域的应用也非常广泛。
在有机合成中,它可以作为催化剂参与复杂分子的合成反应,提高反应效率和产物纯度。
在材料科学领域,蒽醌-2-羧酸金属可以作为电化学传感器,检测环境中的有害物质。
它还可以用作材料的表面修饰剂,提高材料的稳定性与附着力。
蒽醌-2-羧酸金属是一种具有重要应用潜力的有机金属化合物,其结构特殊、性质独特、合成方法多样、应用领域广泛。
在未来的研究中,我们可以进一步深入探讨其在不同领域的应用,并开发出更加高效、环保的合成方法,推动其在科学研究和工业生产中的应用。
【2000字】第二篇示例:蒽醌-2-羧酸金属是一种重要的有机金属化合物,具有广泛的应用价值。
蒽醌-2-羧酸是一种蒽醌衍生物,通过将羧基引入蒽醌分子中得到。
三氯化铝和三甲基铝-概述说明以及解释1.引言1.1 概述3.1概述在化学领域中,三氯化铝(AlCl3)和三甲基铝(AlMe3)是两种常见的化合物。
它们都是铝的有机化合物,具有重要的应用价值和广泛的应用领域。
三氯化铝是一种无机化合物,具有多样的物理和化学性质,广泛用于有机合成反应和催化反应的催化剂。
而三甲基铝是一种有机金属化合物,具有较为特殊的性质和应用,常用于有机合成中的活性中间体或催化剂。
三氯化铝具有无色的晶体形态,在室温下呈固体或液体状态。
它具有较高的熔点和沸点,并且能够吸湿和固化空气中的水分。
化学性质上,三氯化铝是一种强酸性物质,能够与水反应生成盐酸,并能与许多有机物发生氯化反应。
因其具有良好的催化活性,三氯化铝广泛应用于合成香料、染料和医药等有机化合物的合成过程中。
三甲基铝是一种无色液体,在常温下呈液体状态。
它具有挥发性和易燃性,常以液体状态保存。
物理性质上,三甲基铝具有较低的沸点,且易被氧气氧化。
化学性质上,三甲基铝是一种强还原剂,与氧气在空气中剧烈反应,并能与许多有机物发生加成反应。
由于其特殊的反应性质,三甲基铝广泛应用于有机合成中的不饱和化合物反应和催化反应,并常用作催化剂的前体或活性中间体。
综上所述,三氯化铝和三甲基铝都是重要的有机金属化合物,在化工领域具有广泛的应用。
它们的物理性质和化学性质的差异使它们在有机合成反应中发挥不同的作用。
通过对它们的正文部分的详细论述,将更好地了解它们的各个方面特性以及在化学合成中的应用前景。
1.2文章结构1.2 文章结构本文将对三氯化铝和三甲基铝两种化合物进行详细介绍和比较。
文章结构如下:第2节正文:2.1 三氯化铝:2.1.1 物理性质:在本小节中,我们将详细探讨三氯化铝的物理性质,包括其外观、密度、熔点和沸点等方面的特征。
2.1.2 化学性质:在本小节中,我们将详细探讨三氯化铝的化学性质,包括其与其他化合物的反应和它作为催化剂的应用等方面。
2.2 三甲基铝:2.2.1 物理性质:在本小节中,我们将详细探讨三甲基铝的物理性质,包括其外观、密度、熔点和沸点等方面的特征。
二氰合银酸钾,化学式KAg(CN)2,是一种重要的化合物,具有许多重要的化学性质。
它在配位化学和无机化学领域中有着广泛的应用,对于理解金属离子和配体之间的相互作用具有重要的意义。
本文将从中心离子电荷的角度来探讨二氰合银酸钾的化学性质及其意义。
1. 化学式KAg(CN)2KAg(CN)2的化学式中包括钾离子(K+)和氰根离子(CN-)。
钾离子是一种阳离子,具有+1的电荷,而氰根离子则是一种阴离子,也就是说,它带有-1的电荷。
而银离子(Ag+)在该化合物中扮演着中心离子的角色,它与两个氰根离子发生配位键的形成,从而形成了KAg(CN)2这一化合物。
2. 中心离子电荷银离子(Ag+)在KAg(CN)2中是中心离子,它具有+1的电荷。
这个电荷使得银离子成为了KAg(CN)2中的化学活性中心,具有较高的反应活性。
由于银离子是一种过渡金属离子,它具有较高的亲电性和配位性,能够与氰根离子等配体形成稳定的配位化合物。
银离子的电荷也影响了KAg(CN)2的物理性质,如其溶解度、晶体结构等。
3. 化学性质KAg(CN)2具有较强的氧化还原性,可以被还原为银(Ag)金属。
在一定的条件下,KAg(CN)2可以和还原剂发生反应,从而生成纯银。
这一性质使得KAg(CN)2在化工工业中具有重要的应用,例如在银镜反应中,KAg(CN)2可以被还原成银镜。
另外,KAg(CN)2也具有较强的配位性,可以和其他金属离子形成配合物,用作催化剂、稳定剂等。
4. 应用意义KAg(CN)2在化学、医药、材料等领域具有广泛的应用意义。
在化学分析中,KAg(CN)2可以用于检测铜离子、汞离子等金属离子。
在医药领域,KAg(CN)2可以用作抗菌剂、消毒剂等。
在材料领域,KAg(CN)2可以用于制备纯银、光敏材料等。
KAg(CN)2在现代化学中具有重要的地位,对于推动化学科学的发展具有重要的意义。
总结KAg(CN)2是一种重要的化合物,其化学式为KAg(CN)2,其中包括钾离子、银离子和氰根离子。
2重要金属化合物的性质及其应用1.重要的金属化合物2.Na2CO3与NaHCO3的区别方法方法一:与强酸反应。
在两个试管中放入等量的两种固体,同时加入等量的同一盐酸溶液,放气体快者为NaHCO3。
方法二:加热法。
对固体进行加热,把产生的气体通入澄清石灰水,变浑浊者为NaHCO3。
方法三:沉淀法。
在两种溶液中,加入BaCl2(或CaCl2)溶液,有沉淀生成者为Na2CO3。
【典例2】现有两瓶无标签的无色溶液,分别装有Na2CO3和NaHCO3,用下列试剂或方法能将两者区分的是( )①Ca(OH)2②盐酸③CaCl2④NaOH⑤加热A.①③ B.①④ C.②③ D.②⑤解析①④都是碱,可以使Na2CO3、NaHCO3中都含有CO2-3,结果现象一样(①都有沉淀、④都无沉淀),所以①④不能区分。
②使二者放出CO2的速度不同,可以区分。
③使Na2CO3有沉淀,而NaHCO3无沉淀,可以区分。
⑤加热法,因二者都是溶液,加热都不分解,无法区分。
答案C3.Al3+、Al(OH)3、AlO-2的转化及其图像(1)Al3+―→Al(OH)3①可溶性铝盐与少量NaOH溶液反应:Al3++3OH-(少量)===Al(OH)3↓②可溶性铝盐与氨水反应:Al3++3NH3·H2O===Al(OH)3↓+3NH+4(2)Al(OH)3―→Al3+Al(OH)3溶于强酸溶液:Al(OH)3+3H+===Al3++3H2O(3)Al3+―→AlO-2可溶性铝盐与过量的强碱反应:Al3++4OH-(过量)===AlO-2+2H2O(4)AlO-2―→Al3+偏铝酸盐溶液与足量的盐酸反应:AlO-2+4H+===Al3++2H2O(5)AlO-2―→Al(OH)3①偏铝酸盐溶液中加入少量盐酸:AlO-2+H+(少量)+H2O===Al(OH)3↓②偏铝酸盐溶液中通入CO2:AlO-2+CO2(过量)+2H2O===Al(OH)3↓+HCO-3 (6)Al(OH)3―→AlO-2Al(OH)3溶于强碱溶液:Al(OH)3+OH-===AlO-2+2H2O4.氢氧化铝图像解析方法(1)向AlCl3溶液中滴加NaOH溶液至过量发生反应的离子方程式为OA段:Al3++3OH-===Al(OH)3↓AB段:Al(OH)3+OH-===AlO-2+2H2O从图中不难看出,向氯化铝溶液中滴加氢氧化钠溶液,若达不到最大沉淀量时,对应的氢氧化钠溶液的体积有两种情况:一是氯化铝过量即加入的氢氧化钠不足;二是加入的氢氧化钠将生成的氢氧化铝溶解了一部分。
(2)向铝盐溶液中滴入氨水或向氨水中滴加铝盐溶液由于氢氧化铝只能与酸或强碱反应,氨水是一种弱碱,所以氢氧化铝不会溶解在氨水中,则向铝盐溶液中滴入氨水或向氨水中滴加铝盐溶液,反应现象是相同的。
若向铝盐中滴加氨水,离子反应方程式为3NH3·H2O+Al3+===Al(OH)3↓+3NH+4当氨水增加到n(Al3+)∶n(NH3·H2O)=1∶3时,产生最大沉淀量。
(3)向偏铝酸盐溶液中滴入强酸发生反应的离子方程式为OA段:AlO-2+H++H2O===Al(OH)3↓AB段:Al(OH)3+3H+===Al3++3H2O当n(AlO-2)∶n(H+)=1∶1时,产生最大沉淀量,继续滴入强酸,沉淀逐渐溶解。
(4)向NaAlO2溶液中通入CO2由于碳酸的酸性大于氢氧化铝,所以偏铝酸钠能与二氧化碳反应,生成氢氧化铝,产生的Al(OH)3沉淀不溶解在碳酸中,所以产生的沉淀不消失。
(5)向AlCl 3、MgCl2的酸性溶液中滴加NaOH溶液反应的离子方程式依次为H++OH-===H2O Mg2++2OH-===Mg(OH)2↓AlCl3+3OH-===Al(OH)3↓Al(OH)3+OH-===AlO-2+2H2O出现的现象是先产生沉淀,到沉淀最大值,继续滴加NaOH,沉淀部分溶解,最后剩余的为氢氧化镁沉淀,消失的是氢氧化铝沉淀。
【典例3】某溶液中可能含有H+、Na+、NH+4、Mg2+、Fe3+、Al3+、SO2-4等离子,已知①该溶液的焰色反应没有黄色;②当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示。
由此可知:(1)该溶液中肯定含有的离子是___________________________________________________;各离子的物质的量之比为____________________________________________________。
(2)肯定不含的阳离子是________________________________________________________。
解析由图可判断出最初两份NaOH是与H+反应,溶液中无Mg2+、Fe3+,因为最后无沉淀。
从图形的“先三份碱使其沉淀、后一份碱使其溶解”可以确定有Al3+。
关键是寻找与OH-反应、而又使沉淀量不变化的离子,从题给离子中可以找出是NH+4。
在H+、Al3+、NH+4共存时,加入OH-,与OH-反应的前后顺序是H+、Al3+、NH+4。
原因是电解质的强弱是H2O<Al(OH)3<NH3·H2O,最弱者先形成,三者的强弱可以从下面三个反应来证明:Al3++3NH3·H2O===Al(OH)3↓+3NH+4 [证明Al(OH)3比氨水弱]Al(OH)3+3H+===Al3++3H2O[证明H2O比Al(OH)3弱]待溶液中成为Al(OH)3、NH3·H2O时,再加入OH-,才能溶解Al(OH)3。
这是因为Al(OH)3与弱碱不反应,只有在强碱性时才溶解。
该题还有个陷阱就是易把SO2-4当作是不能确定的。
由于溶液是电中性的,必须有阴离子,所以SO2-4一定存在。
n(H+)∶n(NH+4)∶n(Al3+)∶n(SO2-4)=2∶3∶1∶n(SO2-4),再利用电荷守恒:n (H +)+n (NH +4)+3n (Al3+)=2n (SO 2-4) 即:2+3+3×1=2n (SO 2-4) 得n (SO 2-4)=4。
答案 (1)H +、NH +4、Al 3+、SO 2-4 n (H +)∶n (NH +4)∶n (Al 3+)∶n (SO 2-4)=2∶3∶1∶4 (2)Na +、Mg 2+、Fe 3+5.铁及其化合物之间的转化——“铁三角”从Fe 、Fe 2+和Fe 3+的结构可知:Fe 只有还原性,Fe 3+通常只有氧化性,Fe 2+既具有氧化性又具有还原性。
上述微粒通过跟一定的氧化剂或还原剂发生氧化还原反应,才能实现不同价态铁的相互转化,我们把这个相互转化设计成三角形,常称为铁三角。
(1)Fe 、Fe 2+、Fe 3+之间的转化 ①Fe 3+的形成由于Fe 3+的氧化性较强,要想生成Fe 3+,得需要强氧化剂,通常有:Cl 2、Br 2、HNO 3、浓H 2SO 4、KMnO 4(H +)。
与Cl 2:2Fe 2++Cl 2===2Fe 3++2Cl -2Fe +3Cl 2=====点燃2FeCl 3与KMnO 4:5Fe 2++MnO -4+8H +===5Fe 3++Mn 2++4H 2O②F 0e 的形成单质Fe 的还原性较强,要想生成单质Fe ,得需强还原剂,通常有:Al 、Zn 、CO 、H 2。
Fe 2++Zn===Fe +Zn 2+FeO +Al(CO 、H 2)――→高温Fe +Al 2O 3(CO 2、H 2O) Fe 2O 3+Al(CO 、H 2)――→高温Fe +Al 2O 3(CO 2、H 2O)③Fe 2+的形成Fe 2+的氧化性、还原性都不强,所以,从Fe→Fe 2+,弱氧化剂即可,通常有:S 、H +、Cu 2+、Fe 3+;从Fe 3+→Fe 2+,能被Fe 3+氧化的还原剂有:Fe 、Cu 、I -、S 2-、HS -、SO 2、SO 2-3。
e→Fe 2+Fe +2H +===Fe 2++H 2↑Fe +Cu 2+===Fe 2++Cu(湿法炼铜) Fe +S=====△FeSB .Fe 3+→Fe 2+:2Fe 3++Fe===3Fe 2+(据此反应,用Fe 可除去Fe 2+溶液中的Fe 3+;在FeSO 4溶液中,常放少量铁粉,就是为了防止FeSO 4被氧化)2Fe 3++Cu===2Fe 2++Cu 2+(据此反应,可用FeCl 3溶液腐蚀Cu 来制线路板:把一铜板粘在塑料板上,用油漆画出线路图,然后浸在FeCl 3溶液中,Cu 被FeCl 3腐蚀,而用漆画过的线条留了下来,这就成了线路)。
(2)Fe 3+、Fe 2+的检验【典例4】过去电子工业常用30%的FeCl3溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板,发生反应的化学方程式为2FeCl3+Cu===2FeCl2+CuCl2。
(1)检验腐蚀后的溶液中是否含有Fe3+应选用的试剂是________。
(2)为了从使用过的废腐蚀液中回收铜,并重新制得纯净的FeCl3溶液,可采用下列实验步骤,请在各空格内填上适当的物质以使实验达到预期目的。
(3)写出有关化学反应的离子方程式:①________________________________________________________________________;③________________________________________________________________________;⑤________________________________________________________________________。
解析(1)Fe3+与SCN-反应,生成的Fe(SCN)3呈红色。
(2)先要审清题意,目的有两个:“回收铜,并重新制得纯净的FeCl3溶液。
”由题中给出的反应可知,废腐蚀液中含有FeCl3、FeCl2和CuCl2,回收铜可利用Fe与CuCl2的置换反应来完成,①步要加入过量Fe粉,发生反应:2Fe3++Fe===3Fe2+、Fe+CuCl2===FeCl2+Cu,所以A为FeCl2,B为Fe和Cu。
除去Cu中的Fe可加盐酸,Cu不溶于盐酸,Fe与盐酸反应生成FeCl2和H2。
Ⅰ、Ⅱ两过程得到的FeCl2汇集在一起被Cl2氧化:2FeCl2+Cl2===2FeCl3。
答案(1)KSCN溶液(或其他含SCN-的盐溶液)(2)①Fe③盐酸⑤Cl2A.FeCl2B.Fe、Cu C.Cu(3)①2Fe3++Fe===3Fe2+、Fe+Cu2+===Fe2++Cu③Fe+2H+===Fe2++H2↑⑤2Fe2++Cl2===2Fe3++2Cl-理解感悟铁元素及其化合物的推断题的解题关键:一是寻找特征反应及特征现象,二是正确运用“铁三角”的转化关系,三是注意与其他金属及其化合物知识的综合。