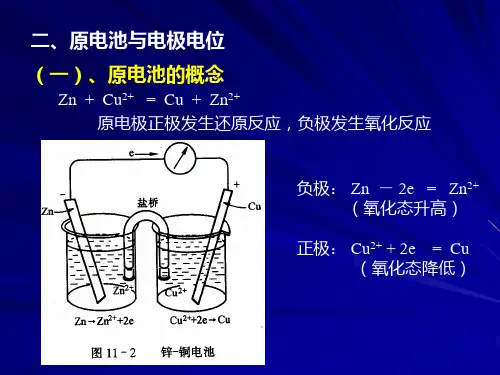
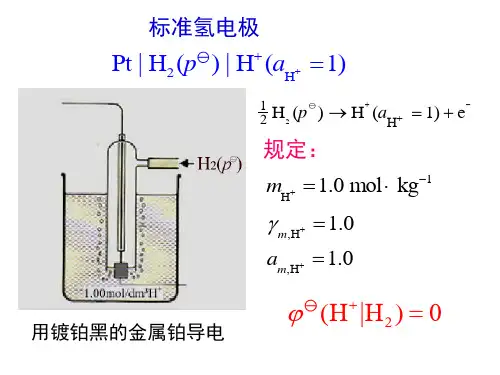
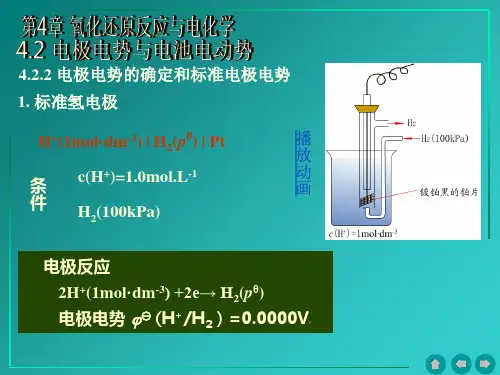
原电池第三节电极电势和原电池的电动势第四节电极电势
- 格式:ppt
- 大小:916.00 KB
- 文档页数:50


化学反应中的电极电势与电池电动势化学反应是一种涉及原子和分子之间重组的过程,而电池则是利用化学反应产生电能的装置。
电极电势和电池电动势是描述电化学反应中电子转移能力的重要参数。
本文将介绍电极电势和电池电动势的概念、影响因素以及它们之间的关系。
一、电极电势的概念与测量电极电势是指电极与溶液或气体之间的电势差。
在电化学反应中,电极上电子的转移产生电势差,进而影响反应的进行。
电极电势能够反映电子在电极上的活动程度,是判断电极是氧化还是还原的参数。
电极电势通常用标准电极电势(E°)来表示,单位为伏特(V)。
测量电极电势的方法有很多种,其中最常用的方法是通过比较电池。
比较电池由两个半电池组成,可以产生一个已知电势差的电池。
通过将待测电极与比较电池相连,测量它们之间的电势差,从而确定待测电极的电势差。
二、电极电势的影响因素1. 温度:电极电势随温度的变化而变化。
温度升高会导致电极电势升高或降低,具体取决于反应的热力学性质。
2. 浓度:电极电势与参与反应的物质浓度有关。
当参与反应的物质浓度发生改变时,电极电势也会发生变化。
3. 压力:对于气体电极,电极电势随气体的分压变化而变化。
增大气体分压会导致电极电势升高。
4. pH 值:对于溶液电极,电极电势会受到 pH 值的影响。
改变溶液pH 值能够改变电极电势。
三、电池电动势的概念与计算电池电动势是指电池两个电极之间的电势差,表征了电化学反应产生的电能。
电池电动势通常用电池电动势(Ecell)来表示,单位为伏特(V)。
计算电池电动势的方法是通过测量两个电极的电极电势,并利用Nernst 方程进行计算。
Nernst 方程是描述电极电势与反应物浓度之间关系的数学方程。
Ecell = E°cell - (RT/nF)ln(Q)其中,E°cell 是标准电动势,R 是气体常数,T 是温度,n 是电子转移的摩尔数,F 是法拉第常数,Q 是反应物的活度积。