溶解度曲线问题2
- 格式:doc
- 大小:42.00 KB
- 文档页数:2

A B C0 t 1 20 t 2 温度/℃ g 40溶解度全国中考化学汇编之溶解度曲线1.右图是a 、b 两种固体物质(不含结晶水)的溶解度曲线。
下列说法正确的是 A.b 的溶解度大于a 的溶解度B.t 1℃时,将a 、b 两种物质的饱和溶液分别恒温蒸发 等质量的水,析出晶体的质量一定相等C.将t 2℃时的b 的不饱和溶液降温至t 1℃, 一定能得到b 的饱和溶液D.t 2℃时,a 溶液的溶质质量分数一定小于 b 溶液的溶质质量分数2.右图所示是甲、乙两种固体物质的溶解度曲线,请回答下列问题: (1)t 1℃时,甲物质的溶解度 乙物质的溶解 度(填“>”、“=”或“<”)。
(2)甲、乙两种物质的溶解度受温度影响较小的是 物质。
(3)t 2℃时,把100g 乙物质放入100g 水中,充分搅拌, 所得溶液是 溶液(填“饱和”或“不饱和”)。
(4)t 2℃时,有一接近饱和的甲溶液,可采用 的方法(任写一种)使它变为饱和溶液。
3.右图是甲、乙两种物质的溶解度曲线,下列说法正确的是 A .甲的溶解度受温度影响比乙小 B .15℃时甲、乙的溶解度相等C .30℃时乙的溶解度为30gD .升高温度可使接近饱和....的甲溶液变为饱和.. 4.请根据图7中A 、B 两种固体物质的溶解度曲线,回答下列问题。
(l)在____℃时,A 、B 两种物质溶解度相同。
(2) t 2℃时,100g 水中溶解_ gA 物质恰好达到饱和,该饱和溶液中溶质的质量分数为_ ___,若要把该饱和溶液稀释成质量分数为10%的溶液,应加水 g 。
(3)将t 2℃时A 、B 两种物质的饱和溶液降温至t 1℃(其它条件不变),溶质的质量分数保持不变的是___ _。
5.(5分) 右图为A 、B 、C 三种物质的溶解度曲线,据图回答: ⑴ t 20C 时,A 、B 、C 三种物质的溶解度由大到小顺序是 ______。
⑵ 将t 20C 时三种物质等质量的饱和溶液分别降温到00C 时,析出溶质最多的是 ___ ,无溶质析出的是 __ 。

初三化学溶解度曲线习题(含答案)和溶液,将它们混合并搅拌均匀,会发生下列哪种情况()A.溶液变成淡黄色B.溶液变成白色浑浊C.溶液变成淡红色D.没有任何变化10.下列说法正确的是()A.溶液的浓度与溶剂的质量无关B.溶解固体的溶解度随温度升高而升高C.溶解气体的溶解度随温度升高而降低D.溶解气体的溶解度随压力升高而升高11.下列说法正确的是()A.溶液的沸点与溶质的种类有关,与溶液浓度无关B.溶液的沸点与溶液浓度有关,与溶质的种类无关C.溶液的沸点与溶液浓度和溶质的种类都有关D.溶液的沸点与溶液浓度和溶质的种类都无关12.下列说法正确的是()A.溶解固体时,固体的溶解度随温度升高而升高B.溶解气体时,气体的溶解度随温度升高而升高C.固体的溶解度随溶剂温度升高而降低D.气体的溶解度随溶剂温度升高而降低13.下列说法正确的是()A.溶解固体时,固体的溶解度随压力升高而升高B.溶解气体时,气体的溶解度随压力升高而升高C.固体的溶解度随溶剂压力升高而降低D.气体的溶解度随溶剂压力升高而降低14.下列说法正确的是()A.在相同条件下,饱和溶液的溶质质量分数与溶液浓度相等B.在相同条件下,饱和溶液的溶质质量分数与溶液浓度无关C.在相同条件下,饱和溶液的溶质质量分数随溶液浓度升高而升高D.在相同条件下,饱和溶液的溶质质量分数随溶液浓度升高而降低15.下列说法正确的是()A.溶质在溶液中的质量分数越大,溶液的浓度越低B.溶质在溶液中的质量分数越小,溶液的浓度越低C.溶质在溶液中的质量分数越大,溶液的浓度越高D.溶质在溶液中的质量分数越小,溶液的浓度越高16.下列说法正确的是()A.溶解固体时,固体的溶解度随溶剂温度升高而升高B.溶解气体时,气体的溶解度随溶剂温度升高而升高C.固体的溶解度随溶剂压力升高而升高D.气体的溶解度随溶剂压力升高而升高1.下列选项中,对于“10%的食盐溶液”的解释错误的是()。
A。
在100g食盐溶液中溶解了10g食盐B。

溶解度曲线题型是化学学科中的一种常见题型,考察学生对溶解度曲线的理解和应用能力。
下面将对溶解度曲线题型进行归纳,并提供相关参考内容。
1.理解溶解度曲线的概念溶解度曲线是反映物质溶解度随温度变化的关系的曲线图。
通常画出物质在单位时间内溶解的质量与溶液温度之间的关系。
2.溶解度曲线分类(1)单斜型:溶解度随温度的升高而逐渐增大或逐渐减小,在一定温度范围内变化不大。
(2)递减型:溶解度随温度的升高而逐渐减小。
(3)递增型:溶解度随温度的升高而逐渐增大。
3.根据溶解度曲线解决实际问题(1)溶解度随温度的变化规律可以用于制备饱和溶液。
当需要制备一定温度下的饱和溶液时,可以根据该温度对应的溶解度,在溶质溶解度大于该值的情况下,添加足够的溶质量使溶液达到饱和状态。
(2)利用溶解度曲线可以推导出溶解热的变化规律。
溶解热是单位质量溶质在溶液中溶解过程中吸收或放出的能量,可以通过测定不同温度下的溶解度来计算溶解热。
4.相关参考内容(1)事实性知识:介绍溶解度曲线的定义、作用和分类,以及溶解度曲线在实际中的应用。
(2)溶解度曲线的示意图:可以绘制一个典型的溶解度曲线示意图,并注明常见的分类。
(3)实例分析:提供一些实际问题,并引导学生根据溶解度曲线进行解决。
例如,根据某种物质的溶解度曲线,求该物质在某一温度下饱和溶液的质量分数。
(4)涉及溶解热的题目:通过给定溶解度曲线和实验数据,让学生计算溶解热的值,并解释计算结果的意义。
总结:溶解度曲线题型的基本内容包括溶解度曲线的概念、分类和解决实际问题的方法。
为了帮助学生理解和应用溶解度曲线,教材和参考资料可以提供相关的知识介绍、示意图、实例分析和涉及溶解热的题目。
这样能够帮助学生更好地理解和应用溶解度曲线。

第九单元溶液课题2 溶解度第2课时溶解度和溶解度曲线课前自主预习1.回答下列问题:(1)固体的溶解度指在一定______下,某固态物质在______溶剂里达到______状态所溶解的______。
(2)20℃时,氯化钠在水中的溶解度为36 g,意思是20℃时,______水中达到______状态时溶解氯化钠的质量为______;或者20℃时,______水中______可溶解氯化钠的质量为36 g。
(3)物质的溶解性是根据______℃时的溶解度规定的,当该温度下物质的溶解度______10 g时,为易溶物质。
a.固体的溶解度从几个要素进行规定?______b.要比较两种物质的溶解度,需要注意什么问题?______【答案】(1)温度100g 饱和质量(2)100g 饱和36g 100g 最多(3)20 大于一定温度、溶剂质量100g、饱和溶液、溶解质量温度相同2.“20℃ NaCl的溶解度为36g”的含义:(1)20℃时,100g水中最多可溶解NaCl___________。
(2)20℃时,36g NaCl完全溶解___________需要___________水。
(3)20℃时,36g NaCl和100g水恰好形成饱和溶液,其质量为___________。
(4)20℃时,136g饱和NaCl溶液中含有NaCl___________,水___________。
(5)36g NaCl和100g水形成饱和溶液时,温度为___________。
【答案】(1)36g(2)达到饱和100g(3)136g(4)36g 100g(5)20℃3.根据教材图9—12和图9—13,回答:(1)溶解度随温度的变化有什么规律?(2)从溶解度曲线你还能获得哪些信息(3)溶解度数据表和曲线都可表示物质在不同温度下的溶解度,二者有何区别?【答案】(1)多数固体的溶解度随温度的升高而增大;少数固体的溶解度受温度变化影响很小;极少数固体的溶解度随温度的升高而如减小(2)曲线表示某物质在不同温度下的溶解度以及溶解度随温度变化的趋势;曲线上的点表示某物质在对应温度下的溶解度;两曲线交点表示两物质在该点对应温度下的溶解度相等;曲线下面的表示溶液是对应温度下该溶质的不饱和溶点液。

溶解度曲线图表题1.(2020湘潭)甲、乙、丙三种固体物质的溶解度曲线如图1所示,请回答下列问题:(1)t1℃时,甲、乙、丙三种物质中溶解度最大的是____。
(2)t2℃时,甲物质的溶解度为____g。
(3)将t2℃时的甲、乙、丙三种物质的饱和溶液降温至t1℃,所得溶液溶质质量分数由大到小的顺序为_______。
(4)如图2,t1℃时,若向烧杯中加入足量的_____(填字母序号)并使之充分溶解,在试管中可观察到有晶体析出。
A 氯化钠B 氢氧化钠C 硝酸铵【答案】丙60乙>甲>丙C【解析】(1)根据甲、乙、丙三种固体物质的溶解度曲线图,t1℃时,甲、乙、丙三种物质中溶解度最大的是丙。
(2)根据甲物质的溶解度曲线图,t2℃时,甲物质的溶解度为60g。
(3)甲、乙溶解度随温度降低而减小,丙溶解度随温度降低而增大,t2℃时溶解度关系为:甲>乙>丙,t1℃时,溶解度关系为:丙>乙>甲,将t2℃时的甲、乙、丙三种物质的饱和溶液降温至t1℃,甲、乙析出晶体得到的是饱和溶液,此温度下甲的溶解度小于乙,故乙的溶质质量分数大于甲,而丙的溶解度随温度的降低而增大,溶液组成不变,所得溶液溶质质量分数由大到小的顺序为乙>甲>丙。
(4)丙的溶解度随温度的升高而减小,则t1℃时,若向烧杯中加入足量的硝酸铵并使之充分溶解,在试管中可观察到有晶体析出,因为硝酸铵溶于水吸热使温度降低;而氯化钠溶于水温度几乎不变,氢氧化钠溶于水放热使温度升高,均不符合题意;故填:C。
2.(2020长沙)数据处理是对数据进行加工的过程,列表法和作图法是常用的数据处理方法。
请你根据图表分析:表:两种物质在不同温度时的溶解度(1)KNO3对应的是图中的_____物质。
(2)25℃时,向100g水中加入45.8g KNO3,充分搅拌后,所得的溶液是_____溶液(填“饱和”或“不饱和”)。
(3)当甲中含有少量乙时,应采用_____结晶法提纯甲。
【答案】甲饱和降温【解析】(1)由表中数据可知,硝酸钾的溶解度随温度的升高而增大,硝酸钾的溶解度受温度变化影响较大,氯化钠溶解度受温度变化影响较小,故KNO3对应的是图中的甲物质。

溶解度曲线图解题技巧什么是溶解度曲线图溶解度曲线图是描述某种物质在不同温度下溶解度变化的图表。
通常,横轴表示温度,纵轴表示溶解度,通过绘制曲线来表示溶解度随温度的变化关系。
溶解度曲线图可帮助我们了解物质溶解度随温度变化的规律,并在化学实验和计算中起到重要作用。
溶解度曲线图解题技巧1.理解溶解度的定义和表示方法在使用溶解度曲线图解题之前,我们首先需要理解溶解度的定义。
溶解度是指单位溶剂中能够溶解的最大溶质的物质量。
通常,溶解度用质量百分比(如g/100g溶剂)或质量分数(如%w/w)表示。
2.分析曲线的走势首先,观察溶解度曲线的走势。
曲线可能是上升的、下降的或呈其他形状。
我们可以通过分析曲线的走势来得出某种物质在不同温度下溶解度的变化趋势。
–上升曲线:表示溶解度随温度增加而增加,通常用于描述固体在液体中的溶解过程。
–下降曲线:表示溶解度随温度增加而减少,通常用于描述气体在液体中的溶解过程。
3.确定反应条件在使用溶解度曲线图解题时,通常需要确定特定的反应条件,例如温度或溶剂的种类。
根据题目给出的条件,我们可以在溶解度曲线图上找到相应的数据点,以便计算或推导出所需的结果。
4.利用曲线计算溶解度一些题目可能需要我们根据溶解度曲线图计算某种物质在特定温度下的溶解度。
在这种情况下,我们可以通过读取曲线上的数据点,并进行线性插值或直接读取数值来计算溶解度。
5.判断饱和溶液条件根据溶解度曲线图,我们还可以判断饱和溶液的条件。
饱和溶液是指在一定温度下,溶质达到最大溶解度而不能再溶解的溶液。
通过观察曲线图上的数据点,我们可以确定饱和溶液的溶质和溶剂的比例,以及可能出现的沉淀和溶液的稳定性。
6.考虑其他因素在使用溶解度曲线图解题时,我们还应该考虑其他因素,如压力、固体颗粒大小和搅拌等。
这些因素可能会对溶解度产生影响,因此我们需要在解题过程中将其纳入考虑。
总结溶解度曲线图是化学中重要的工具,可以帮助我们了解溶解度随温度变化的规律。



北京市2022-2023学年中考化学试题溶解度曲线分类题练答案版化学试题1.(2022眉山)甲、乙、丙三种固体物质的溶解度曲线如图所示。
下列说法正确的是A. 20℃时,甲的溶解度大于乙的溶解度B. 图中P点表示10℃时丙的饱和溶液C. 20℃时,100g乙的饱和溶液中含有乙的质量为30gD. 50℃时,同质量的甲、乙、丙饱和溶液降温至10℃,甲溶液中析出固体最多【答案】D的溶解度(见下表)和溶解度曲线(见图)。
下列说2.(2022连云港)KC1和KNO3法正确的是A. 曲线甲代表KCl的溶解度曲线B. 40℃时KNO3饱和溶液中KNO3的质量分数为63.9%C. t1的值在20~30之间D. 将t1℃时甲和乙的饱和溶液升温至t2℃时,溶液中溶质的质量分数:甲>乙【答案】C3.(2022镇江)如图为Na2CO3和NH4HCO3的溶解度曲线。
下列说法正确的是A. T3℃时,将30gNa2CO3固体加到50g水中,所得溶液的溶质质量分数为37.5%B. 将Na2CO3饱和溶液从T2℃升温到T4℃,溶质质量分数变大C. 将100gNH4HCO3饱和溶液从T4℃降温到T1℃,析出20gNH4HCO3晶体D. 将等质量的两物质饱和溶液从T1℃升温到T4℃,为使溶液恰好饱和,加入两固体质量相等【答案】D4.(2022潍坊)我国化学家侯德榜创立的联合制碱法促进了世界制碱技术的发展。
如图是反应过程涉及到的NH4HCO3、NaCl、NH4Cl和NaHCO3四种物质的溶解度曲线。
下列有关说法错误的是()A.30℃时将等质量的NH4Cl和NaHCO3分别配制成饱和溶液,所得溶液质量NaHCO3大于NH4ClB.在20℃时将30gNH4Cl加入50g水中充分搅拌后得到NH4Cl的饱和溶液C.NH4HCO3与NaCl的溶解度曲线相交于p点,该温度下两溶液溶质的质量分数相等D.将60℃时四种物质的饱和溶液降温到10℃析出晶体最多的是NH4HCO3【答案】CD;5.(2022临沂)如图是a、b、c三种固体物质的溶解度曲线,回答下列问题:(1)在_____℃时,a、c两种物质的溶解度相等。


初三化学中考专题 (5) 溶解度曲线练习及答案1.a 、b 两种物质的溶解度曲线以下图。
以下说法不正确的选项是A. 将 t 1℃时 b 的饱和溶液加水可变为不饱和溶液B. 将 t 2℃时 a 的饱和溶液降温至t 1℃,溶液质量不变C.t 2℃时,两种物质的饱和溶液中溶质质量分数a>bD.将 t 2℃时 a、 b 的饱和溶液分别降温至t 1℃,两溶液的溶质质量分数相等2.以下图是甲、乙、丙三种固体物质的溶解度曲线,以下说法错误的选项是A.t 2℃时,甲、乙两种物质的溶解度相等B.甲的溶解度随温度的高升而增大C. 分别将 t 3℃时甲、乙、丙的饱和溶液降温至 t 1℃,则所得的三种溶液中溶质的质量分数大小关系是乙>甲>丙D.t 1℃时,丙的饱和溶液中溶质的质量分数为40%3. 以下图是甲、乙、丙三种固体物质的溶解度曲线,将甲、乙、丙三种物质t 2℃时的饱和溶液降温至t 1℃,所得溶液的溶质质量分数关系正确的选项是A. 甲>乙>丙B.甲=乙=丙C.甲 =乙>丙D.丙>甲=乙4.(多项选择)甲、乙两固体物质的溶解度曲线以下图,以下说法正确的选项是A.t 1℃时,甲物质的溶解度为20gB.t 1℃时, 30g 甲加入到50g 水中最多可得70g 溶液C.t 2℃时,乙物质的饱和溶液升温变为不饱和溶液D.t 2℃时,甲乙两物质的饱和溶液分别降温到t 1℃时,所得溶液溶质质量分数的大小关系是:甲<乙5. (多项选择)甲、乙两种固体物质的溶解度曲线以下图。
20℃时,进行了以以下图所示的实验,以下表达正确的选项是A.甲的溶解度大于乙的溶解度B.实验过程中,属于不饱和溶液的是A 溶液和 C 溶液C.实验过程中,只有 B 溶液和 D溶液属于饱和溶液D.实验过程中, B 溶液与 E 溶液中溶质的质量分数同样6.(多项选择)甲、乙、丙三种不含结晶水的固体物质的溶解度曲线以下图,以下说法中正确的选项是A.t 2℃时将 50g 甲物质放入 50g 水中,充足搅拌后获得 100g 甲溶液B.t 2℃时配制等质量的三种物质的饱和溶液,甲所需要的水最少C. 分别将t 2℃时三种物质的饱和溶液降温到t 1℃,所得溶液中溶质的质量分数的大小关系是乙>甲>丙D. 分别将 t 2℃时三种物质的饱和溶液降温到t 1℃,甲溶液中析出的晶体最多丙溶液中无晶体析出7.甲、乙、丙三种物质的溶解度曲线以以下图所示。

溶解度曲线练习题一.选择题(共9小题)1.如图是甲、乙两种物质(不含结晶水)的溶解度曲线.下列说法中正确的是( )A.甲的溶解度大于乙的溶解度B.t1℃时,50g甲的饱和溶液中有含有15g甲C.t2℃时甲的溶液和乙的溶液溶质质量分数相等D.当甲中含有少量乙时,可以用降温结晶的方法提纯甲2.如图,是甲、乙两种固体物质的溶解度曲线,下列说法正确的是( )A.甲的溶解度比乙大B.40℃时,甲的饱和溶液中溶质质量分数为50%C.40℃时,将50g乙物质全部溶于水中,恰好能得到150g乙的饱和溶液D.将130g 20℃甲的饱和溶液升温到40℃,最多还能溶解甲物质20g两种物质的溶解度曲线,下列叙述中错误的是( )3.如图是A、BA.A物质的饱和溶液从30℃降温到10℃,变成不饱和溶液B.30℃时,向100g水中加入25gA物质,充分溶解后所得溶液是饱和溶液C.B物质的饱和溶液从30℃降温到20℃,其溶质质量分数减小D.30℃时,将B物质的不饱和溶液转变为饱和溶液,可以采取恒温蒸发溶剂的方法4.(2018•嘉定区一模)甲、乙两种固体的溶解度曲线如图所示,下列说法正确的是( )A.20℃时,甲溶液中的溶质质量一定小于乙溶液B.20℃时,可配制溶质质量分数为30%的乙溶液C.20℃时,50g水中加入20 g乙可得到饱和溶液70gD.50℃时,100 g水中加入20 g乙并降温至20℃,溶液中溶质的质量分数不变5.如图是甲、乙两种物质(不含结晶水)的溶解度曲线.下列说法中正确的是( )A.甲的溶解度大于乙的溶解度B.t1℃时,50g甲的饱和溶液中有15g甲C.t2℃时甲的饱和溶液降温至t1℃变为不饱和溶液D.当甲中含有少量乙时,可以用降温结晶的方法提纯甲6.25℃时,向下列4只均盛有100g水的烧杯中,分别加入不同质量的KCl固体,充分溶解。
下列有关说法不正确的是( )A.①烧杯中溶液的质量为110 gB.②烧杯中溶液的溶质质量分数约为16.7%C.4只烧杯中形成的溶液为饱和溶液的是③④D.增加KCl固体能将KCl的不饱和溶液变为KCl的饱和溶液7.甲、乙两种不含结晶水的固体物质的溶解度曲线如图所示。

高中化学题型之溶解度曲线的计算溶解度曲线是化学中常见的一种重要图像,它描述了在一定温度下溶质在溶剂中的溶解度随溶质的浓度变化的关系。
在化学学习中,我们经常需要计算溶解度曲线上的各个点的数值,以便更好地理解和应用溶解度曲线。
本文将以具体题目为例,说明溶解度曲线的计算方法和相关考点。
首先,让我们来看一个典型的题目:题目:某溶质在水中的溶解度随温度的变化如下表所示:温度(℃)溶解度(g/100 mL)20 1030 2040 3050 4060 50请根据上述数据绘制溶解度曲线,并回答以下问题:1. 温度为35℃时,溶解度为多少?2. 溶解度为25g/100 mL时,温度为多少?解析:首先,我们需要将给定的数据绘制成溶解度曲线图。
横轴表示温度(℃),纵轴表示溶解度(g/100 mL)。
根据表中的数据,我们可以得到以下溶解度曲线图:(插入溶解度曲线图)接下来,我们来解答第一个问题:温度为35℃时,溶解度为多少?根据溶解度曲线图,我们可以看到35℃对应的溶解度应该在20和30之间。
为了更精确地计算出溶解度,我们可以使用线性插值法。
线性插值法的基本原理是根据已知数据点的坐标,通过直线的斜率来估算未知点的坐标。
首先,我们找到温度为30℃和40℃时的溶解度,分别为20g/100 mL和30g/100 mL。
然后,我们可以根据这两个点的坐标计算出直线的斜率:斜率 = (30 - 20) / (40 - 30) = 1接下来,我们计算35℃对应的溶解度。
根据线性插值法的公式:溶解度 = 20 + (35 - 30) * 1 = 25g/100 mL因此,温度为35℃时,溶解度为25g/100 mL。
接下来,我们来解答第二个问题:溶解度为25g/100 mL时,温度为多少?根据溶解度曲线图,我们可以看到溶解度为25g/100 mL对应的温度应该在30℃和40℃之间。
同样地,我们可以使用线性插值法来计算温度。
首先,我们找到溶解度为20g/100 mL和30g/100 mL时的温度,分别为30℃和40℃。

溶解性、溶解度和溶解度曲线题一:如图为氯化钠、碳酸钠在水中的溶解度曲线,其中氯化钠、碳酸钠两物质的溶解度曲线交点为A。
下列说法正确的是()A. 碳酸钠俗称小苏打B. 0℃时,氯化钠的溶解度为36.3 gC. 碳酸钠的溶解度大于氯化钠的溶解度D. 将Na2CO3和NaCl均达到饱和的混合溶液,从40℃降温到20℃时,析出的固体物质主要是NaCl 题二:如图是a、b、c三种固体物质的溶解度曲线,下列说法错误的是()A. t℃时,将50 g a物质加入到50 g水中充分搅拌,可得到90 g a的饱和溶液B. a、b、c三种物质均属于易溶物质C. a中含有少量b,可用冷却a的热饱和溶液的方法提纯aD. 将20℃的三种物质的饱和溶液升温到t℃,所得溶液中溶质的质量分数的大小关系是:b>a=c题三:在a、b、c、d四支试管中各加入1~2小粒碘或高锰酸钾,然后分别加入5 mL水或汽油(如图所示),振荡,观察现象。
(1)a试管中的现象是,c试管中的现象是。
(2)对比(填字母)两支试管中的现象得出:同种溶质在不同溶剂中的溶解性不同;对比a、c试管中的现象得出的结论是;(3)【提出问题】物质的溶解性除与溶质、溶剂的性质有关外,还与什么有关?【作出猜想】。
【设计方案】。
【观察现象】。
【得出结论】。
题四:小明陪妈妈到医院输液,不小心将护士手中的盘子打翻,其中的棉球落在了小明的白色衬衣上,白色衬衣上立即出现了一大片紫黑色痕迹。
为找到去掉白衬衣上的痕迹的最好方法,几位同学进行了讨论,提出了以下几个方案并进行实验:①用水洗;②用无水酒精洗;③用汽油洗;④用四氯化碳洗;⑤用肥皂水洗;⑥用淀粉溶液洗。
(1)你认为留在白色衬衣上的紫黑色物质是什么?(2)如果用白色布条进行实验,为使实验结果更加准确,你认为该实验中需要控制哪些实验条件?(3)一位同学按如图所示方法进行实验:结果是⑤、⑥几乎完全褪色;②略带颜色;③、④略微变浅;①几乎不变。

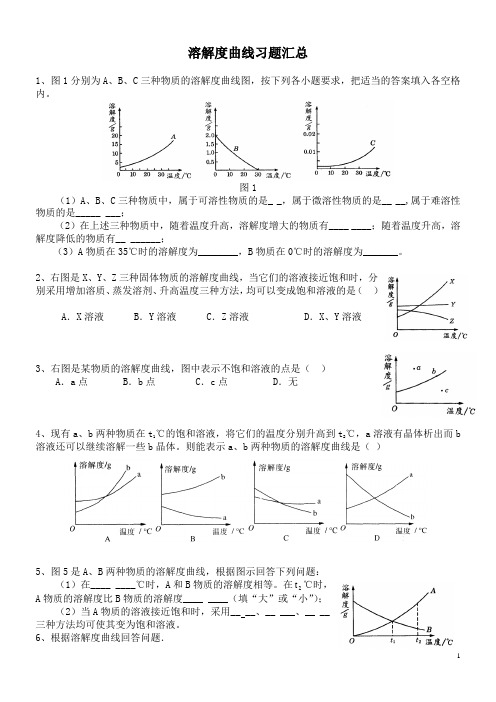
溶解度曲线习题汇总1、图1分别为A、B、C三种物质的溶解度曲线图,按下列各小题要求,把适当的答案填入各空格内。
图1(1)A、B、C三种物质中,属于可溶性物质的是_ _,属于微溶性物质的是__ __,属于难溶性物质的是_____ ___;(2)在上述三种物质中,随着温度升高,溶解度增大的物质有____ ____;随着温度升高,溶解度降低的物质有__ ______;(3)A物质在35℃时的溶解度为________,B物质在0℃时的溶解度为_______。
2、右图是X、Y、Z三种固体物质的溶解度曲线,当它们的溶液接近饱和时,分别采用增加溶质、蒸发溶剂、升高温度三种方法,均可以变成饱和溶液的是()A.X溶液B.Y溶液C.Z溶液 D.X、Y溶液3、右图是某物质的溶解度曲线,图中表示不饱和溶液的点是()A.a点 B.b点C.c点 D.无4、现有a、b两种物质在t1℃的饱和溶液,将它们的温度分别升高到t2℃,a溶液有晶体析出而b溶液还可以继续溶解一些b晶体。
则能表示a、b两种物质的溶解度曲线是()5、图5是A、B两种物质的溶解度曲线,根据图示回答下列问题:(1)在____ ____℃时,A和B物质的溶解度相等。
在2t℃时,A物质的溶解度比B物质的溶解度____ ____(填“大”或“小”);(2)当A物质的溶液接近饱和时,采用__ __、__ ___、__ __三种方法均可使其变为饱和溶液。
6、根据溶解度曲线回答问题.(1)溶解度随温度升高而增大的物质是____ ____.(2)t2℃时,溶解度相等的是__ _____.(3)t2℃时,100 g水中加入20 g a物质,溶液不饱和,为使其饱和,可再加入a物质________g,或使其温度降到__ _____℃.7、右图是 a、b、c三种物质的溶解度曲线,据图回答:(1)当温度是℃,a、b两种物质的溶解度相等;℃时三种物质的溶解度由大到小的顺序是(2)t38、甲乙两种固体的溶解度曲线如右图所示。

溶解度曲线练习题一.选择题(共9小题)1.如图是甲、乙两种物质(不含结晶水)的溶解度曲线.下列说法中正确的是( )A.甲的溶解度大于乙的溶解度℃时,50g甲的饱和溶液中有含有15g甲B.t1℃时甲的溶液和乙的溶液溶质质量分数相等C.t2D.当甲中含有少量乙时,可以用降温结晶的方法提纯甲2.如图,是甲、乙两种固体物质的溶解度曲线,下列说法正确的是()A.甲的溶解度比乙大B.40℃时,甲的饱和溶液中溶质质量分数为50%C.40℃时,将50g乙物质全部溶于水中,恰好能得到150g乙的饱和溶液D.将130g 20℃甲的饱和溶液升温到40℃,最多还能溶解甲物质20g3.如图是A、B两种物质的溶解度曲线,下列叙述中错误的是()A.A物质的饱和溶液从30℃降温到10℃,变成不饱和溶液B.30℃时,向100g水中加入25gA物质,充分溶解后所得溶液是饱和溶液C.B物质的饱和溶液从30℃降温到20℃,其溶质质量分数减小D.30℃时,将B物质的不饱和溶液转变为饱和溶液,可以采取恒温蒸发溶剂的方法4.(2018•嘉定区一模)甲、乙两种固体的溶解度曲线如图所示,下列说法正确的是()A.20℃时,甲溶液中的溶质质量一定小于乙溶液B.20℃时,可配制溶质质量分数为30%的乙溶液C.20℃时,50g水中加入20 g乙可得到饱和溶液70gD.50℃时,100 g水中加入20 g乙并降温至20℃,溶液中溶质的质量分数不变5.如图是甲、乙两种物质(不含结晶水)的溶解度曲线.下列说法中正确的是( )A.甲的溶解度大于乙的溶解度B.t1℃时,50g甲的饱和溶液中有15g甲C.t2℃时甲的饱和溶液降温至t1℃变为不饱和溶液D.当甲中含有少量乙时,可以用降温结晶的方法提纯甲6.25℃时,向下列4只均盛有100g水的烧杯中,分别加入不同质量的KCl固体,充分溶解.下列有关说法不正确的是()A.①烧杯中溶液的质量为110 gB.②烧杯中溶液的溶质质量分数约为16.7%C.4只烧杯中形成的溶液为饱和溶液的是③④D.增加KCl固体能将KCl的不饱和溶液变为KCl的饱和溶液7.甲、乙两种不含结晶水的固体物质的溶解度曲线如图所示.下列说法正确的是()A.20℃时,甲、乙两物质的饱和溶液中溶质分数相等,且都等于20%B.30℃时100g水中可溶解25g甲物质C.升温甲物质的不饱和溶液变为饱和溶液D.30℃时,甲、乙两种物质的溶液降温到0℃时,甲有晶体析出,乙无晶体析出8.如图是a、b、c三种物质的溶解度曲线,下列说法不正确的是()A.P点表示t1℃时,a、c两种物质的溶解度相等B.将c的不饱和溶液变为饱和溶液,可采用升温的方法C.t2℃时,将30g a物质加入到50g水中充分搅拌,得到80g a的溶液D.将t1℃时a、b、c三种物质的饱和溶液升温至t2℃,其溶质质量分数最大是b9. t1℃时,将等质量硝酸钾和氯化钾分别加入到各盛有100g水的两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示.则下列说法不正确的是()A.t1℃时氯化钾的溶解度大于硝酸钾B.烧杯②中上层清液一定是t1℃时硝酸钾的饱和溶液C.t1℃时将烧杯①中溶液倒入②中,充分搅拌后,烧杯②中一定还有固体剩余D.将温度升高到t2℃,两烧杯中溶液的溶质质量分数一定相等(不考虑水的蒸发)二.计算题(共1小题)10.甲,乙两种物质的溶解度曲线如图,请回答下列问题.(1)将40℃的等质量甲、乙两物质的饱和溶液降温至20℃,所得的溶液液的质量大小关系是;(2)40℃时,把40g甲物质放入100g水中,所得的溶液溶质质量分数是(结果精确到0.1%);(3)20℃时,甲物质溶液中溶质的质量分数不可能为;(填选项字母)A。

微专题09溶解度及溶解度曲线1.(2022·贵州黔西·中考真题)如图为甲、乙、丙三种不含结晶水的固体物质的溶解度曲线。
(1)t 3℃时,甲、乙、丙三物质溶解度由小到大的顺序是_____。
(2)t 2℃时,甲和丙两饱和溶液的溶质质量分数关系是_____。
(3)P 点对应混合物,甲、乙、丙中处于不饱和状态的是_____。
【答案】(1)丙<甲<乙(2)甲=丙(3)乙【解析】(1)如图所示,t 3℃时,甲、乙、丙三物质溶解度点在上的是乙表示乙的溶解度最大,其次是甲,最下面的是丙,表示丙的溶解度最小,因此三者溶解度小到大的顺序是:丙<甲<乙;(2)如图所示,t 2℃时,甲和丙的溶解度曲线交于一点,说明此温度下甲和丙的溶解度相等,则根据t 2℃时,甲和丙两饱和溶液的溶质质量分数可以用公式100%100g⨯+溶解度溶解度:计算,因此t 2℃时,甲和丙两饱和溶液的溶质质量分数关系是:甲=丙;(3)如图所示,P 点对应的甲和丙溶解度点都在P 点以下,说明此时甲和丙都处于饱和状态,而P 点在所对应的乙的溶解度点以下,说明此温度下乙是不饱和状态,故填:乙。
2.(2022·湖北襄阳·统考中考真题)如图为甲、乙、丙三种固体物质的溶解度曲线,据图回答问题。
突破一、溶解度曲线(1)t 1℃时,甲、丙两种物质的溶解度大小关系是甲______丙(填“>”“<”或“=”)。
(2)溶解度随温度的升高而减小的物质是______。
(3)t 2℃时,将甲、乙两种物质的饱和溶液降温至t 1℃,对所得溶液的叙述正确的是(填序号)。
A.甲溶液仍是饱和溶液,乙溶液变为不饱和溶液B.溶液中溶剂的质量甲<乙C.溶液中溶质的质量分数甲<乙【答案】(1)=(2)丙(3)C【解析】(1)由溶解度曲线可知,1t ℃时甲、丙两条曲线相交于一点,即1t ℃时,甲、丙两种物质的溶解度大小关系是甲=丙。
向装有等量水的A、B、C三个烧杯中分别加入10g、25g、25gNaNO3固体,充分溶解后,现象如图一所示.
(1)烧杯中的溶液一定属于饱和溶液的是
B
(填序号);
(2)图二中能表示NaNO3溶解度曲线的是
甲
(填“甲”或“乙”);
(3)要使B烧杯中剩余的固体继续溶解,可采用的方法是
升温(加水)
;
(4)图二中A点的含义
t1℃时甲和乙的溶解度相等
;
(5)t2℃时,将30g甲溶于50g水中,所得溶液的质量分数为
33.3%
;
(6)由图二分析,若分别将100g甲、乙的饱和溶液从t2℃降温到t1℃,对所得溶液的叙述正确的是
BD
(填序号).
A.甲、乙都是饱和溶液 B.所含溶剂质量:甲<乙
C.溶液质量:甲>乙 D.溶质质量分数:甲>乙.
考点:饱和溶液和不饱和溶液;饱和溶液和不饱和溶液相互转变的方法;固体溶解度曲线及其作用.
专题:溶液、浊液与溶解度.
分析:饱和溶液是指在一定温度下,在一定量的溶剂里不能再继续溶解某种溶质的溶液,根据饱和溶液与不饱和溶液的转化选择合适的转化方法,溶解度曲线中交点表示两种物质在该温度下的溶解度相等,根据溶质质量分数公式计算所得溶液的溶质质量分数,结合溶解度曲线和形成的溶液进行分析.
解答:解:①B烧杯中有未溶解的固体,一定是饱和溶液,固体:B;
②根据烧杯中形成的溶液可知硝酸钠的溶解度随温度的升高而增大,故填:甲;
③硝酸钠的溶解度随温度的升高而增大,可以使用升高温度的方法使剩余的硝酸钠继续溶解,也可以使用
加水的方法,故填:升温(加水);
④A点表示在t1℃时甲和乙的溶解度相等,故填:t1℃时甲和乙的溶解度相等;
⑤t2℃时,甲物质的溶解度为50g,将30g甲溶于50g水中,能溶解的甲物质的质量为:
50g
100g
×50g=25g,形成的是饱和溶液,所得溶液的溶质质量分数为:
25g
25g+50g
×100%=33.3%,故填:33.3%;
⑥分别将100g甲、乙的饱和溶液从t2℃降温到t1℃,
A、乙变为不饱和溶液,故A错误;
B、t2℃时甲的溶解度大于乙的溶解度,故相同质量的甲、乙的饱和溶液中甲的溶剂质量小于乙的溶剂的质量,降低温度,溶剂的质量不变,仍然是甲<乙,故B正确;
C、降低温度,甲析出固体,而乙不析出固体,故甲溶液的质量小于乙溶液的质量,故C错误;
D、降低温度,乙的溶质质量分数不变,甲的虽然减小,但是仍然大于乙的,故D正确;
故选BD.
点评:本题考查了饱和溶液与不饱和溶液的相互转化以及溶解度的有关知识,完成此题,可以依据已有的知识进行.。