保险丝中铅含量的测定
- 格式:doc
- 大小:43.00 KB
- 文档页数:2

陇东学院学士学位论文作者单位陇东学院化学化工学院指导老师作者姓名专业班级2006级化学1班提交时间二0一0年五月保险丝中铅含量的测定XXX指导教师: XXX(陇东学院化学化工学院 2006级化学1班甘肃庆阳 745000)摘要:本文以硫脲和氟化铵为掩蔽剂,二甲酚橙作指示剂,采用返滴定法测定保险丝中铅的含量。
方法简单、快速,结果准确、可靠。
关键词: 络合滴定;返滴定法;保险丝;掩蔽剂1 引言铅是一种有毒的重金属,也是一种重要的工业原料,其使用范围很广。
很多制造行业都需要铅。
汽车尾气、工业“三废”,使用加铅作稳定剂的塑料和搪瓷、松花蛋、爆米花、自来水管等都是铅的来源。
含铅废水一般采用石灰沉淀法,使废水中铅生成Pb(OH)2、PbCO3沉淀而被除去,铅的有机化合物可用强酸性阳离子交换树脂除去[4]。
据相关研究,我国每人每天都会从食物中摄取微量的铅。
科学研究发现,铅浓度每上升100μg·L-1 ,其智商就会下降5分左右。
因此含铅食品对人体危害很大。
国家允许铅的最高排放浓度为1.0mg·L-1(以Pb计)[8]。
铅也是保险丝中合金的必要成分之一,主要是利用了其熔点低的性质。
本研究采用配位滴定法测定了保险丝中铅的含量,并且用硫脲、NH4F作掩蔽剂来消除Cu2+、Sb3+对测定的影响[3]。
2 实验部分2.1 仪器与试剂电子天平,酸式滴定管,移液管,马弗炉。
乙二胺四乙酸二钠(A·R,西安化学试剂厂),氨水(A·R,山东,汕头市西陇化工厂),二甲酚橙,ZnO基准物质(G·R,西安化学试剂厂),硝酸(A·R,西安化学试剂厂),六亚甲基四胺(A·R,天津市红岩化学试剂厂),氟化铵(A·R,西安化学试剂厂),硫脲(A·R,西安化学试剂厂)。
2.2 实验过程2.2.1 EDTA溶液的配制和标定称取分析纯乙二胺四乙酸二钠1.85克,溶解于300mL水中,加热溶解,冷却后转移至试剂瓶中,稀释至500mL,充分摇匀,贴上标签。

固相萃取柱铅含量测定
固相萃取柱是一种常用于分离和富集样品中目标化合物的技术。
在铅含量测定方面,固相萃取柱可以用于富集和净化样品中的铅离子,以便进行后续的分析和测定。
固相萃取柱的选择应基于样品基
质的特性和铅离子的化学性质。
首先,固相萃取柱的选择至关重要。
针对铅含量测定,可以选
择具有亲铅性能的固相萃取柱,如含有硫醇基团的固相萃取柱。
这
种固相材料能够有效地吸附铅离子,并在后续的洗脱步骤中将其释
放出来。
其次,样品的处理也是关键的一步。
在固相萃取前,通常需要
将样品进行预处理,如酸化、碱化等,以调整样品的pH值,有利于
铅离子的吸附和洗脱。
此外,还需要注意样品的溶解度和浓度,以
确保固相萃取柱的富集效果。
在固相萃取过程中,流动相的选择和流速的控制也需要仔细考虑。
合适的流动相可以帮助铅离子在固相萃取柱中充分吸附,而过
快或过慢的流速都可能影响富集效果。
最后,经过固相萃取柱富集的样品需要进行洗脱和后续分析。
洗脱步骤中的洗脱剂的选择和洗脱次数的控制都会影响最终的铅含量测定结果。
洗脱后的样品可以通过各种分析方法进行铅含量的测定,如原子吸收光谱法、电感耦合等离子体发射光谱法等。
总之,固相萃取柱在铅含量测定中起着至关重要的作用,正确选择固相材料、合理处理样品、控制流动相和洗脱条件,可以有效地提高铅离子的富集效果,为后续的分析提供准确可靠的样品。
在很多电子设备中,都离不开保险丝(FUSE)。
自从十九世纪九十年代爱迪生发明了把细导线封闭在台灯座里的第一个插塞式保险丝之后,保险丝的种类越来越多,应用越来越广。
这里介绍一些保险丝参数、选择及应用常识。
保险丝的各项额定值及其性能指标是根据实验室条件及验收规范测定的。
国际上有多家权威的测试和鉴定机构,如美国的保险商实验公司的UL认证,加拿大标准协会的CSA认证、日本国际与贸易工业部的MTTI认证和国际电气技术委员会的ICE认证。
保险丝的选择涉及下列因素:1. 正常工作电流。
2. 施加在保险丝上的外加电压。
3. 要求保险丝断开的不正常电流。
4. 允许不正常电流存在的最短和最长时间。
5. 保险丝的环境温度。
6. 脉冲、冲击电流、浪涌电流、启动电流和电路瞬变值。
7. 是否有超出保险丝规范的特殊要求。
8. 安装结构的尺寸限制。
9. 要求的认证机构。
10. 保险丝座件:保险丝夹、安装盒、面板安装等。
下面把保险丝选型中常见的参数和术语作一些说明。
正常工作电流:在25℃条件下运行,保险丝的电流额定值通常要减少25%以避免有害熔断。
大多数传统的保险丝其采用的材料具有较低的熔化温度。
因此,该种保险丝对环境温度的变化比较敏感。
例如一个电流额定值为10A的保险丝通常不能在25℃环境温度下大于7.5A的电流运行。
电压额定值:保险丝的电压额定值必须等于或大于有效的电路电压。
一般标准电压额定值系列为32V、125V、250V、600V。
电阻:保险丝的电阻在整个电路中并不十分重要。
但对于安培数小于1的保险丝的电阻会有几个欧姆,所以在低电压电路中采用保险丝时应考虑这个问题。
大部分的保险丝是用正温度系数材料制成,所以也有冷电阻和热电阻之分。
环境温度:保险丝的电流承载能力,其实验是在环境温度为25℃情况下进行的,这种实验受环境温度变化的影响。
环境温度越高,保险丝的工作温度就越高,其保险丝的电流承载能力就越低,寿命也就越短。
相反,在较低的温度下允许会延长保险丝的寿命。
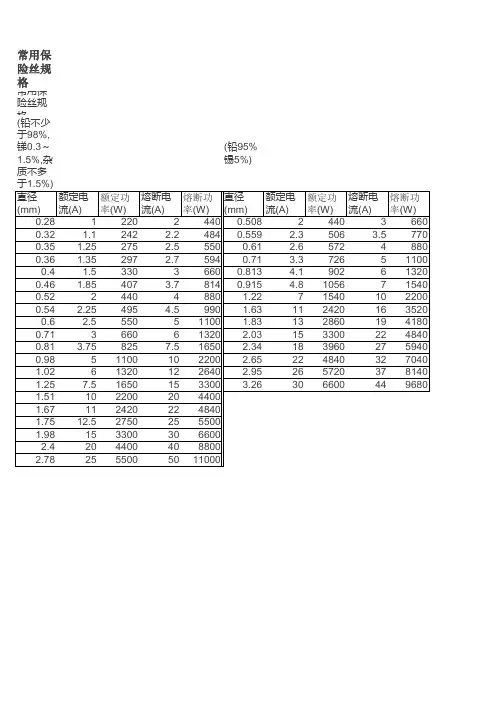
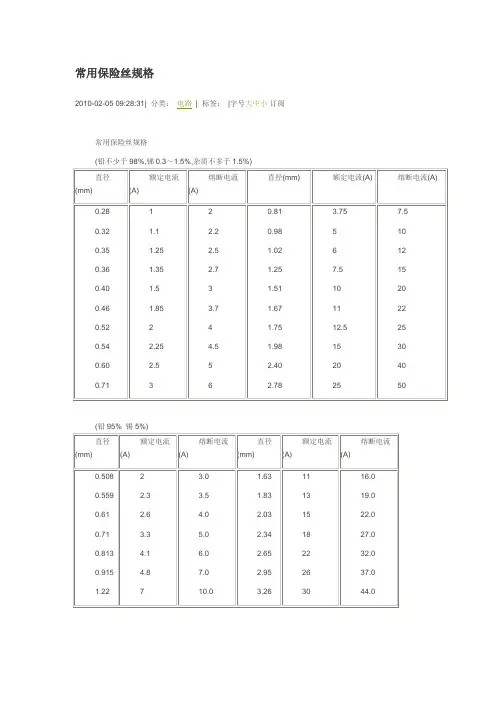
常用保险丝规格常用保险丝规格(铅不少于98%,锑0.3~1.5%,杂质不多于1.5%)(铅95% 锡5%)直径(mm)额定电流(A)额定功率(W)熔断电流(A)熔断功率(W)直径(mm)额定电流(A)额定功率(W)熔断电流(A)熔断功率(W)0.28122024400.508244036600.32 1.1242 2.24840.559 2.3506 3.57700.35 1.25275 2.55500.61 2.657248800.36 1.35297 2.75940.71 3.3726511000.4 1.533036600.813 4.1902613200.46 1.85407 3.78140.915 4.81056715400.5224404880 1.22715401022000.54 2.25495 4.5990 1.631124201635200.6 2.555051100 1.831328601941800.71366061320 2.031533002248400.81 3.758257.51650 2.341839602759400.9851100102200 2.652248403270401.02613201226402.952657203781401.257.51650153300 3.263066004496801.511022002044001.671124202248401.7512.527502555001.981533003066002.42044004088002.782555005011000在很多电子设备中,都离不开保险丝(FUSE)。
自从十九世纪九十年代爱迪生发明了把细导线封闭在台灯座里的第一个插塞式保险丝之后,保险 保险丝的各项额定值及其性能指标是根据实验室条件及验收规范测定的。
国际上有多家权威的测试和鉴定机构,如美国的保险商实验公司的 保险丝的选择涉及下列因素: 1. 正常工作电流。

铅锡合金中铅含量的测定
铅锡合金中铅含量的测定可以通过多种方法进行,以下是常见的几种方法:
1. 半定量法:使用电子天平称取一定重量的铅锡合金样品,溶解于适量的盐酸中,并将溶液定容至一定体积。
然后将溶液中的铅与已知浓度的标准铅溶液进行比色反应,根据比色结果可以大致估算出铅含量的范围。
2. 火焰原子吸收光谱法:将铅锡合金样品溶解于酸性溶液中,然后使用火焰原子吸收光谱仪测定溶液中铅的吸收量,通过与标准曲线对比,可以得到准确的铅含量。
3. 石墨炉原子吸收光谱法:类似于火焰原子吸收光谱法,但是使用石墨炉原子吸收光谱仪进行测定。
相比于火焰原子吸收光谱法,石墨炉原子吸收光谱法可以得到更低浓度的铅含量。
4. X射线荧光光谱法:将铅锡合金样品粉碎成细粉,然后通过X射线荧光光谱仪进行测定。
根据测得的荧光峰强度,可以推算出样品中的铅含量。
以上是常见的几种测定铅锡合金中铅含量的方法,选用哪种方法可以根据实际情况和实验设备的条件来确定。
实验前需要进行充分的样品处理和操作准备,确保实验结果的准确性和可靠性。

保险丝各种安规标准介绍保险丝属于电路保护器件,是一种安全元件,它的质量直接关系到人身和财产的安全。
一个保险丝出厂的时候,会经过各种安全机构的认证,下面我简单介绍一下关于保险丝的各种认证。
一、全球认证CB:CB—是国际电工委员会电工产品合格测试与认证组织(IECEE)建立的国际认证体系。
它是一个在认证机构和超过40个成员国之间相互承认测试结果的国际体系。
CB体系的缩写名称意思是“Certification Bodies’Scheme”(认证机构体系)。
二、欧盟CE认证:CE--全名是(European Communities)凡是贴有“CE”标志的产品就可在欧盟各成员国内销售,无须符合每个成员国的要求,从而实现了商品在欧盟成员国范围内的自由流通。
CE"标志是一种安全认证标志,被视为制造商打开并进入欧洲市场的护照。
三、美国/加拿大UL/CUL认证:UL--是英文保险商试验所(Underwriter Laboratories Inc.)的简写。
UL安全试验所是美国最具权威的,也是世界上从事安全试验和鉴定的专业机构。
CUL:CUL标志是用于在加拿大市场上流通产品的UL标志。
具有此种标志的产品已经过检定符合加拿大的安全标准,这些标准与美国的UL引用的标准基本相同, 当然,某些产品的标准也有差异。
比如,手持电动工具就有两套标准:UL45仅在美国适用。
UL745-1适用于美国和加拿大。
两种标准类似,都源自国际电工协会IEC60745--手持电机驱动工具安全标准。
CUL 标志普遍应用于家用电器、计算机设备、通风设备、家用防盗系统及其他类型的产品。
四、德国VDE 认证:VDE—是德国国家产品标志,意思是德国电气工程师协会。
VDE 测试机构和认证协会根据现行欧洲及国际标准对产品进行测试。
(Verband Deutscher Elektrotechniker,简称VDE)五、加拿大CSA 认证:CSA是加拿大标准协会(Canadian Standards Association)的简称它成立于1919年,是加拿大首家专为制定工业标准的非盈利性机构。

保健用品理化检测方法 第1部分:铅的测定警示——使用本标准的人员应有正规实验室工作的实践经验。
本标准并未指出所有可能的安全问题。
使用者有责任采取适当的安全和健康措施,并保证符合国家有关法规规定的条件。
1 范围本标准规定了保健用品中铅的石墨炉原子吸收光谱法和电感耦合等离子体质谱法。
本标准适用于保健用品理化指标中铅含量的测定。
2 规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件,仅所注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 6682 分析实验室用水规格和试验方法第一法 石墨炉原子吸收光谱法3 原理试样消解处理后,经石墨炉原子化,在283.3 nm处测定吸光度。
在一定浓度范围内铅的吸光度值与铅含量成正比,与标准系列比较定量。
4 试剂和材料除非另有说明,本方法所用试剂均为优级纯,水为GB/T 6682规定的一级水。
4.1 试剂4.1.1 硝酸(HNO3)。
4.1.2 高氯酸(HClO4)4.1.3 磷酸二氢铵(NH4H2PO4)。
4.1.4 硝酸钯[Pd(NO3)2]4.2 试剂配制4.2.1 硝酸溶液(1+99):量取10 mL硝酸,缓慢加入到990 mL水中,混匀。
4.2.2 硝酸溶液(1+9):量取50mL硝酸,缓慢加入到450 mL水中,混匀。
4.2.3 磷酸二氢铵-硝酸钯溶液:称取0.02 g硝酸钯,加少量硝酸溶液(1+9)溶解后,再加入2 g磷酸二氢铵,溶解后用硝酸溶液(1+99)定容至100 mL,混匀。
4.3 标准品经国家认证并授予标准物质证书的1000 mg/L的铅标准溶液。
4.4 标准溶液配制4.4.1 铅标准使用液准确吸取铅标准液(1000 mg/L)1.00 mL于1000 mL容量瓶中,加硝酸溶液(1+99)至刻度,混匀,得到1.00 mg/L的铅标准使用液。
4.4.2 铅标准系列溶液分别吸取铅标准使用液(1.00 mg/L)0 mL、1.00 mL、2.00 mL、3.00 mL、4.00 mL和6.00 mL于l00 mL容量瓶中,加硝酸溶液(1+99)至刻度,混匀。

一.实验目的1.掌握保险丝的溶样方法。
2.进一步巩固掩蔽剂在络合滴定中的应用。
二.实验原理一般的保险丝主要成分为铅及少量的Cu ,Sb 等。
用酸溶解反应式如下:O H 4NO 2)NO (Pb 3HNO 8Pb 32233+↑+=+然后,在络合滴定中都能用EDTA 形成络合物,我们在酸性溶液仲采用硫脲掩蔽Cu ,NH 4F 掩蔽Sb ,六次甲基四胺调节试液pH=5~6,二甲酚橙为指示剂,用EDTA 滴定可测定出铅的含量。
三.主要试剂EDTA 标准溶液,1L •5mol -HNO 3,二甲酚橙指示剂,六次甲基四胺,NH 4F (s ),硫脲(s ) 四.实验步骤称取保险丝0.2g ,加入5mL 1L •5mol -HNO 3,盖上表面皿,加热微沸至溶解,冷却后定容100mL 。
移取上述溶液20mL 至250mL 锥形瓶,加水20mL 、1g 硫脲、1g NH 4F ,60~70℃保温2min ,冷却后加入2~3滴二甲酚橙,滴加约4mL 六次甲基四胺溶液,至出现稳定紫红色,再过量5mL ,用EDTA 标准溶液滴定至溶液有红色变为亮黄色即为终点。
五.数据记录六.分析讨论1.上周配制的EDTA 溶液用完后,放在柜中,今周却不翼而飞。
因此只好借用同学的EDTA 溶液,考察过其上周EDTA 溶液标定中相对偏差较小,因而选用其EDTA 标准溶液,但其准确浓度不得而知。
2.滴定中由于对二甲酚橙由橙色变成亮黄色的变化不够敏锐,可能导致%/)Pb (ω偏大。
七.思考题1.简述二甲酚橙的变色原理答:二甲酚橙与溶液中的铅离子结合,形成红色络合物,使溶液显红色。
用EDTA 滴定到终点后,EDTA与全部铅离子结合生成比二甲酚橙-铅离子更稳定的络合物,游离出指示剂,使溶液呈亮黄色。
2.溶解保险丝时能否用HCl 和H 2SO 4,为什么?答:不能,因为溶解后生成的硫酸铅是难溶物,不能进行滴定。

玩具产品材料中铅含量测试方法一、前言美国总统布什于2008年8月14日签署了《消费品安全改进法案》(Consumer Product Safety Improvement Act of2008,简称CPSIA),该法案规定禁售任何对象为12岁或以下儿童、含铅量超过规定的产品。
法案对玩具产品材料中铅含量做出了明确的要求,因此如何测定玩具产品不同材料中的铅含量,给企业和测试机构提出了新的要求。
本文综述了目前国内外铅含量的主要测试方法,以供参考。
二、试剂除非另有说明,本文所使用的试剂均符合国家标准或行业标准,所使用的水均为去离子水或等同纯度的水(电阻率为18.2MΩ)。
所涉及的试剂及其纯度如下:2.1浓硝酸:优级纯;2.2过氧化氢(30%):分析纯;2.3浓盐酸:优级纯;2.4高氯酸:优级纯;2.5氢氟酸:分析纯;2.6硝酸(1+1,体积比):取1份浓硝酸(2.1)与1份水混合;2.7混合酸1(浓硝酸:高氯酸=4:1,体积比):取4份浓硝酸(2.1)与1份高氯酸(2.4)混合;2.8混合酸2(浓盐酸:浓硝酸:水=2:1:2,体积比):取2份浓盐酸(2.3)、1份浓硝酸(2.1)和2份水混合;2.9混合酸3(浓硝酸:氢氟酸=1:3,体积比):取1份浓硝酸(2.1)与3份氢氟酸(2.5)混合;2.10硝酸(2%):取2份浓硝酸(2.1)与65份水混合;2.11乙酸氨溶液(50%):取500g乙酸氨(NH4C2H3O2)溶于水中,定容至1L;2.12铅标准溶液:有证标准物质,浓度为100mg/L或1000mg/L。
三、设备试验中所用到的设备包括:3.1火焰原子吸收分光光度计(FLAA),配铅空心阴极灯;3.2电感耦合等离子体原子发射光谱仪(ICP-AES);3.3马弗炉;3.4微波消解炉;3.5可调式电热炉;3.6万分位电子分析天平。
四、样品处理目前,常见的样品处理有湿法消解、干法灰化和微波消解三种方法。
干法灰化法操作简便,但在高温下易损失;湿法消解法可以处理多种材料,但耗时长,同时需要使用高浓度的酸,造成的环境污染较严重;微波消解法操作简易,试验周期短,同时由于酸消耗量少,由酸引入的环境污染也大为降低,但同时处理样品的批量小,且仪器成本较高。

铅及铅合金化学分析方法银、砷、铋、镉、铁、镍、锑、锌、铜量的测定ICP电感藕合等离子体发射光谱法1.范围本部规定了铅及铅合精中银、砷、铋、镉、铁、镍、锑、锌、铜元素含量的测定方法。
本部分适用于铅及铅合金中银、砷、铋、镉、铁、镍、锑、锌、铜元素含量的测定。
测定范围见表1表1试料用稀硝酸溶解,加硫酸沉降分离后,干过滤上清液,在稀硝酸介质中,利用电感藕合等离子体发射光谱仪,测定铅及铅合金中银、砷、铋、镉、铁、镍、锑、锌、铜元素含量。
3.试剂3.1市售试剂3.1.1硝酸(ρ1.42g/ml)优级纯3.1.2酒石酸:优级纯3.1.3硫酸(ρ1.84g/ml)优级纯3.1.4硫脲:分析纯3.1.5氢氧化钠优级纯3.1.6盐酸:优级纯3.2溶液3.2.1硝酸(1+3)优级纯3.2.2酒石酸:(200g/L)3.2.3硫脲:(50g/L)3.2.4硫酸(1+3)3.2.5硝酸(1+1)3.2.6氢氧化钠(10%)3.3 标准贮存溶液(以下各元素贮存液均配制成0.001g/ml)3.3.1 铁、铜、锌、镉标准贮存溶液:分别称取0.5000g金属铁、铜、锌、镉(≥99.99%)于一组100ml烧杯中,分别加入30ml硝酸(3.2.5),盖上表面皿,加热至完全溶解,煮沸除去氮的氧化物,分别移入一组500ml容量瓶中,用水稀释至刻度,混匀。
3.3.2 镍标准贮存溶液:分别称取0.5000g金属镍(≥99.99%)于300ml烧杯中,加入30ml硝酸(3.2.5),盖上表面皿,加热至完全溶解,煮沸除去氮的氧化物,移入500ml容量瓶中,用(1+15)的硝酸稀释至刻度,混匀。
3.3.3 砷标准贮存溶液:称取0.6601g三氧化二砷(≥99.9%,预先在烘箱中烘两小时100-110℃)于100ml烧杯中,加入20ml10%的氢氧化钠溶液(3.2.6),溶解后移入500ml容量瓶中用水稀释至200ml,加2滴酚酞指示剂以盐酸中和并过量2滴用水稀释至刻度,混匀。

保险丝中铅含量的测定通过利用EDTA可与铅发生络合反应,形成络合物。
本实验采用络合滴定法测定保险丝中的铅含量。
实验过程中,掌握掩蔽剂在络合滴定中的应用,并且了解保险丝的溶样方法,安排合理的实验操作,较准确地测定出铅含量。
标签:保险丝;铅含量1 引言铅在制造行业应用广泛。
它虽然是一种重要的工業原料,却也是有毒的重金属。
保险丝中就含有一定量的铅,主要利用的是它熔点低的物理性质。
保险丝一般来说其主要成分为铅和少量的Cu,Sb等元素。
常用EDTA标准溶液滴定可测出铅的含量:实验环境应在酸性溶液中,先将少量的Cu,Sb元素掩蔽,避免干扰。
我们常采用的掩蔽剂为硫脲和氟化铵,硫脲掩盖Cu,NH4F 掩蔽Sb。
然后将保险丝试样在酸性溶液溶解,利用络合反应铅能与EDTA在络合滴定过程中形成络合物,以甲基橙作为指示剂指示滴定终点。
实验中,必须要用六次甲基四氨调节试液pH=5-6。
2 实验试剂①EDTA标准溶液(0.01mol/L);②锌标准溶液(0.01mol/L);③HNO3(5mol/L);④二甲酚橙(5g/L);⑤六次甲基四氨(200/L);⑥NH4F(固体);⑦硫脲(固体);⑧甲基红指示剂(2g/L)乙醇溶液;⑨铬黑T(5g/L);⑩氨水溶液。
3 实验步骤3.1 0.01mol/L EDTA溶液的标定用移液管移取锌标准溶液1.00mL于锥形瓶中,加入1滴甲基红指示剂,再加入适量氨水至溶液呈现微黄色,加入1mL氨性缓冲溶液,3mL蒸馏水,振荡使其混合均匀。
然后加1滴铬黑T指示剂,用待标定的EDTA溶液滴定,滴定终点为至溶液呈纯蓝色。
平行标定3次,并且记录每次所消耗EDTA标准溶液的体积,计算EDTA的浓度。
3.2 保险丝中铅含量的测定准确称取0.5g左右的保险丝试样,加入20mL 5mol/L HNO3溶液溶解试样,并且要加热微沸至完全溶解,然后冷却一段时间到室温,将所得试液全部转入250mL容量瓶中,用蒸馏水稀释至刻度线,振荡使其混合均匀,静置一段时间。
铅及铅合金化学分析方法第部分:镁量、钠量的测定火焰原子吸收光谱法警告——使用本标准的人员应有正规实验室工作的实践经验。
本标准并未指出所有可能的安全问题。
使用者有责任采取适当的安全和健康措施,并保证符合国家有关法规规定的条件。
1 范围本部分规定了铅及铅合金中镁量、钠量的测定方法。
本部分适用于铅及铅合金中镁量、钠量的测定。
测定范围:Mg:0.0005%~0.005%、Na:0.0005%~0.005%。
2 方法原理试料用硝酸—酒石酸混合溶液溶解。
在硝酸锶溶液介质中,使用空气—乙炔火焰,于原子吸收光谱仪波长285.2nm、589.0 nm处,分别测量镁、钠的吸光度,以标准曲线法计算镁量、钠量。
3 试剂除非另有说明,在分析中仅使用确认为分析纯的试剂和蒸馏水或去离子水或相当纯度的水。
3.1 硝酸(ρ1.40g/m L),高纯3.2 酒石酸,优级纯3.3 硝酸锶,优级纯3.4 硝酸溶液(1+3)3.5 硝酸溶液(1+2)3.6 硝酸—酒石酸混合溶液:称取10g酒石酸(3.2),溶于100ml硝酸(3.4)中,混匀3.7 硝酸锶溶液(100g/L)3.8 标准溶液3.8.1 镁标准贮存溶液:称取0.1000g金属镁(99.99%)于250mL烧杯中,加入10mL硝酸(3.5),加热至完全溶解,煮沸驱除氮的氧化物,取下,冷却,移入1000mL容量瓶中,用水稀释至刻度,混匀。
此溶液1mL含100µg镁。
3.8.2 镁标准溶液:移取10.00m L镁标准贮存溶液(3.8.1)于100mL容量瓶中,用水稀释至刻度,混匀。
此溶液1m L含10µg镁。
3.8.3 钠标准贮存溶液:称取0.2305g预先在120℃烘 lh的碳酸钠于250mL烧杯中,加入15mL硝酸(3.5),待溶解完全后,移入1000mL容量瓶中,以水定容。
此溶液含1mL含100µg钠。
3.8.4 钠标准溶液:移取10.00mL钠标准贮存溶液(3.8.3)于100m L容量瓶中,用水稀释至刻度,混匀。
铅的测定二、试剂1、盐酸(ρ=1.19),优级纯2、盐酸1+1,1+10,5+953、硝酸(ρ=1.42),优级纯4、硫酸(ρ=1.84),优级纯;1+1005、磷酸(ρ=1.70),优级纯6、氢氧化铵(ρ=0.90),优级纯;1+107、氯化锶溶液 1.5% 称取3g氯化锶(SrCl2•6H2O)溶于水中并稀释至200ml,混匀8、碳酸钾(优级纯)溶液10%9、乙酸—乙酸钠缓冲溶液(pH5.3)称取116g乙酸钠(CH3COONa•3H2O)溶于水,加10ml冰乙酸,稀释至1L,混匀,于pH计上调节pH为5.310、百里酚蓝溶液0.1%,用乙醇(1+4)配制11、抗坏血酸溶液1%,用时现配12、亚铁氰化钾溶液0.1%,用时现配13、氟化铵溶液0.5%14、二甲酚橙溶液0.05%15、铅标准溶液称取0.5000g纯铅(99.99%),置于200ml烧杯中,加20ml 硝酸(1+1)溶解,煮沸驱除氮氧化物,冷却至室温。
然后移入1000ml容量瓶中,用水稀释至刻度,摇匀。
此溶液1ml含铅0.50mg。
移取20.00ml铅标准溶液(0.50mg/ml),置于1000ml量瓶中,用水稀释至刻度,混匀。
此溶液1ml含铅10μg。
四、分析步骤称取试样(铅含量%:0.0005~0.0010称2.0000g;>0.0010~0.0100,称1.0000g;>0.0100~0.0500,称0.5000g;>0.0500~0.1000,称0.2000g;>0.1000~0.2500,称0.1000g)2.0000~0.1000g,置于300ml石英或是不含铅的烧杯中,根据称样量加入15~70ml适宜比例的盐酸(ρ=1.19)、硝酸(ρ=1.42)混合酸,缓慢加热溶解;取下稍冷,加入浓磷酸10ml,硫酸(ρ=1.84)20ml,混匀。
于电热板上加热至冒硫酸烟,取下冷却。
加水溶解盐类,稀释至体积150ml,加热煮沸,在不断搅拌下,加入10ml氯化锶溶液(1.5%)煮沸2~5min,于低温电热板上保温1h后,冷却至室温。
铅、镉、砷、汞、铜测定方法本法系采用原子吸收分光光度法测定中药中的铅、镉、砷、汞、铜,所用仪器应符合使用要求(附录ⅤD)。
除另有规定外,按下列方法测定。
1.铅的测定(石墨炉法)测定条件参考条件:波长283.3nm,干燥温度100~120℃,持续20秒;灰化温度400~750℃,持续20~25秒;原子化温度1700~2100℃,持续4~5秒。
铅标准储备液的制备精密量取铅单元素标准溶液适量,用2%硝酸溶液稀释,制成每1ml含铅(Pb)lμg的溶液,即得(0~5℃贮存)。
标准曲线的制备分别精密量取铅标准储备液适量,用2%硝酸溶液制成每1ml分别含铅0ng,5ng,20ng,40ng,60ng,80ng的溶液。
分别精密量取1ml,精密加含1%磷酸二氢铵和0.2%硝酸镁的溶液0.5ml,混匀,精密吸取20μl注入石墨炉原子化器,测定吸光度,以吸光度为纵坐标,浓度为横坐标,绘制标准曲线。
供试品溶液的制备A法取供试品粗粉0.5g,精密称定,置聚四氟乙烯消解罐内,加硝酸3~5ml,混匀,浸泡过夜,盖好内盖,旋紧外套,置适宜的微波消解炉内,进行消解(按仪器规定的消解程序操作)。
消解完全后,取消解内罐置电热板上缓缓加热至红棕色蒸气挥尽,并继续缓缓浓缩至2~3ml,放冷,用水转入25ml量瓶中,并稀释至刻度,摇匀,即得。
同法同时制备试剂空白溶液。
B法取供试品粗粉1g,精密称定,置凯氏烧瓶中,加硝酸-高氯酸(4:1)液合溶液5~10ml,混匀,瓶口加一小漏斗,浸泡过夜。
置电热板上加热消解,保持微沸,若变棕黑色,再加硝酸-高氯酸(4:1)混合溶液适量,持续加热至溶液澄明后升高温度,继续加热至冒浓烟,直至白烟散尽,消解液呈无色透明或略带黄色,放冷,转入50ml量瓶中,用2%硝酸溶液洗涤容器,洗液合并于量瓶中,并稀释至刻度,摇匀,即得。
同法同时制备试剂空白溶液。
C法取供试品粗粉0.5g,精密称定,置瓷坩埚中,于电热板上先低温炭化至无烟,移入高温炉中,于500℃灰化5~6小时(若个别灰化不完全,加硝酸适量,于电热板上低温加热,反复多次直至灰化完全),取出冷却,加10%硝酸溶液5ml使溶解,转入25ml量瓶中,用水洗涤容器,洗液合并于量瓶中,并稀释至刻度,摇匀,即得。
铅药品中可能存在的铅要严格控制含量。
有两种检查方法,下文介绍的一种方法需要用双硫腙溶液提取铅。
一般测定重金属含量时,以铅的含量代表重金属含量,见重金属<231>。
选择本检查法需用的试剂,其含量要尽可能地低,并将试剂贮存在硼硅玻璃的容器中。
将所有的玻璃器皿用温的稀硝酸(1:2)冲洗,然后再用水冲洗。
特殊试剂——氰化铵溶液——取氰化钾2g溶于15ml氯化铵溶液中,加水稀释至100ml。
枸橼酸铵溶液——取枸橼酸40g溶于90ml水中,加入2~3滴酚红试液,然后小心地加入氯化铵溶液至溶液呈现淡红色。
多次加入20ml双硫腙提取液(如下)萃取溶液以除去可能存在的铅,至双硫腙溶液保持黄绿色不变。
稀释的标准铅溶液——精密量取一定体积的标准铅溶液(见重金属<231>)[每ml含10µg铅],用9倍体积的稀硝酸(1:100)稀释,使1ml溶液含有1µg铅。
双硫腙提取液——取双硫腙30mg荣誉1000ml氯仿中,加入5ml乙醇。
将溶液贮存在冰箱中。
在使用前取一定体积的双硫腙提取液,加入其体积一半的稀硝酸(1:100)振摇,然后将硝酸舍弃。
盐酸羟胺——取盐酸羟胺20g溶于适量水中,使体积约成65ml。
将溶液转移到分液漏斗中,加入5滴百里酚蓝试液,然后滴加氯化铵至溶液呈现黄色。
加入10ml二乙胺基二硫代甲酸钠溶液(1:25),摇匀,在暗处放置5分钟。
连续用10~15ml氯仿萃取溶液至用硫酸铜试液与5ml氯仿萃取液振摇时不再呈现黄色。
再滴加3N盐酸至溶液呈粉红色(如有必要,再加入1~2滴百里酚蓝试液),然后用水稀释至100ml。
氰化钾溶液——取氰化钾50g用适量水溶解至100ml。
按上述枸橼酸铵溶液操作,用双硫腙提取液分次连续地萃取溶液以除去铅,然后加入氯仿振摇萃取氰化钾溶液中的双硫腙。
最后用适量水稀释氰化钾溶液使每100ml溶液含有10g氰化钾。
标准双硫腙溶液——取双硫腙10mg溶于1000ml氯仿中。
固相萃取柱铅含量测定
固相萃取柱是一种用于提取和富集目标化合物的技术。
在铅含量测定中,固相萃取柱可以用来从样品中富集铅,以便进行后续的分析和测定。
以下是固相萃取柱铅含量测定的一般步骤:
1. 样品准备:将待测样品准备好,可以是水样、土壤样品或其他样品,其中含有铅。
2. 固相萃取柱准备:选择适合铅富集的固相萃取柱,如阳离子交换树脂柱。
将柱装入适合的柱架中,并根据厂家说明进行预处理。
3. 样品处理:将样品通过滤纸或其他过滤器进行预处理,以去除固体颗粒或杂质。
将处理后的样品溶液注入固相萃取柱中。
4. 铅富集:通过样品溶液在固相萃取柱中的流动,铅离子会与柱中的固相吸附剂发生相互作用,使铅富集在固相吸附剂上。
5. 洗脱:用适当的洗脱剂将富集的铅从固相吸附剂上洗脱下来。
洗脱剂的选择取决于实验需求和后续分析方法。
6. 铅浓度测定:将洗脱得到的铅溶液进行后续分析和测定。
常用的测定方法包括原子吸收光谱法、原子荧光光谱法等。
需要注意的是,固相萃取柱的选择和实验条件的优化需要根据具体
的实验要求进行调整。
此外,实验中应该严格遵守安全操作规程,以确保实验人员和环境的安全。
铅的检测方法铅的检测方法一、滴定法:原理:将一种已知准确浓度的试剂溶液,滴加到被测物质的溶液中,根据试剂溶液的浓度和用量,计算被测物质的含量。
例1:用盐酸-硝酸混合酸溶解试样,加入一定量的氯化钠防止铅析出,用氯化钠和盐酸稀释液稀释,在微酸性溶液中,用EDTA 滴定法测定铅的含量。
例2:使Pb生成PbSO4沉淀与其它元素分离,在pH值5.5~6.0的醋酸-醋酸钠(铵)缓冲液中,使PbSO4转化为Pb(Ac)2,以二甲酚橙为指示剂,用EDTA标准溶液滴定。
(本法泛用于原矿、尾矿、精矿中含量在0.5以上的Pb)二、分光光度法:原理:分光光度法是通过测定被测物质在特定波长处或一定波长范围内光的吸光度或发光强度,对该物质进行定性和定量分析的方法。
基本定律是朗伯比尔定律。
例:以二溴羟基苯基卟啉为显色剂,配合物最大吸收波长为479nm,在最佳实验条件下绘制标准曲线,在0.06~1.00mg/ml范围内呈线性相关,线性回归方程为y=0.894x-0.022,相关系数为0.9994,摩尔吸光系数ε=2.8×105L·mol-1·cm-1,方法检出限为0.02ug/ml。
三、双波长分光光度法:双波长分光光度法是在传统分光光度法的基础上发展起来的,它的理论基础是差吸光度和等吸收波长。
它与传统分光光度法的不同之处,在于它采用了两个不同的波长即测量波长和参比波长同时测定一个样品溶液,以克服单波长测定的缺点,提高了测定结果的精密度和准确度。
四、双硫腙分光光度法:原理:双硫腙分光光度法是以双硫腙为螯合剂,使之与金属离子反应生成带色物质,而后用分光光度法测定该金属离子的方法。
这是环境监测中常用的一种间接、萃取分光光度法,是测定铅的常用方法,是基层单位经常采用的方法。
例:在水质标准中,采用双硫腙分光光度法对铅的测定:在pH为8.5-9.5的氨性柠檬酸盐-氰化物的还原性介质中,铅与双硫腙形成可被氯仿萃取的淡红色双硫腙铅螯合物,在510nm波长处可进行分光光度测定,从而求出铅的含量。
一.实验目的
1.掌握保险丝的溶样方法。
2.进一步巩固掩蔽剂在络合滴定中的应用。
二.实验原理
一般的保险丝主要成分为铅及少量的Cu ,Sb 等。
用酸溶解反应式如下:
O H 4NO 2)NO (Pb 3HNO 8Pb 32233+↑+=+
然后,在络合滴定中都能用EDTA 形成络合物,我们在酸性溶液仲采用硫脲掩蔽Cu ,NH 4F 掩蔽Sb ,六次甲基四胺调节试液pH=5~6,二甲酚橙为指示剂,用EDTA 滴定可测定出铅的含量。
三.主要试剂
EDTA 标准溶液,1
L •5mol -HNO 3,二甲酚橙指示剂,六次甲基四胺,NH 4F (s ),硫脲(s ) 四.实验步骤
称取保险丝0.2g ,加入5mL 1
L •5mol -HNO 3,盖上表面皿,加热微沸至溶解,冷却后定容100mL 。
移取上述溶液20mL 至250mL 锥形瓶,加水20mL 、1g 硫脲、1g NH 4F ,60~70℃保温2min ,冷却后加入2~3滴二甲酚橙,滴加约4mL 六次甲基四胺溶液,至出现稳定紫红色,再过量5mL ,用EDTA 标准溶液滴定至溶液有红色变为亮黄色即为终点。
五.数据记录
六.分析讨论
1.上周配制的EDTA 溶液用完后,放在柜中,今周却不翼而飞。
因此只好借用同学的EDTA 溶液,考
察过其上周EDTA 溶液标定中相对偏差较小,因而选用其EDTA 标准溶液,但其准确浓度不得而知。
2.滴定中由于对二甲酚橙由橙色变成亮黄色的变化不够敏锐,可能导致%/)Pb (ω偏大。
七.思考题
1.简述二甲酚橙的变色原理
答:二甲酚橙与溶液中的铅离子结合,形成红色络合物,使溶液显红色。
用EDTA 滴定到终点后,EDTA
与全部铅离子结合生成比二甲酚橙-铅离子更稳定的络合物,游离出指示剂,使溶液呈亮黄色。
2.溶解保险丝时能否用HCl 和H 2SO 4,为什么?
答:不能,因为溶解后生成的硫酸铅是难溶物,不能进行滴定。