各类元素离子半径最全版
- 格式:doc
- 大小:408.51 KB
- 文档页数:11

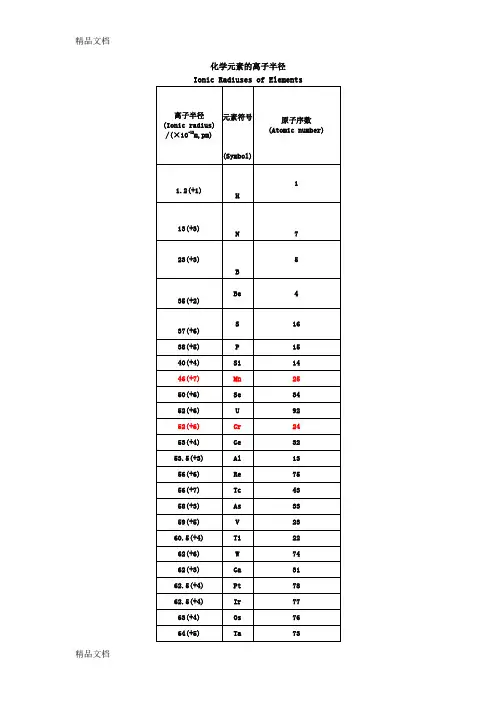
(除注明外均为六配位,非六配位时以上标标注,如+34。
ls=低自旋,hs=高自旋。
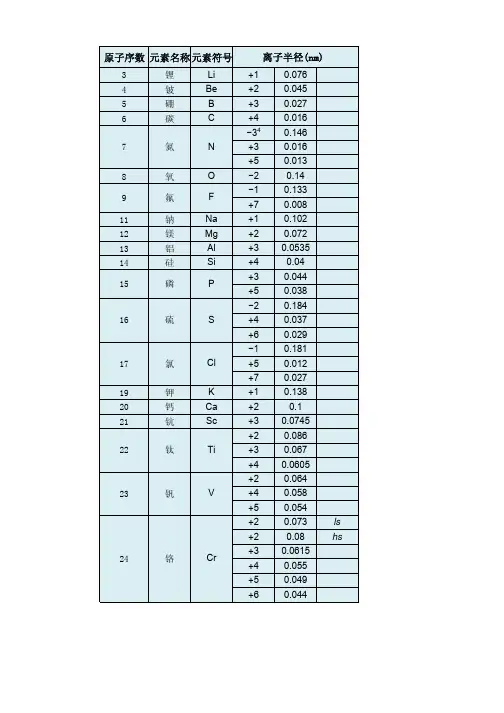
[2])原子序数 元素名称元素符号离子半径pm3 锂Li +1764 铍Be +2455 硼 B +3276 碳 C +4167 氮N −34 146 +316 +5138 氧O −21409 氟 F −1133 +7811 钠Na +110212 镁Mg +27213 铝Al +353.514 硅Si +44015 磷P +344 +53816 硫S −2184 +437 +62917 氯Cl −1181+512+727(除注明外均为六配位,非六配位时以上标标注,如+34。
ls=低自旋,hs=高自旋。
[2])原子序数元素名称元素符号离子半径pm19钾K +113820钙Ca+210021钪Sc+374.522钛Ti+286+367+460.523钒V+264+458+55424铬Cr+273 ls+280 hs+361.5+455+549+64425锰Mn+267+358 ls+364.5hs+453+5433+6425.5+74626铁Fe+261 ls+278 hs+355 ls(除注明外均为六配位,非六配位时以上标标注,如+34。
ls=低自旋,hs=高自旋。
[2])原子序数元素名称元素符号离子半径pm+3 64.5 hs+4 58.5+642527钴Co+265 ls+274.5 hs+354.5 ls+361 hs+45328镍Ni+269+356 ls+360 hs+448 ls29铜Cu+177+273+354 ls30锌Zn +27431镓Ga +36232锗Ge+273+45333砷As+358+54634硒Se −2198(除注明外均为六配位,非六配位时以上标标注,如+34。
ls=低自旋,hs=高自旋。
[2])原子序数 元素名称元素符号离子半径pm+450+64235 溴Br −1196 +34sq59 +5431 +73937 铷Rb +115238 锶Sr +211839 钇Y +39040 锆Zr +47241 铌Nb +372 +468 +56442 钼Mo +369 +465 +561 +65943 锝Tc +464.5 +560 +75644 钌Ru +3 68+4 62+5 56.5+7438(除注明外均为六配位,非六配位时以上标标注,如+34。

元素离子半径表图
元素离子半径表图是一张分类表,列举了元素的离子半径大小。
离子半径是指离子的半径大小,通常用来描述以离子为中心的化合物
中原子间的距离,也是制定分子结构的基础性参数之一。
离子的大小取决于其原子的大小、价电子对的数量和核电荷的大小。
离子半径可以在周期表中查看,并以离子的电荷和离子所处的同
一周期和族之间的关系为基础进行排列和分类。
在元素离子半径表图中,通常呈现两种不同类型的离子:阳离子
和阴离子。
阳离子是带正电荷的离子,它们通常比原子更小,因为它
们会失去外层电子,而这些电子在屏蔽效应下受到更多的吸引力,所
以离子半径变小。
阴离子是带负电荷的离子,它们通常比原子更大,
因为它们会获得多余的电子,这些电子在屏蔽效应下呈现出推斥作用,导致离子半径变大。
元素离子半径表图的重要性不言而喻。
它为化学家提供了非常重
要的信息,有助于在化学实验和制定分子结构时,能够更准确地掌握
离子半径的大小,并根据需要进行相应的操作。
虽然元素离子半径表图只是一个简单的分类表,但它却为整个化
学领域提供了许多基础性的信息,并且在未来的研究中仍将发挥重要
作用。

各类元素离子半径最全版
元素离子半径是指化学元素以及它的离子存在时存在的原子核外围的平均半径。
它由电离度、半径幅度和氧化数决定,能反映物质特性。
一、阳离子半径
1、一价阳离子(Li+、Na+、K+、Rb+、Cs+):这些离子只有一个价,它们的离子半径为:Li+的半径0.76Å,Na+的半径1.02Å,K+的半径1.33Å,Rb+的半径1.48Å,Cs+的半径1.67Å。
3、三价阳离子(Fe3+、Al3+):这些离子具有三个电荷,其半径为:Fe3+的半径0.64Å,Al3+的半径0.51Å。
2、二价阴离子(O2-、S2-):这些离子具有两个负电荷,它们的离子半径分别是:O2-的半径1.30Å,S2-的半径1.84Å。
1、氫离子(H+):氫离子只有一个电荷,其离子半径为0.37Å。
总之,元素离子半径是物质特性的重要反映,它可以帮助我们更好地理解化学元素和它们的离子。

∙0.001 纳米(nm) = 1 皮米 pm(皮米) ∙0.000 001 微米(µm) = 1 皮米∙0.000 000 001 毫米(mm) = 1 皮米∙ 1 000 皮米 = 1 纳米(nm)∙ 1 000 000 皮米 = 1 微米(µm)∙ 1 000 000 000 皮米 = 1 毫米(mm)∙ 1 000 000 000 000 皮米 = 1 米(m)离子半径数据(除注明外均为六配位,非六配位时以上标标注,如+34。
ls =低自旋,hs=高自旋。
[2])原子序数元素名称元素符号离子半径pm3 锂Li +1764 铍Be +2455 硼 B +3276 碳 C +4167 氮N −34 146 +316 +5138 氧O −21409 氟 F −1133 +7811 钠Na +110212 镁Mg +27213 铝Al +353.514 硅Si +44015 磷P +344 +53816 硫S −2184+437+62917 氯Cl−1181+512+72719 钾K +113820 钙Ca +210021 钪Sc +374.522 钛Ti+286+367+460.523 钒V+264+458+55424 铬Cr+273 ls+280 hs+361.5+455+549+64425 锰Mn+2 67+3 58 ls+3 64.5 hs+4 53+5433+6425.5+7 4626 铁Fe +2 61 ls- 1 -+2 78 hs +3 55 ls +3 64.5hs +4 58.5+642527 钴Co +265 ls +274.5hs +354.5ls +361 hs +45328 镍Ni +269+356 ls +360 hs +448 ls29 铜Cu +177+273+354 ls30 锌Zn +27431 镓Ga +36232 锗Ge +273 +45333 砷As +358 +54634 硒Se −2198 +450 +64235 溴Br −1196+34sq59+5431+73937 铷Rb +115238 锶Sr +211839 钇Y +39040 锆Zr +47241 铌Nb+372+468+56442 钼Mo+369+465+561+65943 锝Tc+464.5+560+75644 钌Ru+3 68+4 62+5 56.5+7438+843645 铑Rh+366.5+460+55546 钯Pd+1259+2 86+3 76+4 61.547 银Ag+1115+294+37548 镉Cd +29549 铟In +38050 锡Sn +2112- 2 -+46951 锑Sb +376 +56052 碲Te −2221 +497 +65653 碘I −1220 +595 +75354 氙Xe +84855 铯Cs +116756 钡Ba +213557 镧La +3103.258 铈Ce +3102 +48759 镨Pr +399 +48560 钕Nd +28129 +3 98.361 钷Pm +39762 钐Sm +24122 +3 95.863 铕Eu +2117 +394.764 钆Gd +393.865 铽Tb +392.3 +47666 镝Dy +2107 +391.267 钬Ho +390.168 铒Er +38969 铥Tm+2103+38870 镱Yb+2102+386.871 镥Lu +386.172 铪Hf +47173 钽Ta+372+468+56474 钨W+466+562+66075 铼Re+463+558+655+75376 锇Os+4 63+5 57.5+6 54.5+7 52.5+843977 铱Ir+368+462.5+55778 铂Pt+286+462.5+55779 金Au+1137+385+55780 汞Hg +1119- 3 -+210281 铊Tl +1150 +388.582 铅Pb +2119 +477.583 铋Bi +3103 +57684 钋Po +494 +66785 砹At +76287 钫Fr +118088 镭Ra +2814889 锕Ac +311290 钍Th +49491 镤Pa +3104 +490 +57892 铀U +3102.5+489+578+67393 镎Np+2110+3101+487+575+672+77194 钚Pu+3100+486+574+67195 镅Am+28126+3 97.5+4 8596 锔Cm+397+48597 锫Bk+396+48398 锎Cf+395+482.1[编辑] 参见原子半径[编辑] 参考文献1.^Pauling, L.(1960). The Nature of the Chemical Bond(3rd Edn.). Ithaca,NY: Cornell University Press.2.^ 2.0 2.1Shannon, R.D.. Revised effective ionic radii and systematic studiesof interatomic distances in halides and chalcogenides. Acta. Cryst. A.1976, 32: 751–767. doi:10.1107/S0567739476001551.3.^ 通常来讲,Ag+(129 pm)的离子半径事实上比Na+(116 pm)的大。
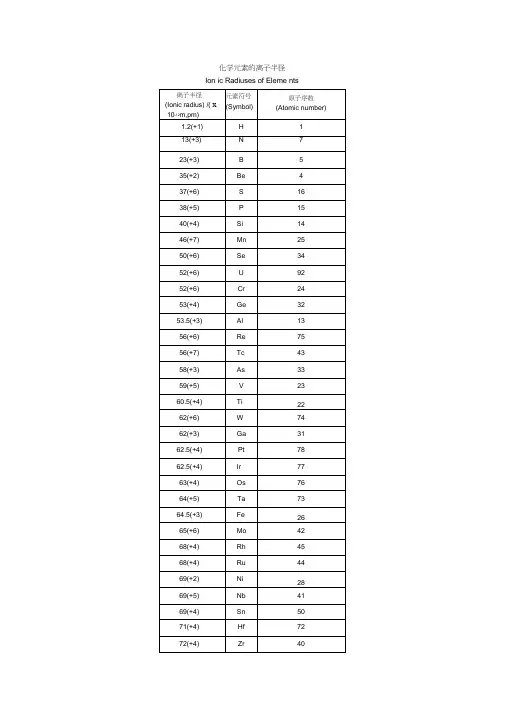
化学元素的离子半径Ion ic Radiuses of Eleme nts离子半径数据(除注明外均为六配位,非六配位时以上标标注, 如+34。
Is =低自旋,hs=高自旋。
⑵)原子序数因元素名称回元素符号回离子半径pmHl3 锂Li +1 764 铍Be +2 455 硼 B +3 276 碳 C +4 16-34 146 7 氮N +3 16+5 13 8 氧O -2 140氟-1 1339 F+7 811 钠Na +1 10212 镁Mg +2 7213 铝Al +3 53.514 硅Si +4 40+3 4415 磷P+5 38硫S +4 37+6 29-1 181 氯Cl +5 12+7 27 钾K +1 138 钙Ca +2 100-2 184钪ScTi 铬CrMn 铁Fe +3 74.5+2 86+3 67+4 60.5+2 64+4 58+5 54+2 73 Is+2 80 hs +3 61.5+4 55+5 49+6 44+2 67+3 58 ls+3 64.5 hs +4 53+54 33+64 25.5+7 46+2 61 ls +2 78 hs +3 55 ls16171920212223242526+3 64.5 hs27 钴Co +4 58.5+64 25+2 65 ls +2 74.5 hs +3 54.5 ls28 镍Ni +3 61 hs +4 53+26+3 56 ls29 铜Cu +3 60 hs +4 48 ls7+17+2730 锌Zn +3 54 ls +2 7431 傢Ga +3 6232 锗Ge+2 7333 砷As +4 53 +3 5834 硒Se +5 46 -2 198 +4 5035 溴Br +6 42-1 196 +34sq 59437 铷Rb +5 31 +7 39+1 15238 锶Sr +2 11839 钇Y +3 9040 锆Zr +4 72+3 72 41 铌Nb +4 68+5 64+3 69钼+4 6542 Mo+5 61+6 59+4 64.5 43 锝Tc +5 60+7 56+3 68+4 62 44 钌Ru +5 56.5+74 38+84 36+3 66.5 45 铑Rh +4 60+5 55+1259钯+2 8646 Pd+3 76+4 61.5+1 115 47 银Ag +2 94+3 75 48 镉Cd +2 95铟In +3 80锡+2 112 Sn+4 69锑+3 76 Sb+5 60-2 221碲Te +4 97+6 56-1 220 碘I +5 95+7 53 氙Xe +8 48铯Cs +1 167 钡Ba +2 135 镧La +3 103.2铈+3 102 Ce+4 87+3 99错Pr+4 85钕8+2 129 Nd+3 98.3钷Pm +3 97钐4+2 122 Sm+3 95.8铕+2 117 Eu+3 94.749505152535455565758596061626364钆Gd+3 93.8铽+3 92.3 65Tb+4 76镝+2 107 66Dy+3 91.267 钬 Ho +3 90.1 68铒Er+3 89铥+2 10369Tm+3 88镱+2 10270Yb+3 86.8 71 镥 Lu +3 86.1 72铪Hf+4 71+3 72 73钽Ta+4 68+5 64+4 6674钨W+5 62+6 60+4 63 铼+5 5875Re+6 55+7 53+4 63+5 57.5 76 锇Os+6 54.5+7 52.5 +84 39+3 68 77 铱Ir +4 62.5+5 57+2 86 78 铂Pt +4 62.5+5 57+1 137 79 金Au +3 85+5 57+1 119 80 汞Hg +2 102铊+1 15081Tl+3 88.5 铅+2 11982Pb+4 77.5 铋+3 10383 Bi+5 76钋+4 9484 Po+6 67 85 砹At +7 6287 钫Fr +1 18088 镭Ra +2814889 锕Ac +3 11290 钍Th +4 94+3 104 91 镤Pa +4 90+5 78+3 102.5铀+4 8992 U+5 78+6 73+2 110+3 101镎+4 8793 Np+5 75+6 72+7 71+3 100+4 86 94 钚Pu+5 74+6 71+28126 95 镅Am +3 97.5+4 85锔+3 9796 Cm+4 85锫+3 9697 Bk+4 83锎+3 9598 Cf+4 82.1。

1—36号元素离子半径1. 介绍离子半径的概念和意义离子半径是指离子在晶体中所占据的空间大小,是离子的一个重要物理性质。
离子半径的大小与离子的电荷、电子层排布和晶体结构有关。
离子半径的研究对于理解化学反应、晶体结构和物质性质具有重要意义。
2. 1号元素氢的离子半径氢原子的离子半径很小,约为37.1 pm。
这是因为氢原子只有一个电子,电子云较为紧密包围在核周围,所以离子半径很小。
3. 2号元素氦的离子半径氦原子的离子半径也很小,约为32.0 pm。
与氢原子类似,氦原子只有两个电子,电子云也较为紧密包围在核周围。
4. 3号元素锂的离子半径锂原子失去一个电子形成Li+离子,离子半径约为76.4 pm。
锂离子的离子半径较大,是因为其核电荷仍然很小,电子云的排布比较松散。
5. 4号元素铍的离子半径铍原子失去两个电子形成Be2+离子,离子半径约为45.0 pm。
铍离子的离子半径较小,是因为铍原子的核电荷比较大,电子云较紧密。
6. 5号元素硼的离子半径的离子半径很小,是因为其核电荷很大,电子云非常紧密。
7. 6号元素碳的离子半径碳原子失去四个电子形成C4+离子,离子半径约为16.3 pm。
碳离子的离子半径非常小,是因为其核电荷非常大,电子云非常紧密。
8. 7号元素氮的离子半径氮原子失去三个电子形成N3-离子,离子半径约为171 pm。
氮离子的离子半径较大,是因为其核电荷相对较小,电子云的排布比较松散。
9. 8号元素氧的离子半径氧原子失去两个电子形成O2-离子,离子半径约为140 pm。
氧离子的离子半径较大,是因为核电荷较小,电子云排布较松散。
10. 9号元素氟的离子半径氟原子失去一个电子形成F-离子,离子半径约为133 pm。
氟离子的离子半径较大,是因为其核电荷相对较小,电子云的排布比较松散。
11. 10号元素氖的离子半径氖原子失去两个电子形成Ne2+离子,离子半径约为154 pm。
氖离子的离子半径较大,是因为其核电荷较小,电子云排布较松散。