2017年化学高考题分项版汇编题02 化学计量与化学计算
- 格式:doc
- 大小:278.50 KB
- 文档页数:9

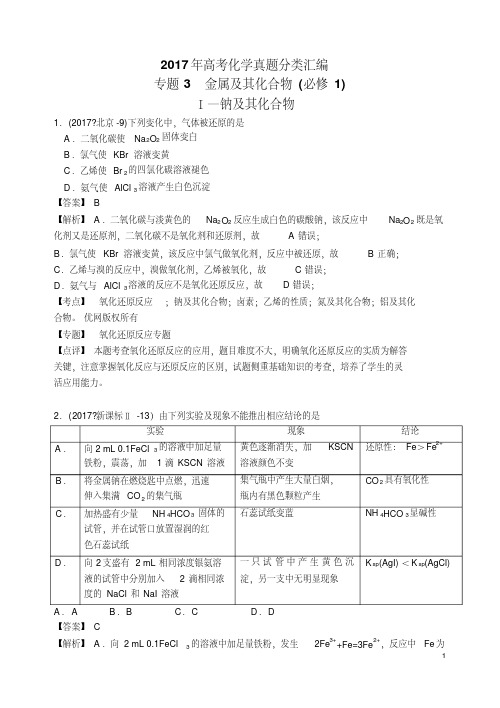
2017 年高考试题,1.【 2017 新课标 1 卷】( 15 分)凯氏定氮法是测定蛋白质中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐,然后通过滴定测量。
已知:NH3+H3BO3=NH3·H3BO3;NH3·H3BO3+HCl= NH4Cl+ H 3BO3。
回答下列问题:(1)a 的作用是 _______________ 。
(2)b 中放入少量碎瓷片的目的是 ____________ 。
f 的名称是 __________________ 。
(3)清洗仪器: g 中加蒸馏水;打开 k1,关闭 k2、k3,加热 b,蒸气充满管路;停止加热,关闭k1,g 中蒸馏水倒吸进入c,原因是 ____________ ;打开 k2放掉水,重复操作2~3 次。
( 4)仪器清洗后,g 中加入硼酸(H3BO3)和指示剂。
铵盐试样由 d 注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭k3,d 中保留少量水。
打开k1,加热b,使水蒸气进入e。
①d中保留少量水的目的是 ___________________ 。
② e 中主要反应的离子方程式为________________ , e 采用中空双层玻璃瓶的作用是________。
( 5)取某甘氨酸(2 52 –1的盐C H NO)样品m克进行测定,滴定g 中吸收液时消耗浓度为c mol·L酸V mL,则样品中氮的质量分数为_________%,样品的纯度≤_______%。
【答案】(1)避免 b 中压强过大( 2)防止暴沸 直形冷凝管 ( 3) c 中温度下降,管路中形成负压( 4)①液封,防止氨气逸出② NH+ -△ NH 3↑+H 2O 保温使氨完全蒸出4+OH=====( 5) 1.4cV7.5cV mm( 4)①氨气是气体,因此 d 中保留少量水的目的是液封,防止氨气逸出。
②e 中主要反应是铵盐与碱在加热条件下的反应,离子方程式为+-△NH 4 +OH ===== NH ↑+H O ;e 采用中空双层玻璃瓶的32作用是保温减少热量损失,有利于铵根转化为氨气逸出。

专题02 化学计量与化学计算1.[2019新课标Ⅱ] 已知N A 是阿伏加德罗常数的值,下列说法错误的是A .3 g 3He 含有的中子数为1N AB .1 L 0.1 mol·L −1磷酸钠溶液含有的34PO -数目为0.1N AC .1 mol 2Cr 2O 7被还原为Cr 3+转移的电子数为6N AD .48 g 正丁烷和10 g 异丁烷的混合物中共价键数目为13N A 【答案】B【解析】A .3He 的中子数为3-2=1,则3g 3He 的中子数为3g 3g/mol A N ⨯=N A ,A 项正确; B .磷酸钠为强碱弱酸盐,磷酸根离子在水溶液中会发生水解,则1L 0.1mol/L 的磷酸钠溶液中磷酸根离子的个数小于1L×0.1mol/L×N A mol -1 =0.1N A ,B 项错误; C .重铬酸钾被还原为铬离子时,铬元素从+6降低到+3,1mol 重铬酸钾转移的电子数为3mol×2×N A mol -1 =6N A ,C 项正确;D .正丁烷与异丁烷的分子式相同,1个分子内所含共价键数目均为13个,则48g 正丁烷与10g 异丁烷所得的混合物中共价键数目为48g+10g 58g/mol ×13×N A mol -1 =13N A ,D 项正确; 答案选B 。
2.[2019新课标Ⅲ] 设N A 为阿伏加德罗常数值。
关于常温下pH=2的H 3PO 4溶液,下列说法正确的是A .每升溶液中的H +数目为0.02N AB .c (H +)= c (42H PO -)+2c (24HPO -)+3c (34PO -)+ c (OH −)C .加水稀释使电离度增大,溶液pH 减小D .加入NaH 2PO 4固体,溶液酸性增强 【答案】B【解析】A 、常温下pH =2,则溶液中氢离子浓度是0.01mol/L ,因此每升溶液中H +数目为0.01N A ,A 错误;B 、根据电荷守恒可知选项B 正确;C 、加水稀释促进电离,电离度增大,但氢离子浓度减小,pH 增大,C 错误;D 、加入NaH 2PO 4固体,H 2PO 4-浓度增大,抑制磷酸的电离,溶液的酸性减弱,D 错误;答案选B。

化学·参考答案与解析专题1化学与STSE化学用语1.解析:选C。
PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为可入肺颗粒物,A项正确;绿色化学要求从源头上消除或减少生产活动对环境的污染,B项正确;燃煤中加入CaO,CaO可以与燃烧后生成的二氧化硫反应生成CaSO3,并进一步被氧化为CaSO4,从而减少二氧化硫的排放,因此可以减少酸雨的形成,但燃煤中加入CaO不能减少温室气体的排放,C项错误;天然气和液化石油气完全燃烧的产物是二氧化碳和水,属于清洁燃料,D项正确。
2.解析:选C。
石灰、碳酸钠等碱性物质能与废水中的酸反应,因此可以用于处理废水中的酸,A项正确;可溶性的铝盐和铁盐溶于水,电离出的Al3+、Fe3+水解分别生成Al(OH)3、Fe(OH)3胶体,其可吸附水中的悬浮物质,因此可以处理水中的悬浮物,B项正确;氯气与Cu2+、Hg2+等重金属离子不反应,不能用Cl2处理水中的Cu2+、Hg2+等重金属离子,可用Na2S来处理,C项错误;烧碱能与NH+4反应生成NH3,因此可用烧碱处理含高浓度NH+4的废水并回收利用NH3,D项正确。
3.解析:选C。
空调温度低时,需要消耗大量的电能,A项错误;推广使用一次性塑料袋和纸巾会产生“白色污染”且浪费资源,B项错误;少开私家车,可以减少汽车尾气的排放,C项正确;豪华包装会浪费不必要的材料,D项错误。
4.解析:选A。
P的左上角标质量数,左下角标质子数,A项正确;F原子的最外层有7个电子,B项错误;两个Cl-应放在Ca2+的两侧,C项错误;明矾的化学式为KAl(SO4)2·12H2O,D项错误。
5.解析:选A。
人呼出的CO2可与Na2O2反应生成O2,故可用作呼吸面具供氧剂,A 项正确;ClO2具有氧化性,可用于自来水的杀菌消毒,B项错误;SiO2可用于制造光导纤维的原因是其导光性能好,与硬度无对应关系,C项错误;液氨汽化吸收大量的热是其作制冷剂的原因,D项错误。



专题02 化学计量与化学计算1.【2017新课标2卷】阿伏加德罗常数的值为A N 。
下列说法正确的是A .1L0.1mol·1L -NH 4Cl 溶液中,4NH +的数量为0.1A NB .2.4gMg 与H 2SO 4完全反应,转移的电子数为0.1A NC .标准状况下,2.24LN 2和O 2的混合气体中分子数为0.2A ND .0.1molH 2和0.1molI 2于密闭容器中充分反应后,其分子总数为0.2A N【答案】D【名师点睛】本题考查阿伏加德罗常数的应用,是高考的一个热点,主要从物质结构、水解、转移电子、可逆反应等角度考查,本题相对比较容易,只要认真、细心就能做对,平时多注意这方面的积累。
2.【2017新课标3卷】N A 为阿伏加德罗常数的值。
下列说法正确的是A .0.1mol 的11B 中,含有0.6N A 个中子B .pH=1的H 3PO 4溶液中,含有0.1N A 个H +C .2.24L (标准状况)苯在O 2中完全燃烧,得到0.6N A 个CO 2分子D .密闭容器中1molPCl 3与1molCl 2反应制备PCl 5(g ),增加2N A 个P-Cl 键【答案】A【解析】A .B 的原子序数为5,即质子数为5,在质量数为11的B 原子中含有6个中子,0.1mol 11B含有0.6N A 个中子,A 正确;B .溶液体积未定,不能计算氢离子个数,B 错误;C .标准状况下苯是液体,不能利用气体摩尔体积计算2.24L 苯的物质的量,则无法判断其完全燃烧产生的CO 2分子数目,C 错误;D .PCl 3与Cl 2反应生成PCl 5的反应是可逆反应,反应物不可能完全转化为生成物,则1molPCl 3与1molCl 2反应生成的PCl 5小于1mol ,增加的P -Cl 键的数目小于2N A 个,D 错误。
答案选A 。
【名师点睛】考查与阿伏加德罗常数有关计算时,要正确运用物质的量的有关计算,同时要注意气体摩尔体积的使用条件;另外还要谨防题中陷阱,如讨论溶液里的离子微粒的数目时,要考虑:①溶液的体积,②离子是否水解,③对应的电解质是否完全电离;涉及化学反应时要考虑是否是可逆反应,如选项D涉及可逆反应,反应的限度达不到100%;其它如微粒的结构、反应原理等,总之要认真审题,切忌凭感觉答题。


2017高考化学全国I I卷解析版(总10页)-本页仅作为预览文档封面,使用时请删除本页-2017年普通高等学校招生全国统一考试化学试题(全国II )7.下列说法错误的是A .糖类化合物也可称为碳水化合物B .维生素D 可促进人体对钙的吸收C .蛋白质是仅由碳、氢、氧元素组成的物质D .硒是人体必需的微量元素,但不宜摄入过多 【解析】A.糖类化合物也可称为碳水化合物,是沿用下来的叫法,故A 正确;B.维生素D 可促进人体对钙的吸收,故B 正确;C.蛋白质含有C 、H 、O 、N 、S 等元素,故C 错误;D.硒是人体必需的微量元素,但不宜摄入过多,摄入过多可能会导致脱发等,故D 正确; 【答案】C8.阿伏加德罗常数的值为A N 。
下列说法正确的是A .1 L mol·1L -NH 4Cl 溶液中, 4NH +的数量为A N B . g Mg 与H 2SO 4完全反应,转移的电子数为A NC .标准状况下, L N 2和O 2的混合气体中分子数为A ND . mol H 2和 mol I 2于密闭容器中充分反应后,其分子总数为A N【解析】+能够发生水解,故NH 4+的数量小于,故A 错误;B. g Mg 与H 2SO 4完全反应,转移的电子数为,故B 错误;C.标准状况下,和O 2的混合气体的物质的量为,故混合气体的分子数为;D. H 2 + I 2 2HI ,反应前后气体分子数不变,故其分子总数为,故D 正确; 【答案】D9.a 、b 、c 、d 为原子序数依次增大的短周期主族元素,a 原子核外电子总数与b 原子次外层的电子数相同;c 所在周期数与族数相同;d 与a 同族。
下列叙述正确的是 A .原子半径:d>c>b>aB .4种元素中b 的金属性最强C .c 的氧化物的水化物是强碱D .d 单质的氧化性比a 单质的氧化性强【解析】a 、b 、c 、d 为短周期主族元素,且a 原子核外电子总数与b 原子次外层的电子数相同,故a 为O ,d 与a 同族,故d 为S ,c 所在周期数与族数相同,故c 为Al ,则b 为Na 或Mg ;A.原子半径b >c >d >a ,故A 错误;种元素种b 的失电子能力最强,故其金属性最强,故B 正确; 的氧化物的水化物是氢氧化铝,为两性氢氧化物,故C 错误; 的氧化性强于S ,故D 错误; 【答案】B10.下列由实验得出的结论正确的是A.乙烯和溴发生加成反应生成1,2-二溴乙烷,结论正确,故A 正确;B.乙醇和水都可与金属钠反应产生可燃性气体,但钠反应更剧烈,故乙醇分子中的氢与水分子中的氢活性不同,故B 错误;C.用乙酸浸泡水壶中的水垢,可将其清楚,利用的是强酸制弱酸,故乙酸的酸性强于碳酸,故C 错误;D.甲烷和氯气在光照下反应后的混合气体中含有HCl 能够使湿润的石蕊试纸变红,故D 错误;【答案】A11.用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为24224H SO H C O 混合溶液。


专题02 化学计量与化学计算1.[2019新课标Ⅱ] 已知N A 是阿伏加德罗常数的值,下列说法错误的是 A .3 g 3He 含有的中子数为1N AB .1 L 0.1 mol·L −1磷酸钠溶液含有的34PO -数目为0.1N AC .1 mol 2Cr 2O 7被还原为Cr 3+转移的电子数为6N AD .48 g 正丁烷和10 g 异丁烷的混合物中共价键数目为13N A2.[2019新课标Ⅲ] 设N A 为阿伏加德罗常数值。
关于常温下pH=2的H 3PO 4溶液,下列说法正确的是A .每升溶液中的H +数目为0.02N AB .c (H +)= c (42H PO -)+2c (24HPO -)+3c (34PO -)+ c (OH −)C .加水稀释使电离度增大,溶液pH 减小D .加入NaH 2PO 4固体,溶液酸性增强3.[2018新课标Ⅲ]下列叙述正确的是A .24 g 镁与27 g 铝中,含有相同的质子数B .同等质量的氧气和臭氧中,电子数相同C .1 mol 重水与1 mol 水中,中子数比为2∶1D .1 mol 乙烷和1 mol 乙烯中,化学键数相同4.[2018新课标Ⅱ]N A 代表阿伏加德罗常数的值。
下列说法正确的是 A .常温常压下,124 g P 4中所含P —P 键数目为4N AB .100 mL 1mol·L −1FeCl 3溶液中所含Fe 3+的数目为0.1N AC .标准状况下,11.2 L 甲烷和乙烯混合物中含氢原子数目为2N AD .密闭容器中,2 mol SO 2和1 mol O 2催化反应后分子总数为2N A 5.[2018新课标Ⅰ]N A 是阿伏加德罗常数的值,下列说法正确的是 A .16.25 g FeCl 3水解形成的Fe(OH)3胶体粒子数为0.1 N AB .22.4 L (标准状况)氩气含有的质子数为18N AC .92.0 g 甘油(丙三醇)中含有羟基数为1.0N AD .1.0 mol CH 4与Cl 2在光照下反应生成的CH 3Cl 分子数为1.0N A6.[2018海南]N A 代表阿伏加德罗常数的值,下列说法正确的是A .12 g 金刚石中含有化学键的数目为4N AB .18 g 的D 2O 中含有的质子数为10C .28 g 的乙烯和环已烷混合气体中所含原子总数为6N AD .1 L 1mol·L¯1的NH 4Cl 溶液中NH 4+和Cl −的数目均为1N A 7.[2017浙江11月选考]设N A 为阿伏伽德罗常数的值,下列说法不正确...的是 A .含0.2 mol H 2SO 4 的浓硫酸和足量的镁反应,转移电子数大于0.2 N AB .25 ℃时,pH=3的醋酸溶液1L ,溶液中含H +的数目小于0.001 N AC .任意条件下,1 mol 苯中含有C —H 键的数目一定为6 N AD .a mol 的R 2+(R 的核内中子数为N ,质量数为A )的核外电子数为a (A-N-2)N A8.[2017浙江4月选考]设N A 为阿伏加德罗常数的值,下列说法正确的是A .标准状况下,2.24 L 乙醇中碳氢键的数目为0.5N AB .1 L 0.1 mol·L -1硫酸钠溶液中含有的氧原子数为0.4N AC .0.1 mol I 与0.1 mol FeCl 3在溶液中反应转移的电子数为0.1N AD .0.1 mol 乙烯与乙醇的混合物完全燃烧所消耗的氧分子数为0.3N A9.[2017海南卷]N A 为阿伏加德罗常数的值。
2017年化学高考题分项版汇编题1.【2017新课标2卷】阿伏加德罗常数的值为错误!未找到引用源。
下列说法正确的是A.1L0.1mol·错误!未找到引用源。
NH4Cl溶液中,错误!未找到引用源。
的数量为0.1错误!未找到引用源。
B.2.4gMg与H2SO4完全反应,转移的电子数为0.1错误!未找到引用源。
C.标准状况下,2.24LN2和O2的混合气体中分子数为0.2错误!未找到引用源。
D.0.1molH2和0.1molI2于密闭容器中充分反应后,其分子总数为0.2错误!未找到引用源。
【答案】D【名师点睛】本题考查阿伏加德罗常数的应用,是高考的一个热点,主要从物质结构、水解、转移电子、可逆反应等角度考查,本题相对比较容易,只要认真、细心就能做对,平时多注意这方面的积累。
2.【2017新课标3卷】N A为阿伏加德罗常数的值。
下列说法正确的是A.0.1mol的错误!未找到引用源。
中,含有0.6N A个中子B.pH=1的H3PO4溶液中,含有0.1N A个错误!未找到引用源。
C.2.24L(标准状况)苯在O2中完全燃烧,得到0.6N A个CO2分子D.密闭容器中1molPCl3与1molCl2反应制备PCl5(g),增加2N A个P-Cl键【答案】A【解析】A.B的原子序数为5,即质子数为5,在质量数为11的B原子中含有6个中子,0.1mol11B含有0.6N A 个中子,A正确;B.溶液体积未定,不能计算氢离子个数,B错误;C.标准状况下苯是液体,不能利用2017年高考试题,气体摩尔体积计算2.24L苯的物质的量,则无法判断其完全燃烧产生的CO2分子数目,C错误;D.PCl3与Cl2反应生成PCl5的反应是可逆反应,反应物不可能完全转化为生成物,则1molPCl3与1molCl2反应生成的PCl5小于1mol,增加的P-Cl键的数目小于2N A个,D错误。
答案选A。
【名师点睛】考查与阿伏加德罗常数有关计算时,要正确运用物质的量的有关计算,同时要注意气体摩尔体积的使用条件;另外还要谨防题中陷阱,如讨论溶液里的离子微粒的数目时,要考虑:①溶液的体积,②离子是否水解,③对应的电解质是否完全电离;涉及化学反应时要考虑是否是可逆反应,如选项D涉及可逆反应,反应的限度达不到100%;其它如微粒的结构、反应原理等,总之要认真审题,切忌凭感觉答题。
2017届高考模拟试题,3.【潍坊市2017届三模】设N A为阿伏加德罗常数值。
下列叙述正确的是A.28gC2H4和CO的混合气体中含有的分子数为N AB.28gN2和6gH2充分反应,生成NH3的分子数为2N AC.标准状况下,11.2LO2参加反应转移的电子数一定为2N AD.0.1molFeCl3完全水解转化为氢氧化铁胶体,生成0.1N A个胶粒【答案】A4.【汕头市2017届三模】设N A为阿伏伽德罗常数的值,下列说法正确的是A.27g铝中加入lmol/L的NaOH溶液,转移电子数是3N AB.56gN2与CO混合物中原子总数是4N AC.标准状况下,44.8LNO与22.4LO2反应后的分子数是2N AD.常温下,lLpH=1的H2SO4溶液中的H+为0.2N A【答案】B【解析】A项未告知NaOH溶液的体积,不确定铝是否完全反应,故无法计算转移电子数,A项错误;N2与CO 的摩尔质量均为28g/mol,56gN2与CO混合物的物质的量为2mol,N2与CO中均含有2个原子,故2molN2与CO混合物中原子总数是4N A,B项正确;NO与O2反应后生成NO2,NO2分子存在:2NO 2N2O4,故标准状况下,44.8LNO与22.4LO2反应后的分子数小于2N A,C项错误;pH=-lg c(H+) 故常温下,lLpH=1的H2SO4溶液中的H+为0.1N A,D项错误。
5.【宁德市2017届第三次质量检查】设N A为阿伏加德罗常数的值。
下列说法正确的是A.17gH2O2与17gH2S所含的电子数均为9N AB.0.3molNO2与水反应,生成H+数目为0.3N AC.0.1molCl2通入适量水中,转移电子数为0.2N AD.2LpH =3的醋酸与足量的锌反应,产生H2分子数为10-3N A【答案】A6.【合肥市2017届一模】设N A为阿伏加德罗常数的值。
下列说法正确的是A.0.lmolC2H6O分子中含C-H键数目为0.5N AB.1L1mol·L-1的NH4Cl溶液中含有NH4+数目为0.1N AC.8.4gNaHCO3和MgCO3混合物中含有阴离子数目为0.1N AD.标准状况下,2.24LCl2与过量NaOH溶液反应转移电子数为0.2N A【答案】C【解析】A.0.lmolC2H6O分子中含C-H键数目不一定为0.5N A,如果是二甲醚则含有0.6N A,A错误;B.铵根水解,1L1mol·L-1的NH4Cl溶液中含有NH4+数目小于0.1N A,B错误;C.NaHCO3和MgCO3的相对分子质量均是84,8.4gNaHCO3和MgCO3混合物中含有阴离子数目为0.1N A,C错误;D.标准状况下,2.24LCl2与过量NaOH溶液反应生成氯化钠、次氯酸钠和水,转移电子数为0.1N A,D错误。
答案选C。
点睛:选项A是易错点,学生容易忽视乙醇存在同分异构体二甲醚而错选。
答题时要灵活,不能思维定式。
7.【安徽省江南十校2017届5月冲刺联考(二模)】用N A表示阿伏加德罗常数的值,下列说法中正确的是A.1mol/LCaCl2溶液中含有Cl-的数目为N AB.标准状况下,2.24LHF所含分子数一定为0.1N AC.6.4gS6与S8的混合物中所含S原子数一定为0.2N AD.标准状况下,2.24L氧元素的单质所含原子数一定为0.2N A【答案】C【解析】A、没有给定体积,无法确定氯离子的数目,选项A错误;B、标准状况下氟化氢不是气态物质,不能用22.4L/mol进行求算,2.24LHF所含分子数一定大于0.1N A,选项B错误;C、S6和S8的混合物中只有S 原子,则硫原子的物质的量为=0.2mol,则所含硫原子数一定为0.2N A,选项C正确;错误!未找到引用源。
D、氧元素的单质有氧气和臭氧,若为臭氧,则标准状况下,2.24L臭氧所含原子数为0.3N A,选项D错误。
答案选C。
8.【聊城市2017届三模】设N A为阿伏加德罗常数的数值,下列说法正确的是A.42gC3H6中含有的共用电子对数目为8N AB.标准状况下,22.4L氯气与56g铁充分反应,转移的电子数为3N AC.由6gCaCO3和5gKHCO3组成的混合物中含有的碳原子数为0.llN AD.1L0.01mol/LKAl(SO4)2溶液中含有的阳离子数为0.02N A【答案】C点睛:解答本类题目要审清选项中涉及的以下几个方面:①要审清所求粒子的种类,如分子、原子、离子、质子、中子、电子等,②涉及物质的体积时要审清物质的状态和温度、压强,③涉及中子数和化学键的计算,要审清相关物质的结构和特殊物质的摩尔质量,④涉及化学反应要明确相关反应的特点和电子转移;⑤涉及溶液中的微粒要关注电离和水解;⑥要注意审清运算公式。
9.【上饶市重点中学2017届第二次联考】设N A为阿伏加徳罗常数的值,下列说法正确的是A.0.01mol·L-1氯水中,Cl2、Cl-和ClO-三粒子数目之和大于0.01N AB.氢氧燃料电池正极消耗22.4L气体时,负极消耗的气体分子数目为2N AC.0.lmol/L(NH4)2SO4溶液与0.2mol/LNH4Cl溶液中的NH4+数目相同D.2.4g镁在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2N A【答案】D点睛:顺利解答该类题目的关键是:一方面要仔细审题,注意关键字词,熟悉常见的“陷阱”;如A、C中溶液的体积及B中气体的状态。
另一方面是要把各种量转化为物质的量,以此为中心进行计算。
有关计算公式有错误!未找到引用源。
、错误!未找到引用源。
、错误!未找到引用源。
、错误!未找到引用源。
特别要注意气体摩尔体积、阿伏加德罗定律的适用范围和使用条件。
10.【四川省大教育联盟2017届第三次诊断性考试】常温下,将0.1L0.2mol/LKMnO4酸性溶液与一定量pH=3的草酸(HOOC-COOH)溶液混合,放出VL气体。
N A代表阿伏加德罗常数的值,下列说法正确的是A.pH=3的草酸溶液含有H+数目为0.001N AB.当1molKMnO4被还原时强酸提供H+数目为N AC.1molHOOC-COOH含共用电子对数目为9N AD.该反应释放CO2分子数目为错误!未找到引用源。
【答案】C【解析】A、没有给定溶液体积,无法求算,选项A错误;B、根据反应2MnO4-+5HOOC-COOH +6H+=2Mn2++10CO2↑+8H2O可知,当1molKMnO4被还原时强酸提供H+数目为3N A,选项B错误;C、C.HOOC-COOH分子中含有二个碳氧双键、一个碳碳单键、二个碳氧单键、二个氢氧键,每个分子共有关9对共用电子对,故1molHOOC-COOH含共用电子对数目为9N A,选项C正确;D、不是标准状况下,不能用22.4L/mol计算,无法确定,选项D错误。
答案选C。
11.【鄂尔多斯市2017届高三模拟考试】用N A表示阿伏伽德罗常数的值,下列说法正确的是A.24gNaH中阴离子所含电子总数为2N AB.标准状况下,44.8LNO与22.4LO2混合后,气体中分子总数为2N AC.在0.lmol/L的K2CO3溶液中,阴离子数目大于O.1N AD.300mL2mol/L乙醇溶液中所含分子数为0.6N A【答案】A【解析】A、NaH中阴离子是H-,阴离子所含电子数为24×2/24mol=2mol,故A正确;B、发生的反应是2NO +O2=2NO2,两者恰好完全反应生成NO2,但2NO2N2O4,因此气体分子物质的量小于2mol,故B错误;C、题目中没有说明溶液的体积,因此无法计算物质的量,故C错误;D、乙醇溶液含有的分子是乙醇和水,因此所含分子物质的量大于0.6mol,故D错误。
12.【邵阳市2017届第三次联考】设N A为阿伏伽德罗常数的值,下列说法正确的是A.标准状况下,44.8LNO与22.4O2反应后的分子数是2N AB.常温下,7.8g苯中所含碳碳双键数目为0.3N AC.27g铝中加入足量的1mol·L-1NaOH溶液,转移电子数是3N AD.25℃时,1.0LpH=13的Ba(OH)2溶液中含有的OH-数目为0.2N A【答案】C点睛:有关阿德常数判断时要正确运用物质的量有关计算,同时要注意使用时条件,如运用气体摩尔体积22.4L/mol时,要注意是标准状态下的气体,另外还要防此题中陷阱,如讨论溶液里的离子微粒时,要考虑(1)溶液的体积(2)离子是否水解(3)对应的电解质是否完全电离,(4)是否是可逆反应,如选项A就是要考虑2NO2⇌N2O4,其它如微粒的结构如苯环中无碳碳双键、反应原理等,总之要认真审题,切忌凭感觉答题。