第七章+原子的电子结构2
- 格式:ppt
- 大小:1.17 MB
- 文档页数:48


第七章 原子的壳层结构7.1 有两种原子,在基态时其电子壳层是这样添充的:(1)n=1壳层、n=2壳层和3s 次壳层都填满,3p 次壳层填了一半。
(2)n=1壳层、n=2壳层、n=3壳层及4s、4p、4d 次壳层都填满。
试问这是哪两种原子?解:每个壳层上能容纳的最多电子数为,每个次壳层上能容纳的最多电子数为。
22n )12(2+l (1)n=1壳层、n=2壳层填满时的电子数为:10221222=×+×3s 次壳层填满时的电子数为:2)102(2=+×3p 次壳层填满一半时的电子数为:3)112(221=+×× 此种原子共有15个电子,即Z=15,是P(磷)原子。
(2)与(1)同理:n=1,2,3三个壳层填满时的电子数为28个4s、4p、4d 次壳层都填满的电子数为18个。
所以此中原子共有46个电子,即Z=46,是(钯)原子。
Pd 7.2 原子的3d 次壳层按泡利原理一共可以填多少电子?为什么?答:根据泡利原理,在原子中不能有两个电子处在同一状态,即不能有两个电子具有完全相同的四个量子数。
对每一个次壳层,最多可以容纳个电子。
3d 次壳层的,所以3d 次壳层上可以容纳10个电子,而不违背泡利原理。
l )(122+l 2=l 7.3 原子的S、P、D 项的量子修正值Na 01.0,86.0,35.1=Δ=Δ=ΔD p s 。
把谱项表达成22)(n Z R σ−形式,其中Z 是核电荷数。
试计算3S、3P、3D 项的σ分别为何值?并说明σ的物理意义。
解:用量子数亏损表征谱项时 形式为 22)(*Δ−=n R n R 用有效电荷表征时 形式为 2222)(*n Z R n RZ σ−= 两种形式等价。
令二者相等,则得到 Δ 与 σ 之间的关系Δ−=−n n Z σ Δ−−=n n Z σ 用 Z = 11 和 n = 3 代入上式得 3S、3P、3D 项的σ值分别为:3119.183 1.35S σ=−=− 3119.630.86P σ=−=− 3111030.01D σ=−≈− σ 代表因内层电子对核电荷的屏蔽效应、价电子的轨道贯穿效应和原子实的极化效应而使价电子感受到的核电荷数的亏损。



原子的核外电子排布教案一、教学目标1. 让学生了解原子的基本结构,知道原子由原子核和核外电子组成。
2. 使学生掌握核外电子的排布规律,能运用能量最低原理、泡利不相容原理和洪特规则解释核外电子的排布。
3. 培养学生的观察、分析和推理能力,提高学生对原子结构的理解和运用能力。
二、教学重点与难点1. 教学重点:核外电子的排布规律及其应用。
2. 教学难点:能量最低原理、泡利不相容原理和洪特规则的理解和应用。
三、教学方法采用问题驱动法、案例分析法和小组合作法,引导学生观察、分析和推理,培养学生的科学思维能力。
四、教学准备1. 教学课件:原子的核外电子排布相关图片和动画。
2. 教学素材:有关核外电子排布的案例和练习题。
3. 教学工具:黑板、粉笔、多媒体设备。
五、教学过程1. 导入:通过展示原子结构模型,引导学生回顾原子的基本结构,提出问题:“原子的核外电子是如何排布的?”2. 讲解:讲解原子的核外电子排布规律,包括能量最低原理、泡利不相容原理和洪特规则。
3. 案例分析:分析具体案例,让学生运用核外电子排布规律解释原子光谱、化学性质等现象。
4. 练习:布置练习题,让学生巩固核外电子排布的知识。
5. 总结:对本节课内容进行总结,强调核外电子排布的重要性。
6. 拓展:引导学生思考核外电子排布在其他领域的应用,如材料科学、生物化学等。
7. 布置作业:布置相关作业,巩固所学知识。
8. 课后反思:教师对本节课的教学效果进行反思,为下一步教学做好准备。
六、教学内容与课时安排1. 教学内容:第六章:核外电子的能级和轨道第七章:能量最低原理第八章:泡利不相容原理第九章:洪特规则第十章:核外电子排布的应用2. 课时安排:每章内容安排2课时,共10课时。
七、教学评价1. 课堂参与度:观察学生在课堂上的发言和提问情况,评估学生的参与度。
2. 练习题的正确率:分析学生完成练习题的情况,评估学生对核外电子排布知识的掌握程度。
3. 小组讨论与合作:评价学生在小组讨论和合作中的表现,评估学生的团队协作能力。

第四章 碱金属原子1. 已知Li 原子光谱主线系最长波长0A 6707=λ,辅线系系限波长A 3519=∞λ.求Li 原子第一激发电势和电离电势.解:主线系最长波长是原子从第一激发态跃迁至基态的光谱线的波长E h hc νλ∆==第一激发电势1eU E =∆34811976.626210310V 1.850V 1.602210 6.70710E hc U e e λ---∆⨯⨯⨯====⨯⨯⨯辅线系系限波长是原子从无穷处向第一激发态跃迁产生的 辅线系~~*2n R n νν∞=-,~~*n n νν∞→∞=192 5.648910J hc eU λ-∞==⨯2 3.526V U =电离电势:U =U 1+U 2=5.376V2. Na 原子的基态3S .已知其共振线波长为58930A ,漫线系第一条的波长为81930A ,基线系第一条的波长为184590A ,主线系的系限波长为24130A 。
试求3S 、3P 、3D 、4F 各谱项的项值. 解:主线系波数~p 22s p ,3,4,(3)()n R Rn n ν=-=-∆-∆~~p 2s ,(3)n Rn νν∞→∞==-∆系限波长:p λ∞=24130A =72.41310m -⨯~1613S 71m 4.144210m 2.41310T ν--∞-===⨯⨯共振线为主线系第一条线, 是原子从3P 到3S 跃迁产生的光谱线 共振线波长:λp1=58930A =75.89310m -⨯~61p13S 3P 71 1.696910m 5.89310mT T ν--=-==⨯⨯1616S 3P 3m 104473.2m 106969.1--⨯=⨯-=T T漫线系(第一辅线系)波数~d 22p d ,3,4,(3)()n R Rn n ν=-=-∆-∆漫线系第一条线是原子从3D 到3P 跃迁产生的光谱线 漫线系第一条光谱线的波长7d18.19310m λ-=⨯167D 3P 31~d m 102206.1m10193.81--⨯=⨯=-=T T ν1616P 3D 3m 102267.1m 102206.1--⨯=⨯-=T T基线系(柏格曼线系)波数,5,4,)()3(2f 2d ~f =∆--∆-=n n RR n ν 基线系第一条线是原子从4F 到3D 跃迁产生的光谱线 基线系第一条光谱线的波长6f1 1.845910m λ-=⨯156F 4D 31fm 104174.5m108459.1--⨯=⨯=-=T T ν 1515D 3F 4m 108496.6m 104174.5--⨯=⨯-=T T3. K 原子共振线波长为7665Å,主线系系限波长为2858Å. 已知K 原子的基态为4S. 试求4S 、4P 谱项的量子数修正项∆S 、∆P 值各为多少?K 原子的主线系波数,5,4,)()4(2P 2S ~p=∆--∆-=n n RR n ν 2S ~~p )4(,∆-==∞→∞Rn n νν 1617~m 104990.3m 10858.211---∞∞⨯=⨯==p λν 16~S 4m 104990.3-∞⨯==νT而 2S S 4)4(∆-=RT 所以 S4S 4T R =∆- 17m 100973731.1-∞⨯=≈R R 7709.14S =∆-2291.2S =∆K 原子共振线为主线系第一条线, 是原子从4P 到4S 跃迁产生的光谱线1p A 7665=λ167P 4S 41pm 103046.1m10665.7--⨯=⨯=-=T T ν 1616S 4P 4m 101944.2m 103046.1--⨯=⨯-=T T而 2P P 4)4(∆-=RT 所以 P4P 4T R =∆- 17m 100973731.1-∞⨯=≈R R7638.14P4P =-=∆T R第五章 多电子原子1. He 原子的两个电子处在2p3d 电子组态.问可能组成哪几种原子态?用原子态的符号表示之.已知电子间是LS 耦合.解:p 电子的轨道角动量和自旋角动量量子数分别为,11=l 211=s . d 电子的轨道角动量和自旋角动量量子数分别为,21=l 212=s . 因为是LS 耦合,所以.,,1,212121l l l l l l L -⋯-++=.1,2,3=L.0,1.2121=-+=S s s s s S 或而 .,,1,S L S L S L J -⋯-++=.1,0,1===J S L 原子态为11P . .0,1,2,1,1===J S L 原子态为30,1,2P ..2,0,2===J S L 原子态为12D ..1,2,3,1,2===J S L 原子态为31,2,3D ..3,0,3===J S L 原子态为13F . .2,3,4,1,3===J S L 原子态为32,3,4F .2. 已知He 原子的两个电子被分别激发到2p 和3d 轨道,其所构成的原子态为3D ,问这两电子的轨道角动量p l 1与p l 2之间的夹角,自旋角动量p s 1与p s 2之间的夹角分别为多少?(1). 解:已知原子态为3D ,电子组态为2p3d, 所以2,1,1,221====l l S L因此'1212221211212221222211113733212/)(cos cos 26)1(6)1(22)1(οθθθπ==---=-+==+==+==+=l l l l L l l l l L L l l p p p p P p p p p P L L P l l p hl l p 所以'0'0471061373180=-=οθL(2).1212122s s S s s p p P =======因为所以而'2212221222212221228109312/)(cos cos 2οθθθ=-=---=-+=s s s s S s s s s S p p p p P p p p p P 所以'0'0327028109180=-=οθS4. 试以两个价电子l 1=2和l 2=3为例说明,不论是LS 耦合还是jj 耦合都给出同样数目的可能状态. (1) LS 耦合.3,221==l l.,,1,212121l l l l l l L -⋯-++=.1,23,4,5=L .2121==s s .0,1=S.,,1,S L S L S L J -⋯-++=当S =0时,J =L , L 的5个取值对应5个单重态, 即1=L 时,1=J ,原子态为11P .2=L 时,2=J ,原子态为12D .3=L 时,3=J ,原子态为13F . 4=L 时,4=J ,原子态为14G .5=L 时,5=J ,原子态为15H .当S =1时,.1,,1-+=L L L J代入一个L 值便有一个三重态.5个L 值共有5乘3等于15个原子态,分别是:1=L 时,0,1,2=J 原子态为30,1,2P2=L 时,1,2,3=J 原子态为31,2,3D3=L 时,2,3,4=J 原子态为32,3,4F 4=L 时,3,4,5=J 原子态为33,4,5G5=L 时,4,5,6=J 原子态为34,5,6H因此,LS 耦合时共有20个可能状态. (2) jj 耦合.,...,.2527;2325;21212121j j j j j j J j j s l j s l j -++===-=+=或或或 将每个j 1、j 2 合成J 得:.1,2,3,42523.2,3,4,52723.0,1,2,3,4,52525.1,2,3,4,5,6272521212121============J j j J j j J j j J j j ,合成和,合成和,合成和,合成和4,3,2,15,4,3,25,4,3,2,1,06,5,4,3,2,1)25,23()27,23()25,25()27,25(共20个可能状态所以,无论是LS耦合还是jj耦合,都会给出20种可能状态.6.已知He原子的一个电子被激发到2p轨道,另一个电子还在1s轨道,试做出能级跃迁图来说明可能出现哪些光谱线跃迁.解:在1s2p组态的能级和1s1s基态之间存在中间激发态,电子组态为1s2s.利用LS耦合规则求出各电子组态的原子态如下:1s1s:1S01s2s:1S0、3S11s2p:1P1、3P0,1,2根据选择定则,这些原子态之间可以发生5条光谱线跃迁。

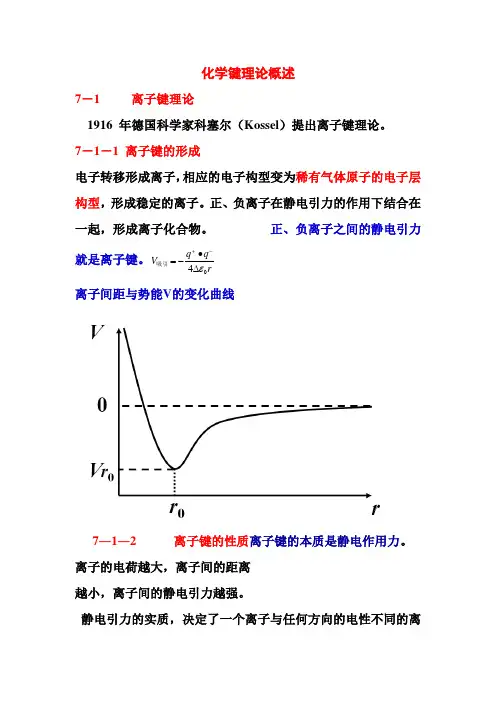
化学键理论概述7-1 离子键理论1916 年德国科学家科塞尔(Kossel )提出离子键理论。
7-1-1 离子键的形成电子转移形成离子,相应的电子构型变为稀有气体原子的电子层构型,形成稳定的离子。
正、负离子在静电引力的作用下结合在一起,形成离子化合物。
正、负离子之间的静电引力就是离子键。
r q q V 04ε -+∙-=吸引离子间距与势能V 的变化曲线7―1―2 离子键的性质离子键的本质是静电作用力。
离子的电荷越大,离子间的距离越小,离子间的静电引力越强。
静电引力的实质,决定了一个离子与任何方向的电性不同的离子相吸引而成键,所以离子键无方向性;而且只要是正负离子之间,则彼此吸引,即离子键无饱和性。
但是每个离子周围排列的相反电荷离子的数目是一定的,这个数目是与正负离子半径的大小和所带电荷多少等有关。
离子键形成的重要条件就是元素之间的电负性差值较大。
一般来说,元素的电负性差越大,形成的离子键越强。
化合物中不存在百分之百的离子键一般用离子性百分数来表示键的离子性的相对大小。
一般认为,∆χ> 1.7,发生电子转移,主要形成离子键。
∆χ< 1.7,不发生电子转移,主要形成共价键。
7―1―3 离子键的强度键能 1 mol 气态分子,离解成气态原子时,所吸收的能量,为离子键的键能,用E i表示。
键能E i越大,表示离子键越强。
晶格能在标准状态下,将1mol 离子型晶体分解成 1 mol 气态正、负离子时需要的能量,用U表示。
晶格能U越大,表示晶体分解成离子时吸收的能量越多,说明离子键越强。
离子键的强度通常用晶格能的大小来衡量。
所以,离子化合物中离子键力是晶体中吸引力和排斥力综合平衡的结果。
离子型化合物在通常状态下是以阴、阳离子聚集在一起形成的巨分子的形式存在。
所以离子化合物的化学结合力不是简单的两个阴、阳离子之间的结合,而是整块晶体之内的整个结合力。
因此,用晶格能描述离子键的强度经常比离子键的键能来得更好。



第七章 原子的壳层结构§7.1 元素性质的周期性变化将元素按核电荷数的大小排列起来,其物理、化学性质将出现明显的周期性。
1869年,门捷列夫首先提出元素周期表。
当时,周期表是按原子量的次序排列起来的,虽然比较粗糙,但仍能反映元素性质的周期变化特性。
那时共知道62个元素,按其性质的周期性排列时,并不连续,而是出现了一些空位。
在周期性的前后特征的指导下,于1874—1875年发现了钪(Sc),它处于钙和钛之间;又发现了锗(Ce)和镓(Ga),它们填补了锌与砷之间的两个空位。
1925年泡利提出不相容原理之后,人们认识到元素的周期性是电子组态的周期性的反映,而电子组态的周期性则联系于特定轨道的可容性。
这样,化学性质的周期性用原子结构的物理图像得到了说明,从而使化学概念“物理化”,化学不再是一门和物理学互不相通的学科了。
元素的化学、物理性质的变化呈现周期性,如原子光谱、电离能等。
各种元素为什么会有周期性?元素的周期性和原子中电子的分布有关,电子如何分布?§7.2 原子的电子壳层结构玻尔:原子内的电子按一定的壳层排列,每一壳层内的电子都有相同的主量子数,每一个新的周期是从电子填充新的主壳层开始,元素的物理、化学性质取决于原子最外层的电子即价电子的数目。
一、电子填充壳层结构的原则:1.泡利不相容原理:在一个原子中,不可能有两个或两个以上的电子具有完全相同的状态(完全相同的四个量子数)。
2.能量最小原理:电子按能量由低到高的次序填充各壳层。
二、各壳层所能容纳的最大电子数1.n 、l 相同的次壳层:)12(2+=l N l2.n 相同的主壳层:2102)12(2n l N n l n =+=∑-=三.各元素的原子壳层结构1.第一周期:从n=1的K壳层填起。
2.第二周期:从n=2的L壳层填起。
3.第三周期:从n=3的M壳层填起。
§7.3 原子基态的电子组态一、电子组态的能量——壳层的次序前面已经讲过,决定壳层次序的是能量最小原理。
第七章元素与元素性质的周期性1.周期表与元素周期表的分区:按原子最后一个电子占据的轨道,周期表中元素可分为5个区。
s区的价电子构型为ns1~2,p区的价电子构型为ns2np1~6,d区的价电子构型为(n-1)d1~9ns1~2,ds区的价电子构型为(n—1)d10ns1~2,f区的价电子构型为(n —2)f0~14(n—1)d0~2ns2。
构造原理:基态多电子原子的电子填充原子轨道的一般次序为1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→4f→5d→6p→7s→5f→6d→7p 构造原理的前提条件是连续轨道间具有较大的能级差,而电子间的排斥作用相对较小。
对于d区元素与f区元素,由于价轨道间能级差较小,当电子间排斥作用超过轨道间能级差时,原子的价电子构型就会出现提前到达全满、半满的不符合构造原理的特殊构型。
通常,亚层轨道为全满或半满时比较稳定。
2.原子性质的周期性(1)原子半径一般规律:同一族元素,从上到下原子半径依次增大;同一周期主族元素,从左到右原子半径依次减小.镧系收缩:从镧到镥,原子半径和三价离子半径逐渐减小。
镧系收缩造成镧系后第三系列过渡元素的原子半径比一般的增大幅度小,与第二系列过渡同一族元素的原子半径接近.d电子也具有较差的屏蔽效应,造成d区元素半径收缩.原子半径存在不同的类型,主要有金属半径、离子半径、共价半径、van der Waals半径,使用时需要注意。
(2)电离能元素第一电离能的一般规律:同一族元素,从上到下逐渐减小;同一周期元素,从左到右大体上依次增大。
元素第一电离能最小的元素为周期表左下角的Cs,元素第一电离能最大的元素为周期表右上角的He.该规律一般可用的变化规律来解释。
原子有效核电荷Zeff(3)电子亲和能电子亲和能的周期性变化比较复杂,变化趋势不很清晰。
粗略的规律为:同一周期元素,从左到右原子电子亲和能依次增大,这可用原子有效核电荷Z的变化规律来解释。
九年级原子结构知识点总结原子结构是化学中的基础知识,它涉及到原子的组成以及原子的性质。
本文将对九年级学生必须掌握的原子结构知识点进行总结。
一、基本概念原子是物质的最小单位,由原子核和电子组成。
原子核由质子和中子组成,质子带正电,中子不带电,电子带负电。
原子核位于原子的中心,电子在原子核周围的能层上运动。
二、元素符号和元素符号元素是由相同类型的原子组成的纯物质。
元素符号是表示元素的一两个字母,通常来自元素名称的拉丁文缩写,例如氢的符号是H,氧的符号是O。
三、电子结构原子的电子排列方式称为电子结构。
基本原则是:1. 电子按照能级从低到高的顺序填充。
能级按照K、L、M、N 等字母来表示,K能级最靠近原子核。
2. 每个能级最多容纳固定数量的电子,第一能级最多容纳2个电子,第二能级最多容纳8个电子,第三能级最多容纳18个电子。
3. 原子外层电子数目决定了元素的化学性质。
四、原子序数和质子数原子的质子数等于原子核中质子的数量,也等于元素周期表中元素的原子序数。
例如,氧元素的原子序数为8,质子数也为8。
五、同位素同位素是指具有相同质子数但质量数不同的原子。
同位素具有相似的化学性质,但质量不同。
六、离子离子是具有正电荷或负电荷的原子或原子团。
正离子是电子数目比质子少的原子或原子团,负离子是电子数目比质子多的原子或原子团。
七、原子的平衡状态原子的平衡状态是指原子内外电子数目相等时的状态。
原子通过得电子或失电子来实现平衡。
得电子后的原子形成负离子,失电子后的原子形成正离子。
八、原子的价电子原子外层最活跃的电子称为价电子。
原子通过共享、转移或捐赠价电子来与其他原子形成化学键。
九、同位素的应用同位素在实际应用中具有广泛的用途,例如用于放射治疗、碳-14用于碳定年、同位素示踪等。
十、元素周期表元素周期表将所有已知元素按照原子序数排列并划分成周期和族。
周期数表示原子中能级最高的电子能级,族数表示原子外层电子数。
总结:九年级的原子结构知识点包括基本概念、元素符号、电子结构、原子序数和质子数、同位素、离子、原子的平衡状态、原子的价电子、同位素的应用以及元素周期表。
原子的电子结构及轨道分布原子的电子结构是指电子在原子中的能级分布和轨道排布的规律。
了解原子的电子结构对于理解原子性质、元素周期表和化学反应等具有重要意义。
本文将对原子的电子结构及轨道分布进行详细论述。
一、原子的电子结构1. 基本概念原子由质子、中子和电子组成。
质子和中子位于原子核中,而电子则以环绕原子核的方式存在。
原子的电子结构由不同能级的电子层组成,能级越靠近原子核,能量越低。
2. 原子模型的演变(这里可以分为几个小节,分别介绍经典原子模型、量子力学模型等)3. 原子的主量子数和次量子数原子的主量子数(n)决定了电子的主要能级和电子层的数量。
主量子数为正整数,其数值越大,电子的能量越高。
原子的次量子数(l)描述了电子的轨道形状。
次量子数的取值范围为0到n-1。
不同的次量子数对应不同的轨道类型,如s轨道、p轨道、d轨道和f轨道。
4. 原子的磁量子数和自旋量子数原子的磁量子数(ml)描述了电子在轨道上的空间分布。
磁量子数的取值范围为-l到l。
原子的自旋量子数(ms)描述了电子的自旋方向。
自旋量子数可以取两个值:+1/2或-1/2。
二、轨道分布图轨道分布图用于表达原子中电子的能级和轨道位置。
轨道分布图常用的表示方式包括原子核符号、能级分层和电子填充规则。
(这里可以列举一些轨道分布图的例子)三、能级填充规则电子在填充轨道时遵循一定的顺序和规则:泡利不相容原理、奥卡规则和洪特规则。
1. 泡利不相容原理泡利不相容原理指出一个轨道最多只能容纳两个自旋方向相反的电子。
2. 奥卡规则奥卡规则规定电子在填充轨道时优先填满能量较低的轨道。
3. 洪特规则洪特规则描述了电子填充顺序,即按照能级的不同,按照一定规律填充轨道。
四、电子排布的例子(这部分可以给出几个具体的原子的电子结构和轨道分布的例子,如氢原子、氦原子等)结论:原子的电子结构及轨道分布是原子性质的重要基础。
通过了解原子的电子结构,我们可以更好地理解元素周期表的特点,以及不同元素之间的化学反应和相互作用。