亚铁盐与铁盐的相互转化
- 格式:docx
- 大小:14.40 KB
- 文档页数:1


第16讲铁盐、亚铁盐及相互转化[复习目标] 1.掌握Fe2+和Fe3+的检验方法。
2.掌握铁盐、亚铁盐的性质,能实现Fe2+和Fe3+的转化。
考点一铁盐、亚铁盐的性质与检验1.铁盐与亚铁盐亚铁盐(Fe2+) 铁盐(Fe3+) 颜色浅绿色(溶液) 黄色(溶液)氧化性与还原性既有氧化性,又有还原性,以还原性为主,如在酸性条件下能被H2O2、NO-3氧化,反应的离子方程式分别为2Fe2++H2O2+2H+===2Fe3++2H2O、3Fe2++4H++NO-3===3Fe3++NO↑+2H2O一般表现为氧化性,如能溶解铜,反应的离子方程式为2Fe3++Cu===Cu2++2Fe2+水解性水解呈酸性极易水解,只存在于酸性较强的溶液中2.其他常见铁盐(1)绿矾(FeSO4·7H2O):一种重要的还原剂,可用作补血剂及植物的补铁剂。
(2)铁铵矾[NH4Fe(SO4)2·12H2O]:无色晶体,易溶于水,常用作化学分析试剂、药物和织物媒染剂。
(3)赤血盐{K3[Fe(CN)6]}:红色晶体,能溶于水,常用于检验Fe2+,生成蓝色沉淀。
(4)高铁酸钾(K2FeO4):暗紫色晶体,具有强氧化性,可用作水体的杀菌、消毒剂或高容量电池材料。
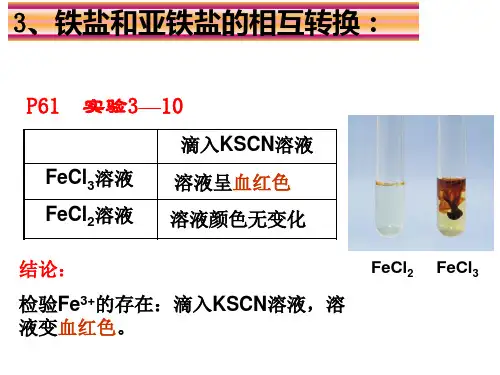
3.Fe2+和Fe3+的检验(1)(2)(3)含Fe 2+、Fe 3+的混合溶液中Fe 2+、Fe 3+的检验 混合溶液――――――→滴加KSCN 溶液溶液变红色,说明含有Fe 3+。
混合溶液――――→滴加酸性KMnO 4溶液酸性KMnO 4溶液紫红色褪去,说明含有Fe 2+。
1.氢氧化铁与HI 溶液仅能发生中和反应( )2.中性溶液中可能大量存在Fe 3+、Cl -、K +、SO 2-4( )3.酸性条件下H 2O 2氧化Fe 2+的离子方程式为2Fe 2++H 2O 2+2H +===2Fe 3++2H 2O( )4.将Fe(NO 3)2样品溶于稀H 2SO 4后,滴加KSCN 溶液,溶液变红,则Fe(NO 3)2晶体已氧化变质( )5.用酸性高锰酸钾溶液检验FeCl 3溶液中是否含有FeCl 2( )答案 1.× 2.× 3.√ 4.× 5.×一、铁盐、亚铁盐的性质1.铁及其化合物是中学化学中一类重要的物质。






亚铁盐与铁盐的相互转化亚铁盐与铁盐的相互转化导语:亚铁盐和铁盐是我们在化学实验和工业生产中经常接触到的物质。
它们之间的相互转化在化学反应中起着重要作用。
本文将深入探讨亚铁盐和铁盐的相互转化,包括它们的性质、反应条件和应用领域。
让我们一起来了解这一有趣的化学现象吧!一、亚铁盐和铁盐的性质及区别1. 亚铁盐的性质:亚铁盐,通常是指氯化亚铁(FeCl2)和硫酸亚铁(FeSO4)。
它们的共同特点是含有2价的铁离子(Fe2+)。
亚铁盐多数为淡绿色或淡蓝色的晶体,易溶于水,在空气中容易被氧化而发生颜色变化。
由于亚铁离子具有较强的还原性,因此亚铁盐在一些还原反应中起到了重要的催化剂的作用。
2. 铁盐的性质:铁盐主要指氯化铁(FeCl3)和硫酸铁(Fe2(SO4)3)。
与亚铁盐不同的是,铁盐中铁的氧化态为3+,即含有3价的铁离子(Fe3+)。
铁盐呈现出红褐色或黄褐色的颜色,也易溶于水。
铁盐在一些氧化反应和络合反应中发挥着重要的作用。
3. 区别与联系:亚铁盐和铁盐的区别主要在于铁的氧化态不同,导致了不同的性质和催化活性。
亚铁盐中的2价铁离子较于3价铁离子在电子构型上更不稳定,因此更容易参与化学反应。
在一些氧化还原和复合反应中,亚铁盐常常被氧化成铁盐。
相反的,铁盐可以通过还原反应转化为亚铁盐。
二、亚铁盐与铁盐的相互转化反应1. 亚铁盐氧化为铁盐:亚铁盐的氧化过程是亚铁离子被氧气氧化为3价的铁离子的过程。
这个反应通常发生在潮湿的空气中。
亚铁盐溶液接触到空气中的氧气后,亚铁离子会被氧化成铁离子。
这个反应可以用如下的反应方程式表示:2Fe2+ + O2 → 2Fe3+。
2. 铁盐还原为亚铁盐:铁盐的还原过程是3价铁离子被还原成2价铁离子的过程。
这个反应通常发生在还原剂的作用下。
在硫酸铁溶液中加入铁粉,铁粉会与铁离子发生反应,并将铁离子还原成亚铁离子。
这个反应可以用如下的反应方程式表示:Fe3+ + Fe → 2Fe2+。

第三章铁金属材料第一节铁及其化合物3.1.3铁盐和亚铁盐板块导航01/学习目标明确内容要求,落实学习任务02/思维导图构建知识体系,加强学习记忆03/知识导学梳理教材内容,掌握基础知识04/效果检测课堂自我检测,发现知识盲点05/问题探究探究重点难点,突破学习任务06/分层训练课后训练巩固,提升能力素养1.知道Fe3+、Fe2+的检验原理、试剂的选择及用显色法检验Fe2+时试剂加入的顺序。
2.知道Fe2+的强还原性、Fe3+的强氧化性,能依据氧化还原反应原理选择适当的物质实现两者间的相互转化。
3.依据氧化还原反应原理理解Fe、Fe2+、Fe3+的转化关系及应用。
重点:Fe3+、Fe2+的检验,铁盐与亚铁盐之间相互转变。
难点:铁盐与亚铁盐之间相互转变。
一、亚铁盐的性质及应用1.弱氧化性(1)Mg、Al、Zn与亚铁盐溶液发生置换反应①Fe2++Zn Fe+Zn2+②Fe2++Mg Fe+Mg2+③3Fe2++3Al3Fe+2Al3+(2)K、Ca、Na与亚铁盐溶液反应①先与水反应:2Na+2H2O2NaOH+H2↑②碱与亚铁盐反应:Fe2++2OH-Fe(OH)2↓2.强还原性(1)能够被Cl2、Br2氧化①除FeCl3溶液中的FeCl2溶液:2Fe2++Cl22Fe3++2Cl-②Br2:2Fe2++Br22Fe3++2Br-(2)能够被O2氧化①反应:12Fe2++O2+6H2O8Fe3++4Fe(OH)3↓②保存:密封保存,防止O2将Fe2+氧化;加少量铁粉将Fe3+还原成Fe2+(3)能够被酸性的H2O2氧化①反应:2Fe2++2H++H2O22Fe3++2H2O②应用:除去Fe3+中Fe2+的最佳方法(4)与酸性条件下的MnO4-、NO3-、ClO-等离子不能大量共存①酸性MnO4-:5Fe2++MnO4-+8H+5Fe3++Mn2++4H2O②酸性NO3-:3Fe2++NO3-+4H+3Fe3++NO↑+2H2O③酸性ClO-:2Fe2++2H++ClO-2Fe3++H 2O+Cl-(5)还原性:I->Fe2+>Br-①向FeBr2溶液通入Cl2,先氧化Fe2+,后氧化Br-②向FeI2溶液通入Cl2,先氧化I-,后氧化Fe2+3.与碱溶液反应①烧碱:Fe2++2OH-Fe(OH)2↓②氨水:Fe2++2NH3·H2O Fe(OH)2↓+2NH4+二、铁盐的性质及应用含有Fe3+的溶液呈棕黄色,Fe3+处于铁的高价态,遇Fe、Cu、HI、H2S、SO2-3等均表现为氧化性。

《铁盐和亚铁盐的性质与转变》教学设计
铁盐和亚铁盐是我国化学教育中重要的两个概念,它们的性质和转变与我们日常生活息息相关。
因此,根据教育部《高等学校化学教学大纲》的规定,对此两种重要的物质的性质和转化应该进行详细的教学设计和讲解。
第一部分要讲述的是铁盐的性质。
铁盐是一种由铁元素组成的盐,据化学实验结果显示,其晶体性质大多可以溶于水。
因而,多数时候,铁盐表现出溶解度高、沉淀不完全性等特点。
在一定温度和压力下,铁盐也易于发生变化,其中包括氧化-还原反应和消去反应等。
第二部分主要讲述的是亚铁盐的性质。
亚铁盐是一种有metaloid属性的混合盐,里面包含有 iron-III,它的合成是通过催分水解法进行的。
此外,它还具备机械强度高、热稳定性好等特性。
同时,亚铁盐可以发生氢化-还原反应和溶剂形成反应,并且可以通过改变溶液的种类或变化水浓度而迅速失去水分。
最后,本文还将概括铁盐和亚铁盐的转变过程,具体而言,铁盐的氧化-还原反应和消去反应可以使晶体结构稳定,而亚铁盐的氢化-还原反应、溶剂形成反应可以使其扩散性变的更强。
通过对这些反应的详细分析,可以更好地了解物质的性质和转变,从而为下一步的学习和实验服务。
公开课教案高一化学组邓仕梅【课题】铁盐与亚铁盐的相互转化【三维目标】知识与技能:1、掌握Fe2+、Fe3+的检验方法及相互转化。
2、通过学生实验培养学生的观察能力、动手能力及分析综合能力。
过程与方法:教学中通过实验和探究,让学生对探究的方法有一定的了解。
在试验和探究过程中,积累一些科学假设对比实验方法。
情感态度与价值观:通过实验探究,让学生体会科学研究的乐趣,体验合作和动手的整个过程的积极的情绪。
【教学重点】铁盐、亚铁盐之间的相互转变【教学难点】铁盐、亚铁盐之间的相互转变【课型】新课【教具准备】FeCl3、FeSO4、新制氯水、硝酸、硫氰化钾、铁粉、酸性KMnO4、H2O2、硫酸亚铁补血口服液、维生素C【教学过程】【引入】Fe(OH)2与O2反应生成Fe(OH)3,+2价铁可以被氧化成+3价铁,我们可否作这样一个猜想:+2价的Fe2+的盐溶液也能被氧化生成+3价的Fe3+的盐溶液,反过来,+3价的Fe3+的盐溶液也能被还原生成+2价的Fe2+的盐溶液呢?也就是Fe2+与Fe3+之间是否可以相互转化呢?下面我们来探究这个问题。
(师生共同分析,讨论,得出结论)【板书】铁盐与亚铁盐的相互转化Fe3+被氧化被还原【问题1】要实现亚铁离子转化成铁离子,需要加什么物质?你怎么知道亚铁离子被氧化成了铁离子了呢?【科学探究】现在给你们提供一些试剂:FeCl 3溶液 、FeSO 4 、新制氯水、硝酸、硫氰化钾、铁粉、酸性KMnO 4、H 2O 2 。
请同学们从中选择合适的试剂,完成实验Fe 2+到Fe 3+的转化。
(学生活动)做实验、观察现象、总结结论、分享成果。
【教师点评】Fe 2+可以被氯水、酸性KMnO 4、HNO 3、O 2、H 2O 2等氧化剂氧化成Fe 3+,由此证明Fe 2+具有还原性。
【板书】 Fe 2+→Fe 3+ 2Fe 2+ + H 2O 2 + 2H + === 2Fe 3+ + 2H 2O2Fe 2+ + Cl 2 === 2Fe 3+ + 2Cl -【问题2】要实现铁离子转变成亚铁离子,需要加什么物质?你怎么知道铁离子被还原成了亚铁离子了呢?【演示实验】完成实验Fe 3+到Fe 2+的转化。
亚铁盐与铁盐的相互转化
亚铁盐和铁盐是两种常见的铁化合物,在一定条件下,它们可以相互转化。
亚铁盐指的是铁的+2氧化态,例如亚铁离子(Fe2+)。
铁盐包括铁的不同氧化态,如三价铁(Fe3+)的盐,例如三氯化铁(FeCl3)。
在适当的条件下,亚铁盐和铁盐之间可以通过氧化还原反应相互转化。
以下是一些常见的亚铁盐和铁盐的相互转化示例:
1.亚铁盐氧化为铁盐: 2Fe2+ + O2 -> 2Fe3+
在有氧条件下,亚铁盐可以被氧气氧化为三价铁盐。
这是一个电子转移过程,其中亚铁离子(Fe2+)失去电子变为三价铁离子(Fe3+)。
2.铁盐还原为亚铁盐: 2Fe3+ + 2e- -> 2Fe2+
在还原条件下,三价铁盐可以接受电子并还原为二价亚铁盐。
这个反应是亚铁离子(Fe2+)接受电子,将三价铁(Fe3+)还原为二价亚铁(Fe2+)。
需要注意的是,亚铁盐和铁盐的相互转化取决于氧化还原反应的条件和环境。
例如,氧气、光、温度和pH值等因素都可以影响这些反应的进行。
此外,不同的铁化合物可能在不同的条件下发生转化,因此具体的反应条件需要根据具体的化合物和反应进行调整。