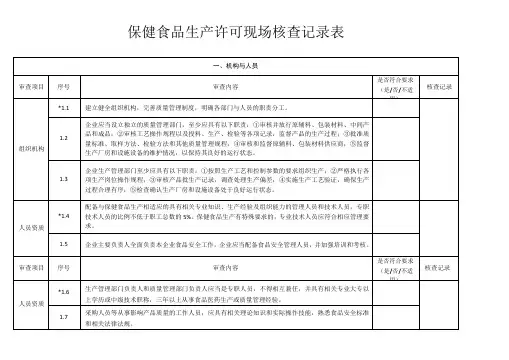
保健食品生产许可现场核查记录表
- 格式:docx
- 大小:36.80 KB
- 文档页数:11

保健食品注册现场核查规定第一章总则第一条为加强保健食品注册现场核查,规范保健食品注册现场核查工作,根据《保健食品注册管理办法》,制定本规定。
第二条保健食品注册现场核查,是指食品药品监督管理部门对保健食品申请注册样品试制和试验情况进行实地确认,对生产资质、生产工艺及生产记录等进行核查,现场查看仪器设备、生产相关记录等,对试制样品进行抽样,并做出核查结论。
样品试制现场包括样品试制过程的所有现场。
试验现场核查包括安全性毒理学试验、功能学试验、功效成分和标志性成分检测、卫生学试验和稳定性试验等现场的核查,必要时对兴奋剂和产品的原料试验现场等进行核查。
第三条国家食品药品监督管理局负责保健食品注册现场核查工作。
省、自治区、直辖市食品药品监督管理局受国家食品药品监督管理局的委托,负责组织对申请注册的国产保健食品试制和试验现场进行核查并抽取复核检验用样品。
必要时,国家食品药品监督管理局负责组织对申请注册的进口保健食品样品试制现场进行核查。
第二章组织实施第四条保健食品注册现场核查前,被核查单位应当做好核查前的准备工作。
核查时间不得擅自变更,确需变更的,被核查单位应当提出书面申请说明理由,经食品药品监督管理部门同意后方可变更。
第五条食品药品监督管理部门应当组织注册现场核查组,及时组织实施注册现场核查,并提前通知被核查单位。
第六条保健食品注册现场核查工作由核查组具体实施。
核查组由 2 人以上组成,指定 1 人为组长。
第七条注册现场核查开始时,核查组应当出示食品药品监督管理部门出具的书面委托函,召开会议,由核查组组长向被核查单位宣布核查内容、要求和纪律等。
第八条现场核查人员可以采取交谈、查看现场、调阅相关资料等方式进行现场核查。
核查组应对核查中发现的问题如实记录,必要时应予取证,即对被核查单位的设备、仪器以及相关文件、凭证和原始记录等进行拍照、录像或复印,并要求被核查单位负责人在有关说明和复印件上签字盖章。
第九条核查组可根据核查需要调取被核查品种同期或一段时期内其它产品的相关记录。

保健食品生产许可审查细则1总则1.1制定目的为规保健食品生产许可审查工作,督促企业落实主体责任,保障保健食品质量安全,依据《中华人民国食品安全法》《食品生产许可管理办法》《保健食品注册与备案管理办法》《保健食品良好生产规》《食品生产许可审查通则》等相关法律法规和技术标准的规定,制定本细则。
1.2适用围本细则适用于中华人民国境保健食品生产许可审查,包括书面审查、现场核查等技术审查和行政审批。
1.3职责划分1.3.1国家食品药品监督管理总局负责制定保健食品生产许可审查标准和程序,指导各省级食品药品监督管理部门开展保健食品生产许可审查工作。
1.3.2省级食品药品监督管理部门负责制定保健食品生产许可审查流程,组织实施本行政区域保健食品生产许可审查工作。
1.3.3承担技术审查的部门负责组织保健食品生产许可的书面审查和现场核查等技术审查工作,负责审查员的遴选、培训、选派以及管理等工作,负责具体开展保健食品生产许可的书面审查。
1.3.4审查组具体负责保健食品生产许可的现场核查。
1.4审查原则1.4.1规统一原则。
统一颁发保健食品生产企业《食品生产许可证》,明确保健食品生产许可审查标准,规审查工作流程,保障审查工作的规有序。
1.4.2科学高效原则。
按照保健食品剂型形态进行产品分类,对申请增加同剂型产品以及生产条件未发生变化的,可以不再进行现场核查,提高审查工作效率。
1.4.3公平公正原则。
厘清技术审查与行政审批的关系,由技术审查部门组织审查组负责技术审查工作,日常监管部门负责选派观察员参与现场核查,确保审查工作的公平公正。
2 受理2.1材料申请2.1.1保健食品生产许可申请人应当是取得《营业执照》的合法主体,符合《食品生产许可管理办法》要求的相应条件。
2.1.2申请人填报《食品生产许可申请书》,并按照《保健食品生产许可申请材料目录》(附件1)的要求,向其所在地省级食品药品监督管理部门提交申请材料。
2.1.3保健食品生产许可,申请人应参照《保健食品生产许可分类目录》(附件2)的要求,填报申请生产的保健食品品种明细。

某食品厂生产加工必备条件现场核查表2. 生产设备:检查生产设备是否完好,有无生锈或者损坏。
设备是否定期清洁和消毒,有无异物残留。
3. 原料存储:检查原料的存储环境,是否符合要求。
原料是否放置在干燥通风的环境中,有无异味或者受潮。
4. 生产作业:检查生产作业环节是否符合食品卫生标准。
员工是否有着整洁的工作服,是否戴着帽子和口罩。
5. 生产过程:检查生产过程中是否按照标准操作,有无交叉污染的可能。
是否定期对生产环境进行清洁和消毒。
6. 包装和储存:检查产品包装和储存环节,是否符合卫生要求。
包装是否密封完好,有无损坏。
7. 废弃物处理:检查废弃物处理是否符合环保要求。
是否有专门的处理区域,处理方式是否符合相关法规。
8. 卫生监控:检查卫生监控的设施和记录是否齐全完善,是否按照要求进行监控。
9. 员工卫生管理:检查员工的健康证明和培训记录,是否符合相关要求。
员工是否每天进行健康检查。
10. 紧急事故预防:检查是否有健全的紧急事故预防和应急处置措施,是否定期进行演练和检查。
以上为某食品厂生产加工必备条件现场核查表,对以上内容进行详细检查,并做出记录和整改。
对于食品厂生产加工必备条件的现场核查,在完成上述检查之后,还需要对一些其他的重要条件进行核查和补充。
以下是一个更加详细的检查表,以确保食品厂生产加工环境的卫生和安全:11. 水质和用水:检查厂内用水是否符合卫生标准,有无受到污染的可能。
是否定期对用水进行检测和处理,确保水质符合要求。
12. 空气质量:检查厂内空气质量是否清新,有无异味或者污染。
是否有专门的通风系统,确保生产过程中的空气质量符合卫生要求。
13. 生产记录和追溯:检查生产记录和追溯体系是否完善。
是否对原料和产品进行追溯,以确保产品质量可追溯。
14. 化学品和危险品储存:检查危险化学品的储存和使用是否符合相关规定,有无泄漏或者异味。
是否有专门的储存和处理区域。
15. 卫生设施:检查员工卫生设施和设备是否齐全完善。

保健食品生产许可审查细则目录1 总则 (4)1.1制定目的 (4)1.2适用范围 (4)1.3职责划分 (4)1.4审查原则 (5)2 受理 (5)2.1材料申请 (5)2.2受理 (6)2.3移送 (6)3 技术审查 (6)3.1书面审查 (6)3.1.1审查程序 (6)3.1.2审查内容 (7)3.1.3做出审查结论 (7)3.2现场核查 (8)3.2.1组织审查组 (8)3.2.2审查程序 (9)3.2.3审查内容 (10)3.2.4做出审查结论 (11)3.3审查意见 (11)4 行政审批 (12)4.1复查 (12)4.2决定 (12)4.3制证 (12)5 变更、延续、注销、补办 (13)5.1变更 (13)5.2延续 (14)5.3注销 (15)5.4补办 (15)6 附则 (15)保健食品生产许可审查细则1 总则1.1制定目的为规范保健食品生产许可审查工作,督促企业落实主体责任,保障保健食品质量安全,依据《中华人民共和国食品安全法》《食品生产许可管理办法》《保健食品注册与备案管理办法》《保健食品良好生产规范》《食品生产许可审查通则》等相关法律法规和技术标准的规定,制定本细则。
1.2适用范围本细则适用于中华人民共和国境内保健食品生产许可审查,包括书面审查、现场核查等技术审查和行政审批。
1.3职责划分1.3.1国家食品药品监督管理总局负责制定保健食品生产许可审查标准和程序,指导各省级食品药品监督管理部门开展保健食品生产许可审查工作。
1.3.2省级食品药品监督管理部门负责制定保健食品生产许可审查流程,组织实施本行政区域保健食品生产许可审查工作。
1.3.3承担技术审查的部门负责组织保健食品生产许可的书面审查和现场核查等技术审查工作,负责审查员的遴选、培训、选派以及管理等工作,负责具体开展保健食品生产许可的书面审查。
1.3.4审查组具体负责保健食品生产许可的现场核查。
1.4审查原则1.4.1规范统一原则。
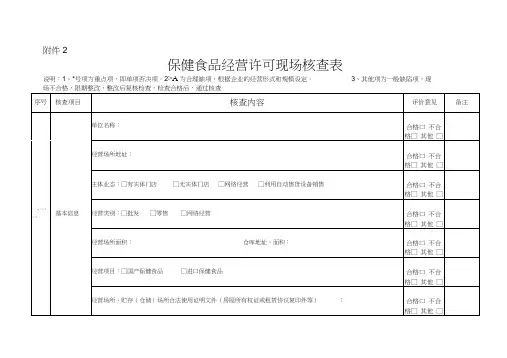

.附件1食品经营许可(食品销售)现场核查表名称:法定代表人(负责人):经营场所:贮存场所:省食品药品监视管理局监制食品经营许可(食品销售)现场核查围(一) 食品销售经营者类别□食品批发商、□商场超市(□大型、□中型、□便利店)、□食杂店、□食品自动售货销售商、□网络食品销售商(二)食品经营工程1. □预包装食品销售〔□不含冷藏冷冻食品、□含冷藏冷冻食品〕2. □散装食品销售〔□不含冷藏冷冻食品、□含冷藏冷冻食品〕3. □特殊食品销售〔□保健食品、□特殊医学用途配方食品、□婴幼儿配方乳粉、□其他婴幼儿配方食品〕. >4. □其他类食品销售5、□食品制售〔□热食类食品、□冷食类食品、□生食类食品、□含裱花蛋糕糕点类、□不含裱花蛋糕糕点类、□不含压力容器制作的自制饮品〕(三) 食品贮存场所□在本经营场所、□在本经营场所外- 2 -.. >- 4 -.. >- 6 -.2、现场核查工程按其对食品平安的影响程度,共分为55项,其中关键项37项、重点项14项和一般项4项(关键项是对食品平安有重大影响的工程,重点项是对食品平安有较大影响的工程,其余工程为一般项)。
〔***表示关键项,**为重点项,*为一般项〕。
"合理缺项〞为不涉及该类核查工程。
现场核查时,关键项必须全部符合〔合理缺项除外〕,重点项不符合的不得超过3项,一般项为引导和鼓励项。
现场核查结果实行综合判定。
对重点项不符合要求的,在现场核查工作完毕后15个工作日完成整改。
. >- 8 -。

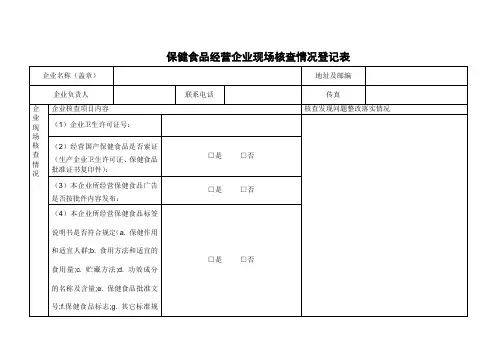
特殊食品(保健食品)经营许可现场核查表
单位名称:住所:
经营场所:仓库地址:
核查人员:核查日期:
主体业态:特殊食品(保健食品)经营者(口含网络经营口含利用自动售货设备销售口含外设仓库)主体类别:
□药品批发企业口零售药店口药品连锁总部口药品连锁门店
口普通食品一级批发口普通食品其他批发口零售统一配送总部口零售统一配送门店口食杂店
口餐饮服务单位口单位食堂
直销企业:口省级分公司口市级分公司口县级分公司
专营商:口省级代理商口市级代理商口县级代理商
现场审查表现场检查项共45项,其中关键项项(*号表示),一般项项
自动售货设备
制度建设
注:1、关键项出现“不符合”情形,核查结论即判定为“不符合”;
2、一般项出现“不符合”情形,且项数>一般项总核查数30%的,核查结论判定为“不符合”
申请人签名(公章):
核查人员签名:
保健食品经营许可现场核查报告。

食品经营许可现场核查表适用于食品销售名称:经营场所:法定代表人(负责人):核查日期:年月日主体业态:□商场超市(□大型□中型□便利店)□食杂店□食品批发经营者□无实体门店食品经营者为不符合;3.本表核查内容中1-2项为通用要求,申请所有类别的经营项目均应符合通用要求;4.关键项必须全部符合(合理缺项除外),一般项“符合”的比例应超过总数(合理缺项除外)的75%以上;5.各地可根据本地实际进一步细化现场核查标准。
现场核查汇总表核查意见:符合□不符合□核查人员签名:申请人阅后签名:日期:日期:附件3-2食品经营许可现场核查表适用于□餐饮服务经营者(□特大型餐饮、□大型餐饮、□中型餐饮、□小型餐饮、□中央厨房、□集体用餐配送单位)、□单位食堂(□学校食堂、□托幼机构食堂)、□就餐人数50人以上的其他类单位食堂。
名称:经营场所:法定代表人(负责人):核查日期:年月日经营项目:□热食类食品制售□冷食类食品制售□生食类食品制售□糕点类食品制售(□含裱花蛋糕□不含裱花蛋糕)□自制饮品制售(□普通类□自酿酒□鲜奶吧)应作为不符合;3、本表核查内容中1-14项为通用要求,申请所有类别的经营项目均应符合通用要求,除热食外的其他经营项目除应满足一般要求外还应同时满足其他相应要求;4、关键项必须全部符合(合理缺项除外),一般项“符合”的比例应超过总数(合理缺项除外)的75%以上;5、各地可根据本地实际进一步细化现场核查标准。
现场核查汇总表核查人员签名:申请人阅后签名:日期:日期:附件3-3食品经营许可现场核查表适用于□餐饮服务经营者(小微餐饮)、□就餐人数50人(含50人)以下的单位食堂(□建筑工地食堂□机关企事业单位食堂□养老机构食堂□其他食堂)。
名称:经营场所:法定代表人(负责人):核查日期:年月日经营项目:□热食类食品制售□冷食类食品制售□糕点类食品制售(□含裱花蛋糕□不含裱花蛋糕)□自制饮品制售(□普通类)作为不符合;3、本表核查内容中1-8项为通用要求,申请所有类别的经营项目均应符合通用要求,除热食外的其他经营项目除应满足通用要求外还应同时满足其他相应要求;4、关键项必须全部符合(合理缺项除外),一般项“符合”的比例应超过总数(合理缺项除外)的80%以上;5、各地可根据本地实际进一步细化现场核查标准。

C.1食品经营许可现场核查表贵州省食品经营许可现场核查表(本表适用于食品销售)经营者名称:法定代表人(负责人):经营场所:仓库地址:核查时间:实用文档实用文档填表说明1、本核查表适用于对《食品经营许可证》申请、变更、换证的经营单位进行现场核查评价。
2、现场核查项目按其对食品安全的影响程度,分为关键项(*)和一般项(/)。
每一个核查项目的评价意见为“符合”、“不符合”或“合理缺陷”,其中:“符合”在“评价意见”栏内画“√”,不符合画“×”,合理缺项画“○”。
项目中的内容如部分不符合,应作为不符合。
实用文档3、核查项目共42项,其中关键项18项,一般项24项。
关键项有1项不符合,则核查意见为“不合格”;所有关键项(合理缺项除外)符合,一般项(合理缺项除外)不符合比例超过20%,则核查结论为实用文档“不合格”。
4、核查人员应针对不符合的项目提出相应的整改要求。
5、限期整改后复查,核查结论仍为“不符合”的,不再安排现场核查。
6、核查人员应如实填写本核查表中的内容。
实用文档实用文档实用文档实用文档实用文档实用文档实用文档实用文档实用文档实用文档当事人(签名或盖章):年月日C.2食品经营许可经营场所现场核记录食品经营许可现场核查记录()第号实用文档申请人:申请经营项目:核查地点:核查时间:实用文档核查记录:核查结论:□符合规定□限期整改□不符合规定□整改后符合规定□整改后不符合规定实用文档实用文档当事人(签名或盖章):核查人签名:年月日年月日备注:本记录一式两联,第一联留存卷宗备查,第二联交当事人。
如有侵权请联系告知删除,感谢你们的配合!24675 6063 恣22974 59BE 妾N(30564 7764 睤20126 4E9E 亞720295 4F47 佇332628 7F74 罴20741 5105 儅25122 6222 戢26992 6970 楰v39856 9BB0 鮰实用文档。
保健食品GMP质量体系RD00300片剂生产过程监督检查记录日期:XXXX年XX月XX日检查人员:XXX一、设备检查1.检查前一批片剂生产所使用的设备清洁情况,未发现残留物或异物。
2.检查本次生产所使用的设备,设备表面无油污或尘埃,运转正常,无异常噪声。
二、操作人员检查1.检查操作人员穿戴情况,所有操作人员均佩戴统一工作服,无携带私人物品。
2.检查操作人员卫生状况,操作人员手部洗涤干净,无明显的伤口或湿润。
三、原辅材料检查1.核对原材料清单,与实际入库的原辅材料相符,无过期产品。
2.检查原辅材料的包装完整性,无破损、潮湿、霉变等情况。
3.取样检查原辅材料的外观、颜色、气味等指标,未发现异常情况。
4.查看原辅材料的存储条件,符合要求,无直接暴露在阳光下或湿度过高的情况。
四、生产过程检查1.检查称量操作,操作人员准确称取原辅材料,并记录称量值,计算准确无误。
2.检查混料操作,混料时间达到要求,操作人员按工艺要求进行搅拌,在此过程中无异常情况发生。
3.检查压片操作,操作人员按照规范操作,压片机压制平稳,片剂的外观整齐无碎裂,符合要求。
五、设备清洁检查1.检查制药设备的清洁状况,设备表面干净光滑,无残留物或污渍。
2.检查生产区域的清洁情况,地面、墙壁无污垢或粉尘,无异味。
六、记录检查1.检查生产记录完整性,记录齐全,无缺失。
2.检查操作人员的纪律性,记录的填写准确无误。
3.检查记录的签字、日期和审核人员,签字规范,日期和审核人员正确。
七、不合格品处理1.未发现生产过程中的不合格品。
2.若出现不合格品,按照相关制度进行处理,作记录并上报高层管理人员。
八、问题与改进1.本次检查未发现任何问题或改进建议。
2.若发现问题或改进建议,经过记录并上报高层管理层,跟踪处理情况。
本次监督检查中未发现任何不合规、不符合GMP质量体系的情况,片剂生产过程规范、设备清洁、操作人员卫生符合要求。
建议维持当前操作程序和设备状态,确保保健食品生产过程的GMP质量体系运行正常。