病毒TCID50测定
- 格式:doc
- 大小:237.00 KB
- 文档页数:6

tcid50法TCID50法是一种常用的病毒感染力测定方法,用于评估病毒的感染力和浓度。
TCID50法全称为50%细胞传染病毒感染量法,是通过观察细胞感染情况来确定病毒的感染量。
下面将介绍TCID50法的原理、步骤和应用。
一、原理TCID50法是通过连续稀释病毒悬液,将其与细胞共培养,观察细胞感染情况,最后根据感染阳性和阴性的比例计算病毒的感染量。
具体原理如下:1. 取一定量的病毒悬液,进行连续稀释。
2. 将不同稀释度的病毒悬液与细胞共培养。
3. 观察培养后的细胞,根据细胞的感染情况判断阳性和阴性。
4. 根据阳性和阴性的比例,使用统计学方法计算出病毒的感染量。
二、步骤TCID50法的操作步骤如下:1. 准备好所需的培养基、细胞和病毒悬液。
2. 进行病毒的连续稀释,一般为10倍稀释。
3. 将不同稀释度的病毒悬液分别与细胞共培养,通常为96孔板形式。
4. 培养一定时间后,观察细胞的感染情况,记录阳性和阴性的孔数。
5. 根据阳性和阴性的比例,使用统计学方法计算出病毒的感染量。
三、应用TCID50法广泛应用于病毒学研究和生物制品生产中,具有以下几个方面的应用:1. 评估病毒的感染力:通过TCID50法可以确定病毒的感染力大小,对于病毒学研究和防控具有重要意义。
2. 测定病毒的浓度:通过TCID50法可以估算病毒的浓度,为病毒制备和应用提供参考。
3. 监测疫苗效果:通过TCID50法可以评估疫苗的效果,判断其对病毒的抑制作用。
4. 生物制品质量控制:TCID50法可以用于生物制品的质量控制,保证产品的安全有效性。
总结:TCID50法是一种常用的病毒感染力测定方法,通过观察细胞的感染情况来评估病毒的感染量。
其原理简单易懂,步骤清晰明了。
TCID50法在病毒学研究和生物制品生产中具有重要应用价值,可以评估病毒的感染力和浓度,监测疫苗效果,并用于生物制品的质量控制。
通过TCID50法的应用,可以更好地了解和控制病毒的感染过程,为病毒学研究和疫苗生产提供科学依据。

tcid50计算方法一、什么是tcid50tcid50是一种用于测定病毒感染力的计算方法,全称为50%组织培养传染量(50% tissue culture infectious dose)。
简单来说,tcid50是表示50%感染组织培养细胞所需的病毒数量。
要计算tcid50,需要进行以下步骤:1. 首先,将待测病毒样品进行一系列稀释。
通常,会进行10倍的稀释,如1:10、1:100、1:1000等。
每个稀释液通常都设置3个或更多的重复。
2. 将每个稀释液分别接种到细胞培养板中的细胞上。
细胞培养板通常分为96孔板,每孔有一定数量的细胞。
3. 在接种后,将细胞培养板放入恰当的条件下培养,让病毒感染细胞。
4. 一段时间后,观察细胞的变化。
如果细胞被病毒感染,细胞会出现病毒感染的特征,如细胞形态改变、细胞死亡等。
5. 根据观察结果,记录每个稀释液中感染细胞的情况,包括阳性孔和阴性孔的数量。
6. 使用统计学方法,计算出50%感染组织培养细胞所需的病毒数量。
这个数量就是tcid50值。
三、tcid50的应用tcid50是一种常用的病毒感染力测定方法,广泛应用于医学、生物学、农业等领域的研究中。
它可以用来评估病毒的感染力,研究病毒的病原性、传播途径等。
在疫苗研发中,tcid50可以用来评估疫苗的有效性。
疫苗通常会被稀释后接种到细胞上,通过计算tcid50可以确定疫苗的效果,以及需要接种多少疫苗才能达到预期的免疫效果。
tcid50还可以用于病毒感染的流行病学研究。
通过测定不同病毒株的tcid50值,可以比较它们的感染力,从而了解病毒的传播途径、传播速度等信息。
总结:tcid50是一种常用的病毒感染力测定方法,通过稀释病毒样品、接种细胞培养板、观察细胞变化等步骤,计算出50%感染组织培养细胞所需的病毒数量。
tcid50的应用广泛,可以用于评估疫苗的有效性,研究病毒的病原性和传播途径等。
通过tcid50的计算,可以更好地了解病毒的特性,为疫苗研制和疾病防控提供科学依据。

实验四病毒感染力的滴定(TCID50的测定)一、实验目的了解病毒感染力测定的几种常用方法,掌握半数细胞培养物感染量TCID50的操作步骤、计算方法及含义。
二、测定病毒感染力的方法( 50% lethal dose):用动物或鸡胚来检测半数致死量LD50半数鸡胚感染量EID(egg 50% infective dose):用鸡胚来检测50(50% tissue culture infective dose):用细胞半数细胞培养物感染量TCID50来检测蚀斑形成单位(plaque forming unit,PFU):用细胞来检测三、材料1、长满单层的细胞1瓶2、胰酶、吸球、吸管、生长液3、96孔细胞培养板4、加样器、枪头5、病毒液(PRV)四、TCID50的操作步骤1、在青霉素瓶或离心管中将病毒液作连续10倍的稀释,从10-1-10-10。
2、将稀释好的病毒接种到96孔微量培养板中,每一稀释度接种一纵排共8 孔,每孔接种100µl。
3、在每孔加入细胞悬液100µl,使细胞量达到2~3×105个/ml。
4、设正常细胞对照,正常细胞对照作两纵排。
(100µl生长液+100µl细胞悬液)5、逐日观察并记录结果,一般需要观察5-7天。
6、结果的计算,按Reed-Muench两氏法或Karber法五、TCID50的计算方法1、Reed-Muench两氏法CPE:Cytopathic effect距离比例=(高于50%病变率的百分数-50%)/(高于50%病变率的百分数-低于50%病变率的百分数)=(91.6-50)/(91.6-40)= 0.8=距离比例×稀释度对数之间的差+高于50%病变率的稀释度的对数lgTCID50=0.8×(-1)+(-3)=-3.8TCID=10-3.8/0.1ml50含义:将该病毒稀释103.8接种100µl可使50%的细胞发生病变。
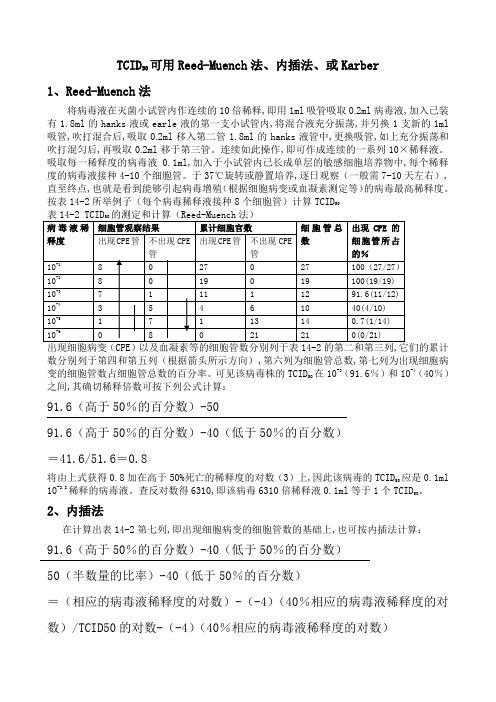
TCID50可用Reed-Muench法、内插法、或Karber1、Reed-Muench法将病毒液在灭菌小试管内作连续的10倍稀释,即用1ml吸管吸取0.2ml病毒液,加入已装有1.8ml的hanks液或earle液的第一支小试管内,将混合液充分振荡,并另换1支新的1ml 吸管,吹打混合后,吸取0.2ml移入第二管1.8ml的hanks液管中,更换吸管,如上充分振荡和吹打混匀后,再吸取0.2ml移于第三管。
连续如此操作,即可作成连续的一系列10×稀释液。
吸取每一稀释度的病毒液0.1ml,加入于小试管内已长成单层的敏感细胞培养物中,每个稀释度的病毒液接种4-10个细胞管。
于37℃旋转或静置培养,逐日观察(一般需7-10天左右),直至终点,也就是看到能够引起病毒增殖(根据细胞病变或血凝素测定等)的病毒最高稀释度。
按表14-2所举例子(每个病毒稀释液接种8个细胞管)计算TCID50数分别列于第四和第五列(根据箭头所示方向),第六列为细胞管总数,第七列为出现细胞病在10-3(91.6%)和10-4(40%)变的细胞管数占细胞管总数的百分率。
可见该病毒株的TCID50之间,其确切稀释倍数可按下列公式计算:91.6(高于50%的百分数)-5091.6(高于50%的百分数)-40(低于50%的百分数)=41.6/51.6=0.8应是0.1ml 将由上式获得0.8加在高于50%死亡的稀释度的对数(3)上,因此该病毒的TCID50。
10-3.8稀释的病毒液。
查反对数得6310,即该病毒6310倍稀释液0.1ml等于1个TCID502、内插法在计算出表14-2第七列,即出现细胞病变的细胞管数的基础上,也可按内插法计算:91.6(高于50%的百分数)-40(低于50%的百分数)50(半数量的比率)-40(低于50%的百分数)=(相应的病毒液稀释度的对数)-(-4)(40%相应的病毒液稀释度的对数)/TCID50的对数-(-4)(40%相应的病毒液稀释度的对数)解上式得TCID的对数为0.8,结果与Reed-Muench503、Karber法按表14-3及5 Karber公式计算TCID效价:50s=阳性管比率总和。

病毒TCID50 测定操作步骤(1)准备细胞取出一块细胞培养板,每个孔大约传8000〜10000个细胞(一个T25瓶的细胞消化后加 10ml 培养液正好传一块96 孔板,要传匀)。
每个孔的细胞铺成单层大约60 %丰度即可接种病毒(下午传好板第二天早上就能用)。
细胞对照选取16 个孔即可。
滴定与对照可以在一块培养板上进行,操作中注意不要窜孔。
也可以分别在不同的细胞培养板上进行,但要保证实验条件一致。
(2)稀释待测病毒液。
A 法为参考书上标准的操作方法B 法参照书将液体量减少后的结果病毒稀释液根据是否需要胰酶来选择适合的液体,无论哪种都无血清。
A 向每支试管中加入 1.8ml 病毒稀释液。
向 1 号试管中加入 0.2ml 病毒,依次 10 倍系列稀释至适宜浓度,最后一支试管。
B在EP管中用无血清的孵育液10倍倍比稀释病毒原液(10-1 , 10- 2…10-10等),根据病毒大致的滴度确定稀释的倍数。
首次滴定可以多稀释几个滴度。
根据接种的孔数稀释病毒,常规每个稀释度接种4孔,则每个稀释度配500口 l,即10-1 为50 口1加入450口1的孵育液中;如每个稀释度接种8个孔,则各配制1ml,即10-1为 100口1加入900^1孵育液中。
若接种8个孔,则相应增加液体量。
上述的配液并不是固定不变的,可以根据接种的量自行调整。
【!此步操作注意事项:1)建议每个稀释度接种 8个孔,若要统计分析则还要增加至 16 个孔。
2)病毒稀释过程中一定将病毒液与孵育液充分混匀。
2)此过程中需要使用加样器和tip头。
使用前用75%乙醇擦拭加样器,并用紫外线照射 20min ,确保无菌。
使用新高压的 tip 头,外包装一定在超净台(或安全柜中打开)。
】(3)接种取细胞培养板,用多道加样器(又称排枪)吸去 96 孔板中的培养液,吸取孵育液加在每孔中再轻轻吹打一次,然后吸出孵育液(此步目的是去除血清,因为血清能干扰病毒的吸附)。

病毒TCID50测定(组织半数感染量)操作步骤(1)准备细胞取出一块细胞培养板,每个孔大约传8000~10000个细胞(一个T25瓶的细胞消化后加10ml培养液正好传一块96孔板,要传匀)。
每个孔的细胞铺成单层大约60%丰度即可接种病毒(下午传好板第二天早上就能用)。
细胞对照选取16个孔即可。
滴定与对照可以在一块培养板上进行,操作中注意不要窜孔。
也可以分别在不同的细胞培养板上进行,但要保证实验条件一致。
(2) 稀释待测病毒液。
A法为参考书上标准的操作方法B法参照书将液体量减少后的结果病毒稀释液根据是否需要胰酶来选择适合的液体,无论哪种都无血清。
A向每支试管中加入1.8ml病毒稀释液。
向1号试管中加入0.2ml病毒,依次10倍系列稀释至适宜浓度,最后一支试管。
B在EP管中用无血清的孵育液10倍倍比稀释病毒原液(10-1,10-2…10-10等),根据病毒大致的滴度确定稀释的倍数。
首次滴定可以多稀释几个滴度。
根据接种的孔数稀释病毒,常规每个稀释度接种4孔,则每个稀释度配500µl,即10-1为50µl加入450µl的孵育液中;如每个稀释度接种8个孔,则各配制1ml,即10-1为100µl加入900µl孵育液中。
若接种8个孔,则相应增加液体量。
上述的配液并不是固定不变的,可以根据接种的量自行调整。
【!此步操作注意事项:1)建议每个稀释度接种8个孔,若要统计分析则还要增加至16个孔。
2)病毒稀释过程中一定将病毒液与孵育液充分混匀。
2)此过程中需要使用加样器和tip头。
使用前用75%乙醇擦拭加样器,并用紫外线照射20min,确保无菌。
使用新高压的tip头,外包装一定在超净台(或安全柜中打开)。
】(3) 接种取细胞培养板,用多道加样器(又称排枪)吸去96孔板中的培养液,吸取孵育液加在每孔中再轻轻吹打一次,然后吸出孵育液(此步目的是去除血清,因为血清能干扰病毒的吸附)。
病毒TCID50测定(组织半数感染量)操作步骤(1)准备细胞取出一块细胞培养板,每个孔大约传8000~10000个细胞(一个T25瓶的细胞消化后加10ml培养液正好传一块96孔板,要传匀)。
每个孔的细胞铺成单层大约60%丰度即可接种病毒(下午传好板第二天早上就能用)。
细胞对照选取16个孔即可。
滴定与对照可以在一块培养板上进行,操作中注意不要窜孔。
也可以分别在不同的细胞培养板上进行,但要保证实验条件一致。
(2) 稀释待测病毒液。
A法为参考书上标准的操作方法B法参照书将液体量减少后的结果病毒稀释液根据是否需要胰酶来选择适合的液体,无论哪种都无血清。
A向每支试管中加入1.8ml病毒稀释液。
向1号试管中加入0.2ml病毒,依次10倍系列稀释至适宜浓度,最后一支试管。
B在EP管中用无血清的孵育液10倍倍比稀释病毒原液(10-1,10-2…10-10等),根据病毒大致的滴度确定稀释的倍数。
首次滴定可以多稀释几个滴度。
根据接种的孔数稀释病毒,常规每个稀释度接种4孔,则每个稀释度配500µl,即10-1为50µl加入450µl的孵育液中;如每个稀释度接种8个孔,则各配制1ml,即10-1为100µl加入900µl孵育液中。
若接种8个孔,则相应增加液体量。
上述的配液并不是固定不变的,可以根据接种的量自行调整。
【!此步操作注意事项:1)建议每个稀释度接种8个孔,若要统计分析则还要增加至16个孔。
2)病毒稀释过程中一定将病毒液与孵育液充分混匀。
2)此过程中需要使用加样器和tip头。
使用前用75%乙醇擦拭加样器,并用紫外线照射20min,确保无菌。
使用新高压的tip头,外包装一定在超净台(或安全柜中打开)。
】(3) 接种取细胞培养板,用多道加样器(又称排枪)吸去96孔板中的培养液,吸取孵育液加在每孔中再轻轻吹打一次,然后吸出孵育液(此步目的是去除血清,因为血清能干扰病毒的吸附)。
tcid50法TCID50法是一种常用的病毒滴度测定方法,用于评估病毒溶液中的活性病毒数量。
TCID50是指病毒的50%组织细胞传染性滴度。
病毒滴度是指病毒溶液中含有多少活性病毒颗粒的浓度。
确定病毒滴度的目的是为了量化病毒溶液中的活性病毒数量,从而为研究人员提供准确的病毒浓度信息,用于病毒研究、疫苗制备和药物筛选等领域。
TCID50法是通过对细胞培养物进行稀释接种,然后观察细胞的病毒感染情况来测定病毒滴度的一种方法。
具体操作过程如下:将细胞培养物均匀地分配到培养皿中。
然后,将病毒溶液进行一系列的稀释,每次稀释一倍,得到一系列的稀释液。
接下来,将每个稀释液滴加到培养皿中的不同孔上。
然后,将培养皿放入恒温培养箱中,让病毒与细胞进行接种。
接种一段时间后,观察培养皿中细胞的感染情况。
可以通过显微镜观察细胞形态的变化,或者通过染色等方法来观察病毒感染的细胞。
根据感染细胞的数量和稀释液的稀释倍数,计算出病毒的TCID50值。
通常,TCID50值是通过统计病毒感染和未感染细胞的比例来计算的。
TCID50值越高,表示病毒的传染性越低;而TCID50值越低,表示病毒的传染性越高。
因此,通过TCID50值可以评估病毒的感染能力和传播能力。
TCID50法具有操作简单、结果可靠的优点,因此被广泛应用于病毒研究和疫苗制备过程中。
通过测定病毒的TCID50值,可以帮助研究人员评估病毒的传播能力和感染能力,从而指导病毒研究和疫苗制备的实验设计。
TCID50法是一种常用的病毒滴度测定方法,通过对细胞培养物进行稀释接种,然后观察细胞的病毒感染情况来测定病毒滴度。
通过测定病毒的TCID50值,可以评估病毒的传播能力和感染能力,为病毒研究和疫苗制备提供准确的病毒浓度信息。
实验病毒感染力的滴定(TCID50的测定)滴度:在半定量或定量测定中,将标本作一系列稀释后进行试验,呈阳性反应的最高稀释度即为滴度。
根据滴度的高低,可以判断标本反应性的强弱。
滴度(抗体的多少)越高,受传染的机会就越小。
一、实验目的了解病毒感染力测定的几种常用方法,掌握半数细胞培养物感染量TCID50的操作步骤、计算方法及含义。
二、测定病毒感染力的方法半数致死量LD50( 50% lethal dose):用动物或鸡胚来检测半数鸡胚感染量EID50(egg 50% infective dose):用鸡胚来检测半数细胞培养物感染量TCID50(50% tissue culture infective dose):用细胞来检测蚀斑形成单位(plaque forming unit,PFU):用细胞来检测三、材料1、长满单层的细胞1瓶2、胰酶、吸球、吸管、生长液3、96孔细胞培养板4、加样器、枪头5、病毒液(PRV)四、TCID50的操作步骤1、在离心管中用MEM将病毒液作连续10倍的稀释,从10-1-10-6。
2、将稀释好的病毒接种到96孔培养板中,每一稀释度接种一纵排,共8 孔,每孔接种100µl。
3、在每孔加入细胞悬液100µl,使细胞量达到2~3×105个/ml。
4、设正常细胞对照,正常细胞对照作两纵排。
(100µl生长液+100µl细胞悬液)5、逐日观察并记录结果,一般需要观察5-7天。
6、结果的计算,按Reed-Muench两氏法或Karber法。
五、TCID50的计算方法1、Reed-Muench两氏法(CPE:Cytopathic effect细胞病变影响)距离比例=(高于50%病变率的百分数-50%)/(高于50%病变率的百分数-低于50%病变率的百分数)=(91.6-50)/(91.6-40)=0.8lg TCID50=距离比例×稀释度对数之间的差+高于50%病变率的稀释度的对数=0.8×(-1)+(-3)=-3.8TCID50=10-3.8/0.1ml含义:将该病毒稀释103.8接种100µl可使50%的细胞发生病变。
病毒感染力的滴定(TCID50的测定)概念:半数感染量(median infective dose, ID50)表示在规定时间内,通过指定感染途径,使一定体重或年龄的某种动物半数感染所需最小细菌数或毒素量。
一、实验目的了解病毒感染力测定的几种常用方法,掌握半数细胞培养物感染量TCID50的操作步骤、计算方法及含义。
二、测定病毒感染力的方法半数致死量LD50( 50% lethal dose):用动物或鸡胚来检测半数鸡胚感染量EID50(egg 50% infective dose):用鸡胚来检测半数细胞培养物感染量TCID50(50% tissue culture infective dose):用细胞来检测蚀斑形成单位(plaque forming unit,PFU):用细胞来检测三、材料1、长满单层的细胞1瓶2、胰酶、吸球、吸管、生长液3、96孔细胞培养板4、加样器、枪头5、病毒液(PRV)四、TCID50的操作步骤1、在青霉素瓶或离心管中将病毒液作连续10倍的稀释,从10-1-10-10。
2、将稀释好的病毒接种到96孔微量培养板中,每一稀释度接种一纵排共8 孔,每孔接种100µl。
3、在每孔加入细胞悬液100µl,使细胞量达到2~3×105个/ml。
4、设正常细胞对照,正常细胞对照作两纵排。
(100µl生长液+100µl细胞悬液)5、逐日观察并记录结果,一般需要观察5-7天。
lgTCID50=L-d(s-0.5)L:最高稀释度的对数D:稀释度对数之间的差S:阳性孔比率总和lgTCID50=-1-1×(3.375-0.5)=-3.875TCID50=10-3.875/0.1ml含义:将该病毒稀释103.875接种100µl可使50%的细胞发生病变。
实例1鸡新城疫活疫苗(一)培养病毒将鸡新城疫病毒(la sota株)接种于9~11d鸡胚的尿囊腔中,接种后48~72h收获病毒,供检测与制苗用。
病毒TCID50测定
操作步骤
(1) 准备细胞
取出一块细胞培养板,每个孔大约传8000~10000个细胞(一个T25瓶的细
胞消化后加10ml培养液正好传一块96孔板,要传匀)。
每个孔的细胞铺成单层大约60%丰度即可接种病毒(下午传好板第二天早上就能用)。
细胞对照选取16个孔即可。
滴定与对照可以在一块培养板上进行,操作中注意不要窜孔。
也可以分别在不同的细胞培养板上进行,但要保证实验条件一致。
(2) 稀释待测病毒液。
A法为参考书上标准的操作方法
B法参照书将液体量减少后的结果
病毒稀释液根据是否需要胰酶来选择适合的液体,无论哪种都无血清。
A向每支试管中加入1.8ml病毒稀释液。
向1号试管中加入0.2ml病毒,依次10倍系列稀释至适宜浓度,最后一支试管。
B在EP管中用无血清的孵育液10倍倍比稀释病毒原液(10-1,10-2…10-10等),根据病毒大致的滴度确定稀释的倍数。
首次滴定可以多稀释几个滴度。
根据接种的孔数稀释病毒,常规每个稀释度接种4孔,则每个稀释度配500µl,即10-1为50µl加入450µl的孵育液中;如每个稀释度接种8个孔,则各配制1ml,即10-1为100µl加入900µl孵育液中。
若接种8个孔,则相应增加液体量。
上述的配液并不是固定不变的,可以根据接种的量自行调整。
【!此步操作注意事项:
1)建议每个稀释度接种8个孔,若要统计分析则还要增加至16个孔。
2)病毒稀释过程中一定将病毒液与孵育液充分混匀。
2)此过程中需要使用加样器和tip头。
使用前用75%乙醇擦拭加样器,并用紫外线照射20min,确保无菌。
使用新高压的tip头,外包装一定在超净台(或安全柜中打开)。
】(3) 接种
取细胞培养板,用多道加样器(又称排枪)吸去96孔板中的培养液,吸取孵育液加在每孔中再轻轻吹打一次,然后吸出孵育液(此步目的是去除血清,因为血清能干扰病毒的吸附)。
将稀释好的病毒液加到96孔板上,每孔100µl,根据观察的习惯,一般从右到左,从上到下,从高稀释度到低稀释度(10-1,10-2 )到原液加样。
【切记:设置正常的细胞对照。
每次实验要重复4次,计算标准差。
】
37℃CO2培养箱中孵育1h,取出培养板吸去病毒液(从低浓度向高浓度吸取可避免窜孔),加入维持液200µl继续在37℃ CO2培养箱中培养。
(4) 培养
将培养板放置于CO2培养箱。
培养温度,培养天。
(5) 测定结果
取出培养板,显微镜下观察细胞病变。
计算方法
1) Spearman-Karber 法
LgCCID50 /0.2ml= - (X0 - d/2 + d×∑R1/N1)
X0 = 全部病变最低稀释度对数
d = 稀释因数对数
N1 = 每个稀释度所种的孔数
R1 = 病变孔数
∑ = 积和
LgCCID50 /ml = LgCCID50 /0.2ml +0.7
2) Reed-Muench法
观察CPE,
找出能引起半数细胞瓶或管感染的病毒稀释倍数,按计算出该病毒液的TCID50
TCID50 是指组织培养物(细胞)半数致死计量。
它有几个性质我们必须明白:1)它表示的是计量,不是浓度;2)它是一个单位;3)它的值等于1,实际上问它的值等于多少是一个没有意义的问题,就像问km的值等于多少一样,如果非要说出的的值等于多少,那我们只能说它的值在任何情况下都等于1。
理解这三个性质对于理解TCID50非常重要,但是这三个性质经常被误解,所以导致对TCID50的理解出现偏差。
首先我们来看一下这个表示法的意思:
病毒浓度为10^8.2TCID50/ml
它表示的是每ml病毒溶液里含有10^8.2个TCID50的病毒,这和氯化钠的浓度为
4.5mol/L表示每L溶液中含有4.5个mol的氯化钠是一样的道理。
经常可以听到人说我的病毒的TCID50是10^xx。
这个说法是不科学的,应该说我这个溶液里含有多少个TCID50的病毒或者说我这个溶液的病毒溶度是xxTCID50/ml.
理解了TCID50的概念之后,我们再来看看TCID50是如何计算的?
请看例子:
每个所加液体的体积是0.08ml。
图中给出的计算方法是有问题的,请先忽略不看。
从图中我们可以知道半数致死的稀释度肯定是介于10^-6到10^-7之间,肯定可以表示
成10^-6.xx。
那么这个.xx到到底是多少呢?
这实际上是一个线性插值的问题。
求解见下图:
PD/[log(dilution above 50%)-log(dilution below 50%)]=[(%next above 50%)-
50%]/[(%next above 50%)-(%next below 50%)]
*注意:如果你的病毒是以3倍3倍地稀释那么上面这个公式的log就应该是以3为底的log,其他稀释度与此相类似。
在本例子中
PD/[(-6)-(-7)]=(80%-50%)/(80%-0%)
PD=0.375
log(50%的致死的稀释度)=-6-0.375=-6.375
求解得到50%的致死的稀释度为10^-6.375
根据TCID50的定义,就把这个稀释度所含的病毒的量定义为1个TCID50.
在本例中即定义把病毒稀释到10^-6.375梯度后取0.080ml所含的病毒的量为1个TCID50.
接下来我们就可以根据这个定义来求原液的病毒溶度。
通常求解每ml含有多少个TCID50的病毒。
我们先要来求解这个问题:已知把病毒稀释到10^-6.375梯度后取0.080ml所含的病毒的量为1个TCID50,那么病毒原液直接取0.080ml有多少个TCID50.
很显然0.080ml病毒原液有10^6.375个TCID50。
再求解1ml有多少个TCID50就简单了:
设1ml这样的病毒原液就有x个TCID50
x/1ml=10^6.375/0.080ml
x=10^6.375/0.08=2.9*10^8
所以每ml这样的病毒原液有2.9*10^8个TCID50,即该病毒原液的溶度为
2.9*10^8TCID50/ml
[如果对于上面我说的“很显然“你一时显然不起来的话,我可以帮你举这样的一个例子:你把溶度未知的DNA溶液稀释100倍(即稀释到10^-2稀释度)后取0.080ml去测0D值结果发现这0.08ml的稀释液含有1个ug的DNA,那么很显然可以知道如果直接取
0.080ml的原液就应该含有100ug 的DNA,该DNA 溶液的溶度为
100ug/0.080ml=1250ug/ml。
如果你还很显然不起来的话,建议你不要从事和理工科相关的工作,你可去当总统什么的,千万别当财政部部长!]
说明:我们已经证实,TCID50法测到的滴度d=log10值比标准空斑法高0.7。
将TCID50/ml转换为PFU/ml:
T=1×108.3 TCID50/ml=1×108.3-0.7 PFU/ml=1×107.6 PFU/ml≈4×107 PFU/ml。
两次重复试验得到的滴度值应相差≤0.7个log10值(100.7)。
MOI 是multiplicity of
infection的缩写,中文译为感染复数。
传统的MOI概念起源于噬菌体感染细菌的研究。
其含义是感染时噬菌体与细菌的数量比值,也就是平均每个细菌感染噬菌体的数量。
噬菌体的数量单位为pfu。
一般认为MOI是一个比值,没有单位,其实其隐含的单位是pfu number/cell。