第五章MS-1质谱
- 格式:ppt
- 大小:1.90 MB
- 文档页数:76





MS - 质谱入门了解质谱本入门指南覆盖了现代质谱实践相关的大部分主题,并解答了质谱使用和性能方面的一些常见问题。
文中还提供了便于深入学习相关文章的链接。
第一部门内容讨论谁使用质谱仪的问题,接着讲述化合物在离子源怎样被电离,以便于质谱仪分析。
然后通过对质量准确性和分辨率等重要主题的讨论,或我们怎样区分紧密相关化合物之间的差别,来讲述各种类型的质谱仪。
本指南涉及化学、样品制备和数据处理,以及当今最流行的MS应用中一些专业用语的定义。
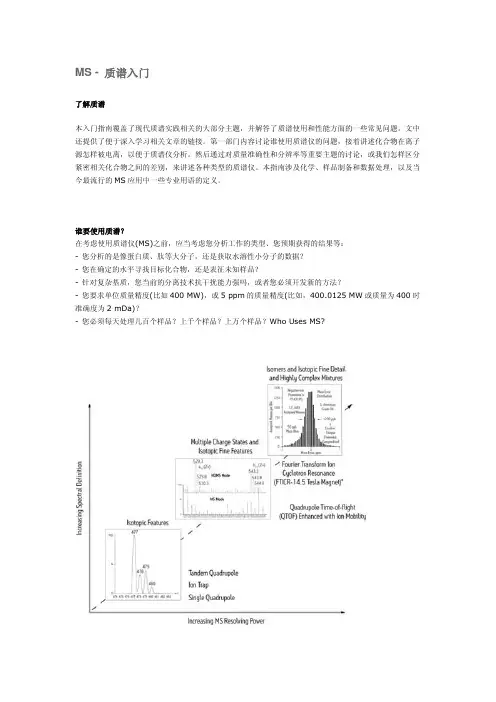
谁要使用质谱?在考虑使用质谱仪(MS)之前,应当考虑您分析工作的类型、您预期获得的结果等:- 您分析的是像蛋白质、肽等大分子,还是获取水溶性小分子的数据?- 您在确定的水平寻找目标化合物,还是表征未知样品?- 针对复杂基质,您当前的分离技术抗干扰能力强吗,或者您必须开发新的方法?- 您要求单位质量精度(比如400 MW),或5 ppm的质量精度(比如,400.0125 MW或质量为400时准确度为2 mDa)?- 您必须每天处理几百个样品?上千个样品?上万个样品?Who Uses MS?图1:表征被测物特征的能力随质谱性能的增加而增强。
化学、生物化学和物理学领域的各学科和分支学科的研究人员和专业技术人员通常会用到质谱分析。
医药工业领域的工作人员在进行药物发现和药物开发时需要利用MS的特异性、动态范围及其灵敏度,区分复杂基质中紧密相关的代谢物,从而鉴定并量化代谢物。
尤其是在药物的开发过程中,药物需要进行鉴定、纯化,确定早期的药代动力学,MS已经证实是不可或缺的工具。
生物化学家扩展了MS的使用领域,将其应用到蛋白、肽和寡核苷酸的分析中。
使用质谱仪,生物化学家们能够监测酶的反应,确定氨基酸序列,并通过包含有蛋白裂解片段衍生物样品数据库鉴别大分子蛋白。
生物化学家通过氢-氘交换在生理条件下形成重要的蛋白-配体的复合物,监测蛋白质的折叠。
临床化学家在药物检测和新生儿筛查中也应用MS,取代结果不确定的免疫分析。


第五章液相色谱-质谱分析技术理论与应用第一节液相色谱—串联质谱分析技术的原理一、质谱法质谱法(Mass Spectrometry,MS),即用电场和磁场将运动的离子(带电荷的原子、分子或分子碎片)按它们的质荷比分离后进行检测的方法。
质谱法测量的对象是必须是带电离子。
质谱法的特点:质谱不属波谱范围;谱图与电磁波的波长和分子内某种物理量的改变无关;谱是分子离子及碎片离子的质量与其相对强度的谱,谱图与分子结构有关;质谱法进样量少,灵敏度高,分析速度快;谱是唯一可以给出分子量,确定分子式的方法,而分子式的确定对化合物的结构鉴定是至关重要的。
利用质谱仪可进行同位素分析,化合物分析,气体成分分析以及金属和非金属固体样品的超纯痕量分析。
在有机混合物的分析研究中证明了质谱分析法比化学分析法和光学分析法具有更加卓越的优越性,其中有机化合物质谱分析在质谱学中占最大的比重,全世界几乎有3/4仪器从事有机分析,现在的有机质谱法,不仅可以进行小分子的分析,而且可以直接分析糖,核酸,蛋白质等生物大分子,在生物化学和生物医学上的研究成为当前的热点,生物质谱学的时代已经到来,当代研究有机化合物已经离不开质谱仪。
1、质谱法用于结构分析的流程质谱法是有机分子通过电子轰击,得到分子离子和碎片离子,通过分离、收集和记录得到样品的结构信息。
由分子结构与裂解方式的经验规律,根据分子离子和各种碎片离子的质荷比及其相对丰度,就可以进行结构分析。
具体流程如下:有机分子通过电子轰击,试样中各组分电离生成不同荷质比的离子,经加速电场的作用,形成离子束,进入质量分析器,利用电场和磁场使发生相反的速度色散——离子束中速度较慢的离子通过电场后偏转大,速度快的偏转小;在磁场中离子发生角速度矢量相反的偏转,即速度慢的离子依然偏转大,速度快的偏转小;当两个场的偏转作用彼此补偿时,它们的轨道便相交于一点。
与此同时,在磁场中还能发生质量的分离,这样就使具有同一质荷比而速度不同的离子聚焦在同一点上,不同质荷比的离子聚焦在不同的点上,将它们分别聚焦而得到质谱图,从而确定其质量。



蛋白ms1解
质谱(Mass Spectrometry)中的MS1(Mass Spectrometry 1)解析,这是质谱技术中的一个步骤。
质谱是一种用于测量和分析样品中分子的质量的技术。
在蛋白质质谱中,MS1解析是指对样品中蛋白质分子的质量进行初步测定和记录的阶段。
MS1解析的过程包括以下步骤:
1.离子化:样品中的蛋白质首先被离子化,通常通
过质谱仪中的电离源。
2.加速:离子化的蛋白质带有电荷,然后被加速到
较高的速度。
3.入射:加速的离子进入质谱仪的入射区域。
4.分析:这时,质谱仪会对离子进行分析,测量它
们的质荷比(m/z)。
在MS1解析中,主要关注的
是记录离子的质荷比。
5.记录谱图:质谱仪生成一个质谱图,其中包含了
不同质荷比的峰,每个峰对应一个离子的质量。
MS1解析提供了蛋白质样品中离子质量的总体概况。
在质谱分析的后续步骤中,还可能进行更详细的MS/MS(Tandem Mass Spectrometry)解析,以获得更多关于蛋白质的结构和组成的信息。
请注意,具体的蛋白质质谱分析流程和术语可能会因
实验室、仪器和应用而异。
第五章质谱一、选择题1. 二溴乙烷质谱的分子离子峰M与M+2、M+4的相对强度为(1)1∶1∶1 (2)2∶1∶1 (3)1∶2∶1 (4)1∶1∶22. 在通常的质谱条件下,下列哪个碎片峰不可能出现(1)M+2 (2)M-2 (3)M-8 (4)M-18二、解答及解析题1. 试确定下述已知质何比离子的可能存在的化学式:(1)m/z为71,只含C、H、O三种元素(2)m/z为57,只含C、H、N三种元素(3)m/z为58,只含C、H两种元素2. 试写出苯和环己烯的分子离子式。
3. 写出环己酮和甲基乙烯醚的分子离子式。
4. 写出丙烷分子离子的碎裂过程,生成的碎片是何种正离子,其m/z是多少?5. 试解释溴乙烷质谱图中m/z分别为29、93、95三峰生成的原因?6. 有一化合物其分子离子的m/z为120,其碎片离子的m/z为105,问其亚稳离子的m/z是多少?7. 试解释环己烷质谱图中产生m/z分别为84、69、56、41离子峰的原因?8. 某有机化合物(M=140)其质谱图中有m/z分别为83和57的离子峰,试问下述哪种结构式与上述质谱数据相符合?(1)(2)9. 某有机物可能是乙基正丁基醚或甲基正戊基醚,其质谱图上呈现离子峰的m/z分别为102、87、73、59、31,试确定其为何物?10. 在碘乙烷的质谱图中呈现m/z分别为156、127、29的离子峰,试说明其形成的机理。
11.在丁酸甲酯的质谱图中呈现m/z分别为102、71、59、43、31的离子峰,试说明其碎裂的过程。
12. 某酯(M=116)的质谱图上呈现m/z(丰度)分别为57(100%)、43(27%)和29(57%)的离子峰,试确定其为下述酯中的哪一种。
(1)(CH3)2CHCOOC2H5(2)CH3CH2COOCH2CH2CH3 (3)CH3CH2CH2COOCH312.某化合物(M=138)的质谱图中呈现m/z为120的强离子峰,试判断其为下述两种化合物中的哪一种?(1)(2)14. 某酯(M=150)的质谱图中呈现m/z为118的碎片峰,试判断其为下述两种化合物中的哪一种?(1)(2)15. 已知某取代苯的质谱图如下图所示,试确定下述4种化合物的哪一种结构与谱图数据相一致?(主要考虑m/z分别为119,105和77的离子峰)(1)(2)(3)(4)16、某未知烃类化合物的质谱如下图所示,写出其结构式。
Chpt.2 Mass Spectrometry (part 1)§1.Introduction1.质谱的本质采用物理手段(光、电、磁)将中性分子转换成带有电荷的分子离子及碎片离子,记录其相对丰度所构成的质量图谱。
横轴表示离子质荷比。
由于电荷数通常是1,因此横轴通常表示离子质量。
纵轴表示离子的相对丰度。
通常采用棒条图的形式。
见教材。
2.质谱的作用●测定分子量●推测分子式及其结构式(比较困难)●对采用其他谱学手段推测得到的分子结构进行其断裂模式分析,并与已测得的质谱相比较,从而验证得到的结构式是否合理。
3.质谱的特点高灵敏度、高分辨率、分析速度快、分子结构信息量丰富、需样品量极少。
§2.Instrumentation2.1Magnetic field only正离子z在加速电场V中获得的动能增量=zV,当忽略正离子z在加速电场E之前获得的动能差异时,该正离子z在通过加速电场V后,其动能E=zV,这一动能大小与该离子的质量大小无关。
即:zV=mv2/2质量m的正离子z在磁场B中运动时满足:劳仑兹力Bzv=离心力mv2/R由此推得:v=BzR/m →zV=m(BzR/m)/2∴m/z=B2R2/2V上式表示磁场B对动能相同的入射离子具有质量层析作用。
实际测量时,扫描磁场B,即可使具有不同质荷比m/z的离子依次到达检测器。
注:在不同的文献中,磁场常用B及H表示。
磁场的作用小结:●当入射离子的动能相同时,可实现质量分离。
即按照m/z值的不同,随着扫描电压的变化,依次流出质谱仪,即磁场起质量层析作用。
●当同一m/z值的入射离子的动能不同时,产生能量色散,使被层析出的离子不能完全都通过收集极的窄缝,导致信号混杂。
在第一无场区即将进入质量分析器的离子特征:●各种阳离子都混杂在里面,认为其组成不随时间而变化。
●进入引导直轨道的离子的运动方向间有微小夹角。
●进入引导直轨道的离子的动能并不严格相等,大体上等于zeV。