-内酰胺酶来源分析
- 格式:pdf
- 大小:108.58 KB
- 文档页数:2


产超广谱β-内酰胺酶大肠埃希菌的耐药分析黎新桂;李时照;何艳红【摘要】目的了解本院产超广谱β-内酰胺酶(ESBLs)大肠埃希菌的发生比例及其对临床上常用的20种抗菌药物耐药变化.方法收集2008~2009年本院各类临床标本中分离的大肠埃希菌,用ATB Expression微生物鉴定系统进行鉴定及药敏试验.结果 2008~2009年产ESBLs的大肠埃希菌分离率分别为 45.51%(71/156)、55.93 %(99/177)(P<0.05).2年来ESBLs阳性的大肠埃希菌对临床常用的20种抗菌药物药敏表现出较高耐药性,耐药率上升差异有统计学意义(P<0.05),非产ESBLs 的大肠埃希菌对大多数抗菌药物仍保持较高的敏感率.结论应加强对大肠埃希菌ESBLs的监测,合理使用抗菌药物,对于有效控制产ESBLs大肠埃希菌的播散和流行是一项重要措施.【期刊名称】《检验医学与临床》【年(卷),期】2010(007)017【总页数】3页(P1853-1855)【关键词】大肠埃希菌;超广谱β-内酰胺酶;耐药【作者】黎新桂;李时照;何艳红【作者单位】广西梧州市人民医院检验科,543000【正文语种】中文【中图分类】R446.5大肠埃希菌是临床上常见的产超广谱β-内酰胺酶(ESBLs)耐药菌之一[1],也是医院获得性感染的常见致病菌[2],随着广谱抗菌药物的广泛应用,其耐药性不断变迁,了解大肠埃希菌对临床常用抗菌药物的敏感性对有效治疗大肠埃希菌感染有重要意义。
本研究对本院2008~2009年各类临床标本分离的大肠埃希菌产ESBLs情况及耐药进行测定,并分析2年来对常用抗菌药物的耐药性变化。
1 材料与方法1.1 菌株来源收集2008年1月至2009年12月本院临床所送检的各类标本中所确认的大肠埃希菌。
1.2 细菌鉴定及药敏试验应用法国生物梅里埃公司ATB Expression微生物鉴定系统进行鉴定及药敏试验.参照美国临床实验标准化委员会(CLSI)标准判断药敏结果和ESBLs表型确证实验。

金属类β-内酰胺酶β-内酰胺酶是革兰阴性杆菌对内酰胺类抗生素耐药的主要机制,细菌产生的β-内酰胺酶大部分系活性部位带丝氨酸残基的酶类,也有一小部分是活性部位为金属离子的酶类,称为金属β-内酰胺酶(metallo-β-lactamase,MBL),简称为金属酶。
金属β-内酰胺酶,属Bush分类3群,Ambler分类B类,该群酶最大特点是可以水解碳青霉烯类等抗生素,而对哌拉西林和氨曲南影响较小。
酶活性中心需金属锌离子的参与而发挥催化活性,故称为金属β-内酰胺酶。
底物为包括碳青霉烯类在内的一大类β-内酰胺抗生素,其活性不被常见的β-内酰胺酶酶抑制剂如克拉维酸等所抑制,但可被离子鳌合剂乙二胺四乙酸(EDTA)、菲咯啉或硫基化合物抑制所抑制。
金属β-内酰胺酶可由染色体和质粒介导,可在铜绿假单胞菌、嗜麦芽窄食单胞菌、粘质沙雷菌、肠杆菌属菌、肺炎克雷伯菌、嗜水气单胞菌和不动杆菌、脆弱类杆菌属、等细菌中检出此类酶。
一、发现和分布第一个报道的金属酶是从蜡样芽孢杆菌( Bacill us cereus) 中发现的,该酶为锌依赖酶。
20 世纪80 年代初期日本从嗜麦芽窄食单胞菌中鉴定出第二种锌依赖青霉素酶L1 型酶,随后又从嗜水气单胞菌和脆弱拟杆菌中鉴定出多种能水解亚胺培南的金属酶。
这些酶都由染色体基因编码。
该类金属酶分布在蜡样芽孢杆菌、嗜麦芽窄食单胞菌、脆弱拟杆菌、气单胞菌属和戈氏军团菌中,除嗜麦芽窄食单胞菌外,在临床上都极为罕见,而且都是单株散发的。
1991年日本学者在铜绿假单胞菌中发现了第一种质粒介导的金属酶( IMP21) ,不久又从脆弱拟杆菌中发现了一种可转移金属酶,这两个酶的发现意味着金属酶已经从单株散发向随机分布过渡。
现在已报道了10多种可转移金属酶: IMP21~8 和VIM21~3,分布在铜绿假单胞菌、不动杆菌和肠杆菌科细菌中,地域分布上已经不再局限于日本,现已分布至亚洲、欧洲和美洲的多个国家(见表1)。

.论著.大肠埃希菌产超广谱内酰胺酶的耐药性分析郭琼杰,杨柳,杨晨,王娜,王珊珊[摘要]目的分析大肠埃希菌(Escherichia coli,E.coli)产超广谱B-内酰胺酶(extended spectrum B-lactamases, ESBLs)的耐药性。
方法选取2017年6月〜2019年6月秦皇岛市第一医院收治的非重复大肠埃希菌感染80例患者作为研究对象,分别对其感染标本中的细菌进行检验、分离培养,运用常规鉴定技术鉴定细菌并进行药敏试验,使用纸片扩散法(K-B paper diffusion method,K-B法)检测E.coli,使用K-B法和国家临床实验室标准委员会(national committee for clinical laboratory standards,NCCLS)建议的双纸片协同试验进行ESBLs检测,统计E.coli ESBLs阳性株数并分析其耐药性。
结果非重复大肠埃希菌感染病例80例患者中E.coli ESBLs阳性株23株,占比28.75%,阴性株57例,占比71.25%。
E.coli ESBLs阳性株主要来源于尿液标本,之后依次为穿刺液、痰液、血液及引流液。
对E.coli ESBLs阳性株进行耐药性分析,结果显示亚胺培南的体外活性最好,耐药率最低为0.00%,其次为阿米卡星4.35%、头孢替坦4.35%、厄他培南4.35%、左氧氟沙星4.35%、头孢他啶4.35%、哌拉西林/他唑巴坦4.35%、妥布霉素4.35%;该试验中细菌对复方新诺明的耐药性最高为95.65%,其次为阿莫西林/克拉维酸91.30%、氨节西林91.30%、氨曲南86.96%、头孢曲松86.96%。
结论E.coli ESBLs对复方新诺明、阿莫西林/克拉维酸、氨节西林、氨曲南、头孢曲松有着较强的耐药性,对亚胺培南、阿米卡星、头孢替坦、厄他培南、左氧氟沙星、头孢他啶、哌拉西林/他唑巴坦、妥布霉素等药物较为敏感,临床治疗时应严格根据细菌分布特点结合其耐药情况进行合理给药。


金属类β-内酰胺酶β-内酰胺酶是革兰阴性杆菌对内酰胺类抗生素耐药的主要机制,细菌产生的β-内酰胺酶大部分系活性部位带丝氨酸残基的酶类,也有一小部分是活性部位为金属离子的酶类,称为金属β-内酰胺酶(metallo-β-lactamase,MBL),简称为金属酶。
金属β-内酰胺酶,属Bush分类3群,Ambler分类B类,该群酶最大特点是可以水解碳青霉烯类等抗生素,而对哌拉西林和氨曲南影响较小。
酶活性中心需金属锌离子的参与而发挥催化活性,故称为金属β-内酰胺酶。
底物为包括碳青霉烯类在内的一大类β-内酰胺抗生素,其活性不被常见的β-内酰胺酶酶抑制剂如克拉维酸等所抑制,但可被离子鳌合剂乙二胺四乙酸(EDTA)、菲咯啉或硫基化合物抑制所抑制。
金属β-内酰胺酶可由染色体和质粒介导,可在铜绿假单胞菌、嗜麦芽窄食单胞菌、粘质沙雷菌、肠杆菌属菌、肺炎克雷伯菌、嗜水气单胞菌和不动杆菌、脆弱类杆菌属、等细菌中检出此类酶。
一、发现和分布第一个报道的金属酶是从蜡样芽孢杆菌( Bacill us cereus) 中发现的,该酶为锌依赖酶。
20 世纪80 年代初期日本从嗜麦芽窄食单胞菌中鉴定出第二种锌依赖青霉素酶L1 型酶,随后又从嗜水气单胞菌和脆弱拟杆菌中鉴定出多种能水解亚胺培南的金属酶。
这些酶都由染色体基因编码。
该类金属酶分布在蜡样芽孢杆菌、嗜麦芽窄食单胞菌、脆弱拟杆菌、气单胞菌属和戈氏军团菌中,除嗜麦芽窄食单胞菌外,在临床上都极为罕见,而且都是单株散发的。
1991年日本学者在铜绿假单胞菌中发现了第一种质粒介导的金属酶( IMP21) ,不久又从脆弱拟杆菌中发现了一种可转移金属酶,这两个酶的发现意味着金属酶已经从单株散发向随机分布过渡。
现在已报道了10多种可转移金属酶: IMP21~8 和VIM21~3,分布在铜绿假单胞菌、不动杆菌和肠杆菌科细菌中,地域分布上已经不再局限于日本,现已分布至亚洲、欧洲和美洲的多个国家(见表1)。


β-内酰胺酶的分类
β-内酰胺酶可以分为四类:
1. 类A β-内酰胺酶:这是最常见的β-内酰胺酶,它能够降解广谱青霉素和第一代头孢菌素。
这些酶通常由革兰阴性菌产生。
2. 类B β-内酰胺酶:这些酶也称为金属β-内酰胺酶,因为它们需要金属离子(通常是锌)来发挥催化作用。
这些酶能够降解第二代头孢菌素和碳青霉烯类抗生素。
类B β-内酰胺酶主要由革兰阴性菌产生。
3. 类C β-内酰胺酶:这些酶主要由革兰阳性菌产生,能够降解广谱青霉素和第一代头孢菌素。
类C β-内酰胺酶通常不会降解第二代头孢菌素和第三代头孢菌素。
4. 类D β-内酰胺酶:这些酶由革兰阳性菌产生,能够降解广谱青霉素和第一代头孢菌素。
类D β-内酰胺酶通常不会降解第二代头孢菌素和第三代头孢菌素。

AmpC酶AmpC 酶是AmpCβ内酰胺酶的简称。
是由肠杆菌科细菌或和绿脓假单胞菌的染色体或质粒介导产生的一类β内酰胺酶,属β内酰胺酶Ambler 分子结构分类法中的C 类和Bush Jacoby Medeiros 功能分类法中第一群,即作用于头孢菌素、且不被克拉维酸所抑制的β内酰胺酶。
故AmpC 酶又称作为头孢菌素酶。
AmpC 酶按其产生的方式分为3 类:诱导高产酶、持续高产酶和持续低产酶。
(1) 诱导高产酶:AmpC 酶的合成往往与β2内酰胺类抗生素的存在有关。
绝大部分肠杆菌科细菌和绿脓假单胞菌在正常条件下(即无β内酰胺类抗生素存在的条件下) 只产生少量的AmpC 酶。
而当有诱导作用的β内酰胺类抗生素存在的条件下,AmpC 酶的产量明显增加,增加的范围在100~1 000 倍之间。
(2) 持续高产酶:另有一部分产AmpC 酶的菌株不论在有无β内酰胺类抗生素存在的条件下均可持续高水平产生AmpC 酶,其原因为去阻遏突变,即调控基因之一的ampD 基因发生突变,产生的有缺陷的AmpD 蛋白,不能与另一种调控蛋白—AmpR 蛋白结合形成复合物,AmpR 蛋白即以激活子状态发挥激活作用,引起AmpC酶的大量表达。
质粒介导的AmpC 酶往往都属于此类AmpC 酶。
产生这种AmpC 酶的细菌对临床的危害最大,是临床微生物实验室检测的重点。
(3) 持续低产酶:还有极少部分产AmpC 酶的菌株,不论在有无β内酰胺类抗生素的存在的条件下均持续低水平的产生AmpC 酶,其原因可能是另一种调节基因—ampR 基因发生突变, 产生有缺陷的AmpR 蛋白,不能在无β内酰胺类抗生素存在的条件下起到抑制子的作用,也不能在有β内酰胺类抗生素存在的条件下起到激活子的作用,故AmpC 酶得以持续低水平地表达。
检测不同类型的AmpC 酶或检测产不同类型AmpC 酶的菌株,其方法也有所不同。
近年来,随着β内酰胺类抗生素、尤其是头孢菌素的广泛应用,产AmpC 酶的革兰阴性杆菌越来越多见,尤其是出现了(去阻遏) 持续高产AmpC 酶和质粒介导的AmpC 酶,导致耐药菌株广泛传播和临床对该类细菌感染的治疗困难,已引起临床的高度重视,故检测AmpC 酶具有非常重要的临床意义。
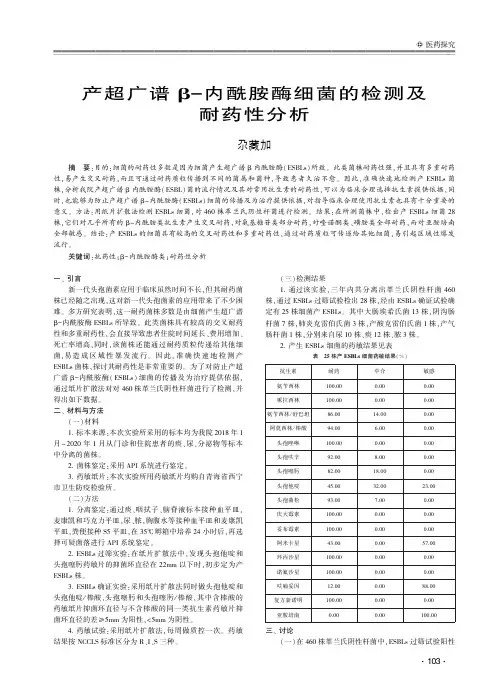
㊀2021,37(1)中国人兽共患病学报C h i n e s e J o u r n a l o f Z o o n o s e sD O I :10.3969/j.i s s n .1002-2694.2020.00.179 实验研究产新德里金属βG内酰胺酶大肠埃希菌耐碳青霉烯类药物相关机制研究和分子分型傅芬蕊1,2,张㊀娅1,3,潘玉红1,4,曹颖平1,4,郑培烝1,4福建省自然科学基金(N o .2016J 01466)通讯作者:郑培烝,E m a i l :z h e n g p e i z h e n g @a l i y u n .c o m ;O R C I D :0000G0002G6342G0745作者单位:1.福建医科大学附属协和医院,福州㊀350001;2.宁德市医院,宁德㊀352000;3.九江学院附属医院,九江㊀332000;4.福建医科大学医学技术与工程学院,福州㊀350004摘㊀要:目的㊀研究某三甲医院临床分离的产新德里金属βG内酰胺酶(N D M )大肠埃希菌的耐药机制和分子流行病学特征.方法㊀在某三甲医院收集的耐碳青霉烯类大肠埃希菌中利用聚合酶链反应(P C R )筛查是否携带N DM 基因,通过测序确定N DM 型别并进一步检测其它碳青霉烯酶相关基因和广谱βG内酰胺酶类耐药基因.通过载体构建和表达研究N D M G1㊁N D M G6及N D M G9对亚胺培南的水解能力.采用多位点序列分型(M L S T )对产N D M 大肠埃希菌进行分子分型.结果㊀共筛选出8株携带N D M 大肠埃希菌,其中2株为N D M G9型,6株为N D M G6型.4株大肠埃希菌同时携带N DM G6㊁T E M 和C T X GM G1基因,1株同时携带N DM G6㊁T E M 和C T X GM G9基因.携带N DM G1㊁N DM G6与N DM G9重组菌对亚胺培南均耐药,最小抑菌浓度(M I C )分别为32μg /m L ㊁128μg /m L 和64μg /m L .产N D M 大肠埃希菌M L S T 分型结果为S T 226㊁S T 648和S T 1284型各1株,S T 101型5株,此5株均来源于神经内科.结论㊀首次发现同时携带N DM G6㊁T E M 和C T X GM G1基因和携带N DM G6㊁T E M 和C T X GM G9基因的大肠埃希菌,N D M G6㊁N D M G9对亚胺培南的耐药性比N D M G1强,应引起重视.M L S T 分型结果提示某三甲医院可能存在耐碳青霉烯类大肠埃希菌的院内局部传播.关键词:大肠埃希菌;耐药;新德里金属βG内酰胺酶;多位点序列分型中图分类号:R 378.2㊀㊀㊀文献标识码:A ㊀㊀㊀文章编号:1002-2694(2021)01-0053-07C a r b a p e n e m Gr e s i s t a n c em e c h a n i s m s a n dm o l e c u l a r t y p i n g of E s c h e r i c h i a c o l i p r o d u c i ng N e wD e lh im e t a l βGl a c t a m a s e F U F e n Gr u i 1,2,Z H A N G Y a 1,3,P A N Y u Gh o n g 1,4,C A O Y i n g Gp i n g 1,4,Z H E N GP e i Gz h e n g1,4(1.F u j i a n M e d i c a lU n i v e r s i t y U n i o n H o s p i t a l ,F u z h o u 350001,C h i n a ;2.N i n g d eM u n i c i p a lH o s p i t a l ,N i n gd e 352000,C h i n a ;3.J i u j i a n g U n i v e r s i t y A f f i l i a t e d H o s p i t a l ,J i u j i a n g 332000,C h i n a ;4.S c h o o l o f M e d i c a lT e c h n o l o g y a n dE n g i n e e r i n g ,F u j i a n M e d i c a lU n i v e r s i t y ,F u z h o u 350004,C h i n a )A b s t r a c t :T h e a i m o f t h i ss t u d y w a s t o i n v e s t i g a t e t h er e s i s t a n c e m e c h a n i s m sa n d m o l e c u l a re p i d e m i o l o gi c a l f e a t u r e so f E s c h e r i c h i ac o l i s t r a i n s p r o d u c i n g N e wD e l h im e t a l βGl a c t a m a s e (N D M )c o l l e c t e d i n a t h i r d c l a s sAh o s p i t a l .N DM g e n e sw e r e s c r e e n e dw i t hP C R i n c a r b a p e n e m Gr e s i s t a n t E s c h e r i c h i a c o l i s t r a i n s .T y p e s o f N DM g e n e sw e r e i d e n t i f i e db y s e q u e n c i n g .O t h e r c a r b a p e n e m Gr e s i s t a n c e r e l a t e d g e n e sa n de x t e n d e d Gs p e c t r u m GβGl a c t a m a s e g e n e sw e r ed e t e c t e db y P C Rf o r N DM g e n e p o s i t i v e s t r a i n s .A n e x p r e s s i o n s y s t e m w a s u s e d t o e v a l u a t e t h e i m i p e n e m Gh y d r o l y s i s a b i l i t y o fN D M G1,N D M G6a n dN D M G9.M o l e c u l a r t y p i n g o f E s c h e r i c h i a c o l i p r o d u c i n g N D M w a s p e r f o r m e dw i t h t h em u l t i l o c u s s e q u e n c e t y p i n g (M L S T )m e t h o d .E i g h t s t r a i n s o f E s c h e r i c h i a c o l i p r o d u c i n g N D M w e r e i d e n t i f i e d ,a m o n g wh i c hs i xw e r eN D M G6s t r a i n s ,a n dt h er e m a i n d e rw e r eN D M G9s t r a i n s .F o u r s t r a i n so f E s c h e r i c h i ac o l i w e r ef o u n dt os i m u l t a n e o u s l y c a r r y N DM G6,T E M a n d C T X GM G1g e n e s ,a n do n e s t r a i nw a s f o u n d t o s i m u l t a n e o u s l y c a r r y N DM G6,T E M a n d C T X GM G9g e n e s .R e c o m b i n a n t E s c h e r i c h i a c o l i s t r a i n s e x p r e s s i n gN DM G1,N DM G6a n d N DM G9g e n e sw e r e r e s i s t a n t t o i m i pe n e m ,w i t h m i n i m u mi n h i b i t o r y c o n c e n t r a t i o n so f32μg /m L ,128μg/m La n d64μg /m L ,r e s p e c t i v e l y.M L S Tr e v e a l e d f o u r d i s t i n c t s e Gq u e n c e t y p e s (S T s ),a m o n g wh i c h f i v e s t r a i n s o f S T 101w e r e c o l Gl e c t e d f r o mt h en e u r o l o g i c a l u n i t ,a n d t h e r e m a i n i n g t h r e e s t r a i n s w e r eS T 226,S T 648a n dS T 1284,r e s p e c t i v e l y .T h i s s t u d y r e po r t s t h e f i r s t i d e n t i f i c a t i o no f E s c h e r i c h i ac o l i s i m u l t a n e o u s l y c a r r y i n g N DM G6,T E M a n d C T X GM G1g e n e s ,o r N DM G6,T E M a n d 35C T XGMG9g e n e s.N o t a b l y,ND MG6w a s a s s o c i a t e dw i t h t h eh i g h e s t i m i p e n e mh y d r o l y s i s a b i l i t y,a n dw a s f o l l o w e db y N D MG9a n dN D MG1.T h eM L S Tr e s u l t s i n d i c a t e d t h a t an o s o c o m i a l i n f e c t i o no f c a r b a p e n e mGr e s i s t a n tE s c h e r i c h i a c o l i o c c u r r e d l o c a l l y i na t h i r d c l a s sAh o s p i t a l.K e y w o r d s:E s c h e r i c h i a c o l i;r e s i s t a n c e;N e w D e l h im e t a l l oGβGl a c t a m a s e;m u l t i l o c u s s e q u e n c e t y p i n gS u p p o r t e db y t h eN a t u r a l S c i e n c eF o u n d a t i o no fF u j i a nP r o v i n c e(N o.2016J01466)C o r r e s p o n d i n g a u t h o r:Z h e n g P e iGz h e n g,E m a i l:z h e n g p e i z h e n g@a l i y u n.c o m㊀㊀大肠埃希菌是引起人类各种感染如泌尿道㊁呼吸道㊁创面伤口的感染以及菌血症常见的病原体之一.近年来,由于抗菌药物使用不规范,大肠埃希菌对抗菌药物的耐药性明显增强,出现耐碳青霉烯类药物的大肠埃希菌.根据全国耐药性监测网2018年的数据,大肠埃希菌对碳青霉烯类药物全国平均耐药率为1.5%.碳青霉烯类药物是目前临床上控制革兰阴性菌感染最有效的抗生素之一,对大肠埃希菌具有强大抗菌活性,一旦出现耐药,将使得感染后的治疗变得十分困难.大肠埃希菌对碳青霉烯类药物最常见的耐药机制是产碳青霉烯酶[1].碳青霉烯酶是指所有能水解碳青霉烯类的βG内酰胺酶,依据A m b l e r分子分类将碳青霉烯酶分为A类碳青霉烯酶㊁B类金属βG内酰胺酶(M e t a l l oGβGl a c t a m a s e,M B L)和D类苯唑西林酶(O x a c i l l i n a s e,O X A).自2009年在印度分离的大肠埃希菌中发现新德里金属βG内酰胺酶1(N e w D e l h im e t a l l oGβGl a c t a m a s eG1,N D MG1)以来,产N D M型酶的大肠埃希菌在世界范围内被广泛报道,而亚洲大陆被认为是主要的流行区域,特别是中国和印度[2],目前已发现20多种型别的N D M.本文收集来自住院患者的耐碳青霉烯类药物大肠埃希菌8株,对其耐药机制和分子分型进行研究,结果报道如下.1㊀材料和方法1.1㊀菌株来源㊀从住院患者临床标本中分离的8株对亚胺培南耐药的大肠埃希菌.1.2㊀仪器与试剂㊀V I T E KG2c o m p a c t全自动微生物分析仪㊁革兰阴性细菌鉴定卡(G N)㊁药敏卡片(A S TGG N16)㊁亚胺培南E t e s t试纸条(法国生物梅里埃公司)㊁P C R扩增仪(美国A p p l i e dB i o s y s t e m s 公司)㊁凝胶成像分析系统(美国B I OGR A D公司)㊁T a q D N A聚合酶(2.5U/μL)㊁d N T P(2.5mm o l/L)㊁D N A纯化回收试剂盒㊁质粒小提试剂盒及T O P10感受态细胞(北京天根生化科技有限公司)㊁p C R2.1载体(25n g/μL)(美国I n v i t r o g e n生命技术公司)㊁MGH琼脂(英国O x o i d公司)㊁引物的合成及P C R产物测序(上海博尚生物技术有限公司).1.3㊀方㊀法1.3.1㊀菌株鉴定与药敏㊀使用V I T E KG2c o m p a c t 全自动微生物分析仪进行菌株鉴定和药敏.采用亚胺培南E t e s t试纸条对亚胺培南耐药性进行验证.药敏结果根据2019年C L S I的抗菌药物敏感性试验标准进行判断.以大肠埃希菌A T C C25922为质控菌株.1.3.2㊀碳青霉烯酶基因检测及测序㊀煮沸法提取细菌D N A模板,采用P C R法扩增常见的A类碳青霉烯酶基因(K P C㊁G E S㊁S M E㊁I M I/NM C)㊁B类金属酶基因(N DMGl i k e㊁I MPGl i k e㊁V I MGl i k e㊁S I MG1㊁G I MG1和S P M)㊁D类苯唑西林酶基因(O X AG23Gl i k e㊁O X AG24Gl i k e㊁O X AG58Gl i k e和O X AG143Gl i k e)和广谱βG内酰胺酶类耐药基因(S HV㊁T E M㊁C T XGMG1群㊁C T XGMG2群㊁C T XGMG8群㊁C T XGMG9群和C T XGMG25群).P C R的扩增体系均为25μL:上下游引物各0.5μL(10μmm o l/L),1μL模版D N A,2.5μL10ˑT a q B u f fGe r,2μLd N T P,0.5μLT a q聚合酶(2.5U/μL),用灭菌水补足至25μL.反应参数为:94ħ预变性5m i n;94ħ30s,55ħ30s,72ħ1m i n,循环30次;72ħ延伸10m i n.扩增产物用1%琼脂糖凝胶进行电泳,凝胶成像分析系统进行结果观察.电泳阳性产物送测序公司纯化并双向测序,所得测序结果使用B L A S T与G e n B a n k中的序列进行比对. N DMGl i k e基因阳性的标本再用N DMGf u l l引物扩增N DM型基因全长,经测序确定具体的N DM基因型别.引物名称㊁引物序列及预计产物长度见表1.45中国人兽共患病学报2021,37(1)表1㊀扩增耐药基因相关引物信息T a b .1㊀P r i m e r i n f o r m a t i o n f o r r e s i s t a n c e g e n e a m pl i f i c a t i o n 引物名称引物序列(5ᶄG3ᶄ)扩增产物长度/b p参考文献K P C 上游:C G G T G T G T A C G C G A T G G A T A 574本文下游:T C C G G T T T T G T C T C C G A C T G G E S 上游:C G G T T T C T A G C A T C G G G A C A 321本文下游:C G T T T G G T T T C C G A T C A G C C S M E 上游:A T A G C G A C A A T G G G G C A A C A 300本文下游:C A G C A G G A A C A C T A G C A C G AI M I /NM C上游:A T C G G T G G T C C T G A G G G T A T 301本文下游:C G T A T G C T C C G C A A C T A C C AO X A G23Gl i k e 上游:G A T C G G A T T G G A G A A C C A G A 501[3]下游:A T T T C T G A C C G C A T T T C C A T O X A G24Gl i k e 上游:G G T T A G T T G G C C C C C T T A A A246[3]下游:A G T T G A G C G A A A A G G G G A T T O X A G51Gl i k e 上游:T A A T G C T T T G A T C G G C C T T G 353[4]下游:T G G A T T G C A C T T C A T C T T G G O X A G58Gl i k e 上游:A A G T A T T G G G G C T T G T G C T G 599[3]下游:C C C C T C T G C G C T C T A C A T A CO X A G143Gl i k e 上游:T G G C A C T T T C A G C A G T T C C T149[5]下游:T A A T C T T G A G G G G G C C A A C CI M P Gl i k e 上游:G A A T A G (A /G )(A /G )T G G C T T A A (C /T )T C T C 188[6]下游:C C A A A C (C /T )A C T A (G /C )G T T A T C V I M Gl i k e 上游:G T T T G G T C G C A T A T C G C A A C 382[6]下游:A A T G C G C A G C A C C A G G A T A G S I M G1上游:G T A C A A G G G A T T C G G C A T C G 569[6]下游:T G G C C T G T T C C C A T G T G A GG I M G1上游:T C A A T T A G C T C T T G G G C T G A C 72[6]下游:C G G A A C G A C C A T T T G A A T G G S P M 上游:C T A A A T C G A G A G C C C T G C T T G 798[6]下游:C C T T T T C C G C G A C C T T G A T C N DM Gl i k e 上游:T C C T C A A C T G G A T C A A G C A G G 249本文下游:A A A A T A C C T T G A G C G G G C C A N DM Gf u l l 上游:A T G G A A T T G C C C A A T A T T A T G C A C 813[7]下游:T C A G C G C A G C T T G T C G G CP r e GN DM Gf u l l 上游:C A C C T C A T G T T T G A A T T C G C C 984[8]下游:C T C T G T C A C A T C G A A A T C G C S H V 上游:A G G A T T G A C T G C C T T T T T G 393[9]下游:A T T T G C T G A T T T C G C T C GT E M 上游:A T G A G T A T T C A A C A T T T C C G858[10]下游:C C A A T G C T T A A T C A G T G A G G C T X GM G1群上游:G G T T T A A A A A A T C A C T G C G T C833[11]下游:T T G G T G A C G A T T T T A G C C G C551期傅芬蕊,等:产新德里金属βG内酰胺酶大肠埃希菌耐碳青霉烯类药物相关机制研究和分子分型表1(续)引物名称引物序列(5ᶄG3ᶄ)扩增产物长度/b p参考文献C T X GM G2群上游:A T G A T G A C T C A G A G C A T T C G 865[12]下游:T G G G T T A C G A T T T T C G C C G C C T X GM G8群上游:A T G A T A G A G A C A T C G C G T T A A G 860[13]下游:C G G T G A C G A T T T T C G C G G C A G C T X GM G9群上游:A T G G T G A C A A A G A G A G T G C A 863[12]下游:C C C T T C G G C G A T G A T T C T C C T X GM G25群上游:C A C A C G A A T T G A A T G T T C A G923[14]下游:T C A C T C C A C A T G G T G A G T 1.3.3㊀N D M G1㊁N D M G6与N D M G9酶水解亚胺培南能力的比较㊀实验分为8组,见表2.分别扩增含与不含启动子序列的N DM G1㊁N DM G6及N DM G9型基因全长(携带N DM G1型基因的菌株来源于本实验室保存的菌株),引物分别为P r e GN DM Gfu l l 与N DM Gf u l l ,引物序列见表1,反应体系及条件同上.按D N A 纯化回收试剂盒方法对上述基因全长进行纯化,根据p C R2.1载体试剂说明书进行转化.根据抗性筛选与蓝白筛选挑选转化成功的重组T O P 10感受态细胞,进行P C R 检测耐药基因,测序证实转化是否成功和N D M 型别是否正确,琼脂稀释法测亚胺培南M I C 值.表2㊀N D M G1㊁N D M G6及N D M G9水解亚胺培南能力试验分组情况T a b .2㊀G r o u p e d e v a l u a t i o no f t h e i m i p e n e m Gh y d r o l ys i s a b i l i t y o fN D M G1,N D M G6a n dN D M G9菌株解释㊀T O P 10T O P 10感受态细胞T O P 10+p C R2.1含空载体的重组菌T O P 10+p C R2.1+N DM G1含N DM G1全长基因的重组菌T O P 10+p C R2.1+N DM G6含N DM G6全长基因的重组菌T O P 10+p C R2.1+N DM G9含N DM G9全长基因的重组菌T O P 10+p C R 2.1+P r e GN DM G1含启动子和N DM G1全长基因的重组菌T O P 10+p C R 2.1+P r e GN DM G6含启动子和N DM G6全长基因的重组菌T O P 10+p C R 2.1+P r e GN DM G9含启动子和N DM G9全长基因的重组菌1.3.4㊀多位点序列分型(M L S T )㊀对携带有N DM 基因的8株大肠埃希菌进行分型,P C R 扩增7个管家基因,即a d k ㊁f u m C ㊁g y r B ㊁i c d ㊁m d h ㊁pu r A 和r e c A ,所用引物序列及预计产物长度参考网站(h t Gt ps ://e n t e r o b a s e .r e a d t h e d o c s .i o /e n /l a t e s t /m l s t /m l s t Gl e g a c yGi n f o Ge c o l i .h t m l ).P C R 的扩增体系及扩增参数同上.扩增的P C R 产物的测序结果提交到p u b M L S T 数据库进行在线序列比对获得序列型.2㊀结㊀果2.1㊀菌株鉴定与表型筛查结果㊀本次收集的8株大肠埃希菌,经鉴定均为对亚胺培南不敏感的大肠埃希菌.经亚胺培南E t e s t 试纸法验证所有菌株均对亚胺培南不敏感.见表3.2.2㊀碳青霉烯酶基因筛查与测序结果㊀8株对亚胺培南不敏感大肠埃希菌所测A 类和D 类碳青霉烯酶基因均为阴性,B 类碳青霉烯酶基因中除N DM Gl i k e 基因为阳性外,其余均为阴性;广谱βG内酰胺酶基因中7株T E M 基因阳性,4株C T X GM G1基因阳性,1株C T X GM G9基因阳性,具体见表3.扩增8株N DM 基因全长,电泳结果与预计条带大小(813b p )相近,如图1所示.将P C R 产物进行双向测序,序列经比对分析,6株为携带N DM G6基因,2株为携带N DM G9基因,见表3.2.3㊀N D M G1㊁N D M G6和N D M G9水解亚胺培南能力结果㊀以T O P 10感受态细胞和含有空载体的重组菌作为阴性对照,仅含有N DM G1Gfu l l 基因㊁N DM G6Gf u l l 基因和N DM G9Gf u l l 基因的重组菌,因不含启动子,N DM 型基因无法表达,故表现为对亚胺培南敏感,与阴性对照组结果相同,M I C 值均为0.25μg /m L .而含有P r e GN DM G1Gfu l l 基因㊁65中国人兽共患病学报2021,37(1)表3㊀8株产新德里金属βG内酰胺酶大肠杆菌临床相关信息㊁耐药基因检测及分子分型结果T a b .3㊀R e l a t e d c l i n i c a l i n f o r m a t i o n ,r e s i s t a n c e g e n e d e t e c t i o na n dm o l e c u l a r t y p i n g o f e i gh t s t r a i n s o f E s c h e r i c h i a c o l i p r o d u c i n g N e wD e l h im e t a l βGl a c t a m a s e 科室年龄(岁)标本类型亚胺培南E t e s t 试纸法碳青霉烯酶基因广谱βG内酰胺酶基因M L S T分型结果康复科53中段尿>32(R )N DM G6T E M S T 101神经内科86中段尿8(R )N DM G6T E M ,C T X GM G1S T 101神经内科81中段尿4(R )N DM G6T E M ,C T X GM G1S T 101神经内科84中段尿>32(R )N DM G6T E M ,C T X GM G1S T 101神经内科67中段尿>32(R )N DM G6T E M ,C T X GM G1S T 101血液科60分泌物3(I )N DM G6T E M ,C T X GM G9S T 648呼吸内科64痰2(I)N DM G9-S T 1284小儿外科17分泌物12(R )N DM G9T E MS T 2261G8分别为8株待检菌株;M 为D N A m a r k e r;阴性为阴性对照图1㊀N D M 基因扩增产物电泳图F i g .1㊀E l e c t r o ph o r e s i s o fP C R p r o d u c t s o f t h e N D M g e n e P r e GN DM G6Gf u l l 基因及P r e GN DM G9Gf u l l 型基因的重组菌对亚胺培南均耐药,对亚胺培南的M I C 值分别为32μg /m L ㊁128μg /m L 和64μg/m L .2.4㊀M L S T 结果㊀对该8株耐药大肠埃希菌进行分子分型,S T 101型有5株㊁S T 226㊁S T 648和S T 1284型各1株.见表3.3㊀讨㊀论自2009年首次发现产N D M G1酶的菌株以来,产N D M 型酶的菌株迅速向其他国家播散,在世界各地均有发现并报道.我国及世界上流行的分离菌中检出率较高的N D M 型酶基因主要为N DM G1和N DM G5[15].本次实验在8株大肠埃希菌中均检测出N DM 基因,其中6株携带N DM G6基因,2株携带N DM G9基因.而N DM G6基因在2012年第一次从新西兰病人携带的大肠杆菌中鉴定出来以来[16],国内外关于N DM G6基因报道均较少见.N DM G9基因是我国学者2014年在肺炎克雷伯菌中首次报道发现[17],目前已在韩国㊁我国大陆及台湾地区等地均发现了携带N DM G9基因的大肠杆菌㊁肺炎克雷伯菌等细菌[18].为了进一步分析菌株耐药基因的携带情况,还筛查8株耐药菌的广谱βG内酰胺酶基因,发现大肠埃希菌中存在多种耐药基因共存现象,几乎所有的耐药菌株均携带有T E M 基因,4株耐药菌同时携带有N DM G6㊁T E M 和C T X GM G1基因,1株同时携带N DM G6㊁T E M 和C T X GM G9基因,目前国内外均未见此类报道.本文结果显示N D M G1㊁N D M G6和N D M G9水解亚胺培南能力从强到弱依次为N D M G6㊁N D M G9和N D M G1,文献中未见同时比较以上3种型别N D M 水解亚胺培南能力的报道.对于N DM 型基因,目前已发现了20多个型别,而它们之间大多只有几个碱基的不同.N DM G6基因㊁N DM G9基因与N DM G1基因的区别是分别在基因698位置(CңT )和454位置(GңA )上存在有一个碱基的改变,从而导致氨基酸分别由丙氨酸转变为缬氨酸㊁谷氨酸转变为赖氨酸.氨基酸的改变会影响N D M 蛋白的二级结构,可能改变N D M 蛋白的空间结构,从而改变N D M 与底物即碳青霉烯类药物的结合特性,表现出不同的水解能力.不同类型的N D M 水解碳青霉烯类药物的具体机制有待进一步研究.本次研究还采用M L S T 法对8株耐药大肠埃希菌进行分型,结果为:5株携带N DM G6基因大肠埃希菌为S T 101型,1株携带N DM G6基因大肠埃751期傅芬蕊,等:产新德里金属βG内酰胺酶大肠埃希菌耐碳青霉烯类药物相关机制研究和分子分型希菌为S T648型,有2株携带N DMG9基因大肠埃希菌分别为S T226型和S T1284型.在2012年首次报道产N DMG6基因的大肠埃希菌,其分型结果也为S T101型,而在国外报道,产N DM型基因的大肠埃希菌中,也有发现其M L S T分型结果为S T101型[19],提示大肠埃希菌S T101型与N D M型碳青霉烯酶基因关系密切.S T648型大肠埃希菌常在产超广谱βG内酰胺酶的大肠埃希菌中发现[20],在英国㊁日本分别首次报道产N DMG5和N DMG7基因的大肠埃希菌,其分型结果均为S T648型[21],国内学者也有在S T648型大肠埃希菌中发现N DMG5基因,但并未检测出携带有N DMG6基因,国际上也并未发现携带有N DMG6基因的S T648型.产N DM基因的S T1284型大肠埃希菌在国内外鲜有报道发现,第一次在S T1284型大肠埃希菌中检出N DMG5基因是在2015年,而后虽有再次检出N DMG5基因,但到目前为止未检出携带有包括N DMG9基因在内其它N DM型基因.国内外均未在S T226型大肠埃希菌中发现N DM型基因.本次分离的8株耐药大肠埃希菌有5株M L S T 分型结果一致,均为S T101型,且均检出N DMG6基因.其中4株来自神经内科患者,1株来自康复科患者.通过查阅临床相关资料发现,这位康复科患者是在神经内科治疗一段时间后转入康复科的,且与2号患者曾在同一个病房治疗.2号患者长期卧床治疗,在其住院期间,3号㊁4号和5号患者也在神经内科治疗,而且3号和4号患者前后入住同一张病床.以上患者多为免疫力低下㊁有留置导尿管史和长期卧床的老年人.综合以上因素提示这些病人极有可能是在医院内发生了交叉感染.对此,临床上应尽量缩短留置导尿管的时间㊁合理使用抗菌药物㊁规范医护人员的操作和加强对各种医疗器械的消毒措施,同时应重视并加强院感监控力度,避免耐药菌株的传播和医院内感染的发生.利益冲突:无引用本文格式:傅芬蕊,张娅,潘玉红,等.产新德里金属βG内酰胺酶大肠埃希菌耐碳青霉烯类药物相关机制研究和分子分型[J].中国人兽共患病学报,2021,37(1):53G59.D O I:10.3969/j.i s s n.1002G2694.2020.00.179参考文献:[1]T a nK,N g u y e n J,N g u y e nK,e t a l.P r e v a l e n c e o f t h e c a r b a p e nGe mGh e t e r o r e s i s t a n t p h e n o t y p e a m o n g E S B LGp r o d u c i n g E s c h eGr i c h i a c o l i a n dK l e b s i e l l a p n e u m o n i a e c l i n i c a l i s o l a t e s[J].JA n t iGm i c r o bC h e m o t h e r,2020,75(6):1506G1512.D O I:10.1093/j a c/ d k a a048[2]L i J,Y uT,T a oX Y,e t a l.E m e r g e n c e o f a nN D MG5Gp r o d u c i n g E s c h e r i c h i a c o l i s e q u e n c e t y p e410c l o n e i n i n f a n t s i n a c h i l d r e n s h o s p i t a l i n C h i n a[J].I n f e c t D r u g R e s i s t,2020,13:703G710.D O I:10.2147/I D R.S244874[3]W o o d f o r dN,E l l i n g t o n M J,C o e l h oJ M,e t a l.M u l t i p l e xP C R f o r g e n e se n c o d i n gp r e v a l e n tO X Ac a r b a p e n e m a s e s i n A c i n e t oGb a c t e r s p p[J].I n t JA n t i m i c r o bA g e n t s,2006,27(4):351G353.D O I:10.1016/j.i j a n t i m i c a g.2006.01.004[4]B r o w nS,Y o u n g H K,A m y e s S G.C h a r a c t e r i s a t i o n o fO X AG51, an o v e lc l a s s D c a r b a p e n e m a s ef o u n di n g e n e t i c a l l y u n r e l a t e d c l i n i c a l s t r a i n so f A c i n e t o b a c t e rb a u m a n n i i f r o m A r g e n t i n a[J].C l i n M i c r o b i o l I n f e c t,2005,11(1):15G23.D O I:10.1111/j.1469G0691.2004.01016.x[5]H i g g i n sP G,L e h m a n n M,S e i f e r t H.I n c l u s i o no f O X AG143p r i m e r si na m u l t i p l e x p o l y m e r a s ec h a i nr e a c t i o n(P C R)f o r g e n e s e n c o d i n gp r e v a l e n tO X Ac a r b a p e n e m a s e s i n A c i n e t o b a c t e r s p p[J].I n tJA n t i m i c r o b A g e n t s,2010,35(3):305.D O I:10.1016/j.i j a n t i m i c a g.2009.10.014[6]M e n d e sR E,K i y o t aK A,M o n t e i r o J,e t a l.R a p i dd e t e c t i o n a n d i d e n t i f i c a t i o no fm e t a l l oGb e t aGl a c t a m a s eGe n c o d i n g g e n e s b y m u l t iGp l e x r e a lGt i m eP C Ra s s a y a n dm e l t c u r v e a n a l y s i s[J].JC l i n M iGc r o b i o l,2007,45(2):544G547.D O I:10.1128/J C M.01728G06[7]H o r n s e y M,P h e eL,W a r e h a m D W.An o v e l v a r i a n t,N D MG5, o ft h e N e w D e l h im e t a l l oGβGl a c t a m a s ei na m u l t i d r u gGr e s i s t a n t E s c h e r i c h i a c o l i S T648i s o l a t e r e c o v e r e d f r o ma p a t i e n t i n t h eUGn i t e dK i n g d o m[J].A n t i m i c r o b A g e n t s C h e m o t h e r,2011,55(12):5952G5954.D O I:10.1128/A A C.05108G11[8]K a a s eM,N o r d m a n nP,W i c h e l h a u sT A,e t a l.N D MG2c a r b a pGe n e m a s e i n A c i n e t o b a c t e r b a u m a n n i i f r o m E g y p t[J].JA n t i m iGc r o bC h e m o t h e r,2011,66(6):1260G1262.D O I:10.1093/j a c/d k r135[9]B h a t t a c h a r j e eA,S e n M R,P r a k a s hP,e t a l.R o l e o f b e t aGl a c t aGm a s e i n h i b i t o r s i ne n t e r o b a c t e r i a l i s o l a t e s p r o d u c i n g e x t e n d e dGs p e c t r u mb e t aGl a c t a m a s e s[J].JA n t i m i c r o bC h e m o t h e r,2008,61(2):309G314.D O I:10.1093/j a c/d k m494[10]T o n k iM,M o h a rB,Šišk oGK r a l j e v iK,e t a l.H i g h p r e v a l e n c e a n d m o l e c u l a rc h a r a c t e r i z a t i o n o fe x t e n d e dGs p e c t r u mβGl a c t aGm a s eGp r o d u c i n g P r o t e u s m i r a b i l i s s t r a i n s i ns o u t h e r nC r o a t i a [J].J M e d M i c r o b i o l,2010,59(P t10):1185G1190.D O I:10.1099/j mm.0.016964G0[11]P a r kY J,L e eS,K i m Y R,e t a l.O c c u r r e n c e o f e x t e n d e dGs p e cGt r u m(b e t a)Gl a c t a m a s e sa n d p l a s m i dGm e d i a t e d A m p C(b e t a)Gl a c t a m a s e s a m o n g K o r e a ni s o l a t e so f P r o t e u s m i r a b i l i s[J].JA n t i m i c r o bC h e m o t h e r,2006,57(1):156G158.D O I:10.1093/ j a c/d k i408[12]G a r r e cH,D r i e u xGR o u z e t L,G o l m a r d J L,e t a l.C o m p a r i s o n o f n i n e p h e n o t y p i c m e t h o d sf o rd e t e c t i o n o fe x t e n d e dGs p e c t r u mb e t aGl ac t a m a s e p r od u c t i o nb y E n te r o b a c t e r i a c e a e[J].JC l i nM iGc r o b i o l,2011,49(3):1048G1057.D O I:10.1128/J C M.02130G10[13]N a v o nGV e n e z i a S,C h m e l n i t s k y I,L e a v i t tA,e t a l.D i s s e m i n aGt i o no f t h e C T XGMG25f a m i l y b e t aGl a c t a m a s e s a m o n g K l e b s i e l l a85中国人兽共患病学报2021,37(1)p n e u m o n i a e,E s c h e r i c h i a c o l i a n d E n t e r o b a c t e rc l o a c a e a n d iGd e n t i f i c a t i o no f t h en o v e l e n z y m eC T XGMG41i n P r o t e u sm i r aGb i l i s i n I s r a e l[J].JA n t i m i c r o bC h e m o t h e r,2008,62(2):289G295.D O I:10.1093/j a c/d k n182[14]G o r e nM G,N a v o nGV e n e z i a S,C h m e l n i t s k y I,e t a l.C a r b a p e nGe mGr e s i s t a n tK P CG2Gp r o d u c i n g E s c h e r i c h i ac o l i i na T e lA v i vM e d i c a lC e n t e r,2005t o2008[J].A n t i m i c r o b A g e n t s C h eGm o t h e r,2010,54(6):2687G2691.D O I:10.1128/A A C.01359G09[15]Z o u H,J i aX,L i u H,e t a l.E m e r g e n c eo fN D MG5Gp r o d u c i n g E s c h e r i c h i ac o l i i nat e a c h i n g h o s p i t a l i nC h o n g q i n g,C h i n a: I n c FGt y p e p l a s m i d s m a y c o n t r i b u t e t o t h e p r e v a l e n c e o f b l a N D MG5[J].F r o n tM i c r o b i o l,2020,11:334.D O I:10.3389/ f m i c b.2020.00334[16]W i l l i a m s o nD A,S i d j a b a tH E,F r e e m a nJ T,e ta l.I d e n t i f i c aGt i o na n dm o l e c u l a r c h a r a c t e r i s a t i o no fN e wD e l h im e t a l l oGβGl a cGt a m a s eG1(N D MG1)Ga n d N D MG6Gp r o d u c i n g E n t e r o b a c t e r i a c e a e f r o m N e w Z e a l a n d h o s p i t a l s[J].I n tJ A n t i m i c r o b A g e n t s,2012,39(6):529G533.D O I:10.1016/j.i j a n t i m i c a g.2012.02.017[17]W a n g X,L iH,Z h a oC,e t a l.N o v e lN D MG9m e t a l l oGβGl a c t aGm a s e i d e n t i f i e d f r o maS T107K l e b s i e l l a p n e u m o n i a e s t r a i n iGs o l a t e d i nC h i n a[J].I n t JA n t i m i c r o bA g e n t s,2014,44:90G91.D O I:10.1016/j.i j a n t i m i c a g.2014.04.010[18]L i nY C,K u r o d a M,S u z u k i S,e t a l.E m e r g e n c eo f a n E s c h eGr i c h i a c o l i s t r a i n c oGh a r b o u r i n g m c rG1a n db l a N D MG9f r o ma uGr i n a r y t r a c t i n f e c t i o n i nT a i w a n[J].JG l o bA n t i m i c r o bR e s i s t,2019,16:286G290.D O I:10.1016/j.j g a r.2018.10.003[19]Q a m a rMU,W a l s hT R,T o l e m a nMA,e t a l.D i s s e m i n a t i o n o f g e n e t i c a l l y d i v e r s e N D MG1,G5,G7p r o d u c i n gGG r a mGn e g a t i v e p a t h o g e n s i s o l a t e d f r o m p e d i a t r i c p a t i e n t s i nP a k i s t a n[J].F uGt u r eM i c r o b i o l,2019,14(1):691G704.D O I:10.2217/f m bG2019G0012[20]P e i r a n oG,P i t o u t J D D.E x t e n d e dGS p e c t r u mβGL a c t a m a s eGP r oGd u c i n g E n t e r o b a c t e r i a c e a e:u p d a t eo n m o l e c u l a re p i d e m i o l o g y a n dt r e a t m e n to p t i o n s[J].D r u g s,2019,79(14):1529G1541.D O I:10.1007/s40265G019G01180G3[21]M i z u n oY,Y a m a g u c h iT,M a t s u m o t oT.Af i r s t c a s eo fN e wD e l h im e t a l l oGβGl a c t a m a s eG7i na nE s c h e r i c h i ac o l i S T648i s oGl a t e i nJ a p a n[J].J I n f e c tC h e m o t h e r,2014,20(12):814G816.D O I:10.1016/j.j i a c.2014.08.009收稿日期:2020G05G22㊀编辑:张智芳(上接第52页)[29]S c h e y K L,W a n g Z,W e n k e J L,e t a l.A q u a p o r i n s i n t h e e y e: e x p r e s s i o n,f u n c t i o n,a n dr o l e s i no c u l a rd i s e a s e[J].B i o c h i mB i o p h y sA c t a,2014,1840(5):1513G1523.D O I:10.1016/j.b b a g e n.2013.10.037[30]H i b u s eT,M a e d aN,N a g a s a w aA,e t a l.A q u a p o r i n s a n d g l y cGe r o lm e t a b o l i s m[J].B i o c h i m B i o p h y sA c t a,2006,1758(8):1004G1011.D O I:10.1016/j.b b a m e m.2006.01.008[31]A l v a r a d oM E,R u b i a n oC,Sán c h e zW,e t a l.C a l c i u mGb i n d i n g p r o t e i n s t h a t a r e t y p e Bᵡr e g u l a t o r y s u b u n i t s o f p h o s p h a t a s e2A i n G i a r d i ai n t e s t i n a l i s[J].P a r a s i t o lR e s,2018,117(10):3205G3214.D O I:10.1007/s00436G018G6019Gz[32]P r a s a dR,A t u l,S o n iA,e t a l.E x p r e s s i o n,c h a r a c t e r i z a t i o n, a n dc e l l u l a r l o c a l i z a t i o n o f k n o w p a i n s,p a p a i nGl i k e c y s t e i n e p r oGt e a s e s o f t h e P l a s m o d i u mk n o w l e s i m a l a r i a p a r a s i t e[J].P L o S O n e,2012,7(12):e51619.D O I:10.1371/j o u r n a l.p o n e.0051619[33]张佳凤,郝文波,肖斌,等.抗弓形虫水通道蛋白多肽抗体的制备及鉴定[J].中国人兽共患病学报,2015,31(10):903G907.D O I:10.3969/j.i s s n.1002G2694.2015.10.002[34]钟亮尹,刘思敏,曾智华,等.弓形虫C D P K5基因多克隆抗血清的制备及功能鉴定[J].重庆医学,2016,45(16):2182G2185.D O I:10.3969/j.i s s n.1671G8348.2016.16.008[35]冯宪敏,张宏梅,李瑶,等.蓝氏贾第鞭毛虫P P D K多肽抗体制备与定位研究[J].中国病原生物学杂志,2015,10(2):144G147.D O I:10.13350/j.c j p b.150210[36]肖斌,陈瑜,李林海,等.兔抗弓形虫C o r A家族M g2+转运蛋白多肽抗体的制备及鉴定[J].生物技术通讯,2016,27(6):778G782.D O I:10.3969/j.i s s n.1009G0002.2016.06.006[37]C a o i l i S E.B e n c h m a r k i n g BGc e l l e p i t o p e p r e d i c t i o nw i t h q u a n t iGt a t i v ed o s eGr e s p o n s ed a t ao na n t i p e p t i d ea n t i b o d i e s:t o w a r d s n o v e l p h a r m a c e u t i c a l p r o d u c td e v e l o p m e n t[J].B i o m e d R e s I n t,2014,2014:867905.D O I:10.1155/2014/867905[38]W a n g F,Y eB.B i o i n f o r m a t i c sa n a l y s i sa n dc o n s t r u c t i o no f p h y l o g e n e t i c t r e e o fA q u a p o r i n s f r o m E c h i n o c o c c u s g r a n u l o s u s [J].P a r a s i t o lR e s,2016,115(9):3499G3511.D O I:10.1007/ s00436G016G5114G2收稿日期:2020G04G24㊀编辑:张智芳951期傅芬蕊,等:产新德里金属βG内酰胺酶大肠埃希菌耐碳青霉烯类药物相关机制研究和分子分型。
β-内酰胺酶研究进展摘要:青霉素于40年代初首次用于临床,几年后就从链球菌中分离到了青霉素酶,以后随着β-内酰胺类抗生素的不断开发和广泛应用,特别是近几十年来超广谱新品种的大量应用,β-内酰胺酶的种类、底物谱和耐药程度均以惊人的速度在发展,不能不引起格外的重视。
关键词:细菌,β-内酰胺酶,耐药任何生物都试图适应周围环境并生存下去,细菌个体小,易变异,拥有耐药能力,这是自然界的法则。
科学界有一种理论叫“中性突变漂变学说”,以“中性突变”为基础的分子进化学已逐渐形成。
这个学说认为,在分子水平上看,大部分基因突变对于生命体的生存既不产生有利效应,也不酿成不利后果,因此,这类突变在自然选择中是“中性”的。
在亿万年中,生物体内的基因不断产生中性突变,他们不受自然选择的支配,而是通过随机的偶然过程(即遗传漂变)在群体中固定下来或是被淘汰,结果就造成了基因和蛋白质分子的多样性,实现了分子的进化。
在药物选择性压力下,产β-内酰胺酶的细菌被筛选出来,得以泛滥。
为了对β-内酰胺酶有一个教深入了解,现将β-内酰胺酶的研究综述如下。
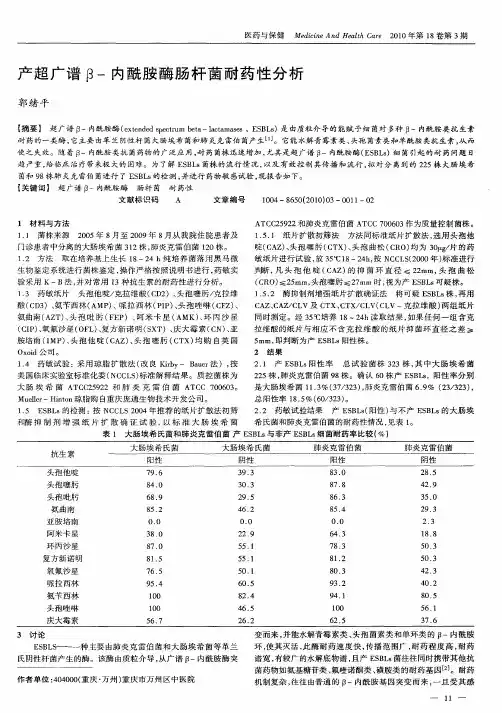
1 β-内酰胺类药物作用机理肽聚糖合成的最后一步是被称为青霉素结合蛋白(penicillin binding proteins,即PBPs)的转肽酶形成的。
β内酰胺类抗生素与D-丙氨酰-D-丙氨酸结构上的相似使得它们与青霉素结合蛋白结合(图一)。
β-内酰胺核不可逆地与青霉素结合蛋白的Ser403单元结合,使其失活,从而抑制细菌细胞壁的形成。
此外这个结合可能还激活细胞壁中的自溶酶。
图1 青霉素与青霉素结合蛋白结合使酶失活2 β-内酰胺酶起源β-内酰胺酶是指能催化水解6-氨基青霉烷酸(6-APA)和7-氨基头孢烷酸(7-ACA)及其N-酰基衍生物分子中β-内酰胺环酰胺键的灭活酶。
β-内酰胺酶来源于细菌细胞壁合成酶(即PBPs),是由于细菌合成PBPs的过程中的基因的变异而造成的(图2)。
β-内酰胺类药物在这类酶的作用下,使β-内酰胺环水解开环,而β-内酰胺环是与PBPs结合的活性功能部位,因此β-内酰胺环的破坏使其失去了干扰细菌细胞壁合成的功能。
谈关于流感嗜血杆菌的分离培养实验分析发表时间:2008-11-05T10:37:42.607Z 来源:《中小企业管理与科技》供稿作者:王连厚[导读] 摘要:目的:探讨耐氨苄西林的流感嗜血杆菌产生β-内酰胺酶的机制。
方法:对临床分离的112株流感嗜血杆菌耐药菌用纸片法作β-内酰胺酶测定,用PCR法检测产酶流感嗜血杆菌中的β-内酰胺酶基因的存在。
摘要:目的:探讨耐氨苄西林的流感嗜血杆菌产生β-内酰胺酶的机制。
方法:对临床分离的112株流感嗜血杆菌耐药菌用纸片法作β-内酰胺酶测定,用PCR法检测产酶流感嗜血杆菌中的β-内酰胺酶基因的存在。
结果:纸片法测得产酶菌株32株,产酶率28.6%(32/112);32株产酶菌中PCR法测β-内酰胺酶基因阳性菌株29株,阳性率为90.6%(29/32),其中质粒DNA模板组阳性为25株,基因组DNA模板组阳性为4例。
结论:(1)流感嗜血杆菌耐氨苄西林主要由质粒介导产生β-内酰胺酶所造成。
(2)PCR法是研究流感嗜血杆菌是否携带β-内酰胺酶基因及该基因所在位置的简便而有效的方法。
本实验室成功提高流感嗜血杆菌分离率的基础上,分离获得36株耐氨苄西林的流感嗜血杆菌,用纸片法测定它们产β-内酰胺酶的情况后,用PCR方法对产酶菌中β-内酰胺酶基因的存在与否进行检测,对耐氨苄西林的流感嗜血杆菌产生β-内酰胺酶机制作了初步分析。
一、实验采取的方法1、流感嗜血杆菌的分离培养收集痰或咽拭子标本,于1 h内接种于改良的哥伦比亚巧克力琼脂平板中,置5%CO2孵箱,37℃孵育18~24h,对疑似流感嗜血杆菌的菌落分别于血琼脂和营养琼脂平板上作卫星试验,仅在血琼脂平板上卫星试验阳性者为流感嗜血杆菌。
用常规的纸片法(K-B法)对每个菌株作体外药物敏感试验,根据美国NCCLS标准判读药敏结果。
从平板上挑取耐氨苄西林的单菌落接种于含3ml 液体HTM培养液的试管中,于5% CO2孵箱37℃孵育培养过夜,离心收集菌体用于质粒制备等后续实验。
内酰胺酶分类
内酰胺酶是一类广泛存在于细菌中的酶类,其作用为水解β-内
酰胺类抗生素,导致细菌的抗性降低。
内酰胺酶可根据其氨基酸序列和催化机制分为多个不同的分类。
第一类内酰胺酶是由单个酶基因编码的,其催化机制为酰基转移。
这一类酶包括TEM酶、SHV酶和CTX-M酶等。
它们可通过基因突变、基因水平的水平转移等方式在细菌中传播,导致多重耐药的出现。
第二类内酰胺酶是由两个酶基因编码的,其中一个基因编码β-
内酰胺酶,另一个基因编码抑制因子。
这一类酶包括AmpC酶和CMY
酶等。
它们的产生通常是由于某些基因突变或转座子的影响,导致抑制因子的失活或缺失,从而使酶的表达量上调。
第三类内酰胺酶是由多个酶基因编码的,其中包括不同的酶、抑制因子和调控基因。
这一类酶包括GES酶和NDM酶等。
它们的产生通常是由于多种基因变异的影响,导致酶的表达量上调和抑制因子的失活或缺失。
以上几类内酰胺酶在细菌中的广泛存在和其产生的多重耐药现
象已成为全球医疗卫生领域的一大难题。
因此,对内酰胺酶的分类和机制的深入研究具有重要意义,可以为制定有效的抗菌药物和治疗方案提供重要的理论依据。
- 1 -。
β-内酰胺酶来源分析
β-内酰胺酶(β-lactamase)的产生是细菌对(β内酰胺类)抗菌药物耐药最常见的机制,在各种耐药机制中占80%。
β-内酰胺酶是由多种酶组成的酶家族,能水解β-内酰胺类抗生素,这些酶的基因存在于细菌的染色体或质粒中。
至今β-内酰胺酶的数量已超过200种,其中超广谱β-内酰胺酶(extended spectrum β-lactamase,ESBL)已超过50种。
β-内酰胺酶是指能催化水解6-氨基青霉烷酸(6-APA)和7-氨基头孢烷酸(7-ACA)及其 N -酰基衍生物分子中β-内酰胺环酰胺键的灭活酶。
细菌产生β-内酰胺酶是细菌对β-内酰胺类抗生素耐药的主要机制。
β-内酰胺酶分为染色体介导酶和耐药质粒介导酶二大类,以其水解对象可分为青霉素酶、头孢菌素酶、广谱酶和超广谱酶四种。
质粒是一种密闭环状双股螺旋结构的DNA,存在于胞浆内,也是具有遗传功能的基因成分,质粒带有各种基因,包括耐药基因,但不是细菌存活所不可缺少的组成物质。
染色体基因决定细菌对抗生素固有耐药性,近代研究证明在院内感染病人中产生质粒介导酶的耐药菌,其产生耐药性大多是在接触抗生素后获得的,并通过耐药基因的转移而播散,也可由基因表达而传至下代。
β-内酰胺酶掺杂于饲料中或直接喂食的可能性:可操作性几乎为零。
1.成品饲料的保存条件下(温度和氧化),β-内酰胺酶会很快失活。
2.β-内酰胺酶直接喂食:β-内酰胺酶在进入动物胃肠道后,会在胃酸,及各种胃肠道内
的蛋白酶(如胃蛋白酶,胰蛋白酶,胆汁,糜蛋白酶等等)作用下水解失活,而不能进入血液循环。
即便有微量β-内酰胺酶进入血液循环,其也会在肝脏解毒分解失活或经肾脏排出。
内源性β-内酰胺酶 —— 本身存在于动物体内的β-内酰胺酶:微乎其微
β - 内酰胺酶是由细菌产生的酶类,生成后存在于细菌内,通过水解或非水解方式破坏进入菌体内的β - 内酰胺环,导致β - 内酰胺类抗生素失活,这是大多数致病菌对β - 内酰胺类抗生素耐药性的主要机制。
因此,产生β - 内酰胺酶的耐药菌在保持其本身结构完整时,是不会将其自身的β - 内酰胺酶释放至宿主(动物)体内的;而当产生β - 内酰胺酶的耐药菌被宿主细胞(如白细胞或淋巴细胞)吞噬破坏后,细菌内的β - 内酰胺酶会释放至动物体细胞内(如白细胞或淋巴细胞),而动物细胞内部的蛋白酶会自动识别作为异体蛋白的
β - 内酰胺酶,从而将其水解破坏,此时也同样不会有完整的β - 内酰胺酶进入动物的体液循环系统。
因此,在动物体内存在完整的β - 内酰胺酶的可能性微乎其微,即便有也会绝大部分经肝脏解毒分解或经肾脏排出体外,乳汁中存在完整的β - 内酰胺酶的可能性更小。
单位换算:
1. β - 内酰胺酶IU(国际单位)定义:一单位酶能够在1分钟内pH 7.0, 25 °C的条件下水解1.0微摩尔
的青霉素G,青霉素G 分子量:356.37,因此1IU酶能分解356.37mg的青霉素G。
2. β - 内酰胺酶(青霉素酶)U(单位,某些检测机构定义):1U青霉素酶U可以分解1个单位青霉素G,
1个单位青霉素G 等于0.6mg。
3. 换算:1IU=365.37/0.6=609U。