高中化学-物质的组成、性质和分类
- 格式:ppt
- 大小:392.00 KB
- 文档页数:34

高中化学知识点全总结一、化学基本概念。
1. 物质的组成、性质和分类。
- 物质的组成。
- 宏观:物质由元素组成,如氧气由氧元素组成。
- 微观:物质由分子、原子、离子等微观粒子构成。
例如,水由水分子构成,金属铁由铁原子构成,氯化钠由钠离子和氯离子构成。
- 物质的性质。
- 物理性质:不需要发生化学变化就表现出来的性质,如颜色、状态、气味、熔点、沸点、硬度、密度等。
例如,铁是银白色固体,水是无色无味的液体。
- 化学性质:物质在化学变化中表现出来的性质,如可燃性、氧化性、还原性、酸碱性等。
例如,氢气具有可燃性,氧气具有氧化性。
- 物质的分类。
- 混合物:由两种或两种以上物质混合而成的物质,如空气、溶液等。
- 纯净物:由一种物质组成的物质,包括单质和化合物。
- 单质:由同种元素组成的纯净物,如氧气(O_2)、铁(Fe)等。
- 化合物:由不同种元素组成的纯净物,如二氧化碳(CO_2)、氯化钠(NaCl)等。
- 氧化物:由两种元素组成,其中一种元素是氧元素的化合物,如氧化铜(CuO)、水(H_2O)等。
2. 化学用语。
- 元素符号:表示元素的符号,如H表示氢元素。
- 化学式:用元素符号和数字的组合表示物质组成的式子。
例如,H_2O表示水的化学式。
- 化学方程式:用化学式表示化学反应的式子。
例如,2H_2 +O_2{longrightarrow}2H_2O表示氢气和氧气反应生成水的化学方程式。
- 离子符号:表示离子的符号,如Na^+表示钠离子,Cl^-表示氯离子。
二、化学基本理论。
1. 原子结构。
- 原子的构成。
- 原子由原子核和核外电子构成,原子核由质子和中子构成(氢原子无中子)。
- 原子序数 = 核电荷数 = 质子数 = 核外电子数。
- 核外电子排布。
- 分层排布,离核由近及远,能量由低到高,每层最多容纳2n^2个电子(n 为电子层数),最外层电子数不超过8个(K层为最外层时不超过2个)。
2. 元素周期律和元素周期表。

高中化学:物质的组成、性质和分类知识点考点1 物质的组成1.元素——宏观概念,说明物质的宏观组成。
元素是质子数相同的一类原子的统称。
质子数相同的微粒不一定是同一种元素,因为微粒的含义要比原子广泛。
2.分子、原子、离子——微观概念,说明物质的微观构成。
(1)分子是保持物质化学性质的一种微粒。
(单原子分子、双原子分子、多原子分子)(2)原子是化学变化中的最小微粒。
(不是构成物质的最小微粒)(3)离子是带电的原子或原子团。
(基:中性原子团)3.核素——具有一定数目的质子和一定数目的中子的一种原子同位素——具有相同质子数和不同中子数的原子互称为同位素同素异形体——同种元素形成的结构不同的单质特别提醒:1.离子与基团:2.同位素与同素异形体:[知识规律]物质到底是由分子、原子还是离子构成?这与物质所属的晶体类型有关。
如金刚石(C)、晶体Si都属原子晶体,其晶体中只有原子;NaCl、KClO3属离子晶体,其晶体中只有阴阳离子;单质S、P4属分子晶体,它们是由原子形成分子,进而构成晶体的。
具体地:(1)由分子构成的物质(分子晶体):①非金属单质:如H2、X2、O2、O3、N2、P4、S、C60、稀有气体等②非金属氢化物:如HX、H2O、NH3、H2S等③酸酐:如SO2、CO2、SO3、P2O5、N2O5 等④酸类:如HClO4、HClO、H2SO4、H3PO4、H2SiO3等⑤有机物:如烃类、烃的衍生物、糖类、氨基酸等⑥其它:如NO、N2O4、Al2Cl6等(2)由原子直接构成的物质(原子晶体):稀有气体、金刚石、晶体硅、二氧化硅、碳化硅、石墨(混合型晶体)等;(3)由阴阳离子构成的物质(离子晶体):绝大多数盐、强碱、低价金属氧化物。
(4)由阳离子和自由电子构成的物质(金属晶体):金属单质、合金考点二物理变化和化学变化1.物理变化和化学变化的比较:(1)特征:有无新物质生成(2)本质:有无化学键的断裂和形成(3)现象:物理变化→大小、形状、状态改变化学变化→发光、发热、变色、析出沉淀等(4)典型实例:物理变化:⑴升华⑵萃取⑶分液⑷蒸馏(分馏)⑸吸附⑹渗析⑺盐析⑻胶体聚沉⑼电泳⑽金属导电 (11)焰色反应(12)电离等化学变化:⑴风化⑵裂化⑶硫化⑷老化⑸炭化⑹干馏⑺脱水⑻蛋白质变性⑼水解⑽同素异形体互变(11)电解 (12)熔融盐导电(13)电解质溶液导电 (14)水泥硬化等。

课时4物质的组成、性质和分类知识点一物质的组成与分类【考必备·清单】1.物质的组成(1)元素、物质及微粒间的关系(2)理解几组概念名称含义原子、分子和离子①原子是化学变化中的最小微粒。
②分子是保持物质化学性质的一种微粒,一般分子由原子通过共价键构成,但稀有气体是单原子分子。
③离子是带电荷的原子或原子团。
元素具有相同核电荷数(即质子数)的同一类原子的总称,在自然界中存在游离态和化合态两种形式。
单质和化合物①单质是由同种元素组成的纯净物。
②化合物是由不同种元素组成的纯净物。
纯净物和混合物①纯净物:由同种单质或化合物组成的物质。
②混合物:由几种不同的单质或化合物组成的物质。
同素异形体同种元素组成的不同单质。
物理性质差别较大;同素异形体之间的转化属于化学变化。
[名师点拨]只含一种元素的物质不一定是单质,如O2和O3的混合物、金刚石与石墨的混合物等。
只含一种元素的纯净物才是单质。
2.简单分类法(1)树状分类法①明确分类标准是对物质正确树状分类的关键[名师点拨]酸、碱、盐、氧化物的含义酸电离出的阳离子全部是H+的化合物是酸,分为强酸与弱酸、含氧酸与无氧酸等碱电离出的阴离子全部是OH-的化合物是碱,分为强碱与弱碱、可溶性碱与难溶性碱等盐由金属阳离子(或铵根离子)与酸根离子组成的化合物是盐,分为可溶性盐与难溶性盐,酸式盐、碱式盐与正盐等氧化物由两种元素组成的化合物,其中一种是氧元素,分为金属氧化物与非金属氧化物,酸性氧化物、碱性氧化物与两性氧化物等②树状分类法在无机物分类中的应用(2)交叉分类法——从不同角度对物质进行分类(如图为氧化物的分类)[名师点拨]①碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物,如Mn2O7为酸性氧化物。
②酸性氧化物不一定是非金属氧化物,如Mn2O7;非金属氧化物也不一定是酸性氧化物,如CO、NO。
③酸性氧化物、碱性氧化物不一定都能与水反应生成相应的酸、碱,如SiO2、Fe2O3。

高中化学基础知识复习(五)物质的组成和分类一、分类法及其应用常见的物质分类方法为和。
1、物质的分类1)根据物质的组成成分,可将物质分为和。
2)根据物质的组成元素,可将纯净物分为和。
①单质一般分为和。
②无机化合物根据组成和性质,又可分为、、、氧化物、氢化物等。
③一般根据氧化物与酸、碱反应的性质,可将其分为和。
2、化学反应的分类按反应物、生成物的种类及数目的多少分为四个基本反应类型化学按反应中分为离子反应反非离子反应应氧化还原反应按反应中分为非氧化还原反应按反应进行的程度和方向分为按反应的热效应分为二、分散系、胶体1、分散系及其分类概念:分散系是指把分散到中所得到的体系。
分散系组成:由和组成溶液:分散质离子直径分类:胶体:分散质离子直径介于之间。
浊液:分散质离子直径。
2、胶体的性质与制备:胶体与其它分散系的本质区别是:。
1)丁达尔效应当一束光通过胶体时,胶体内会出现一条光亮的通路,这是由于胶体粒子对光线而形成的,利用丁达尔效应可以区分。
2)胶体微粒透过滤纸,透过半透膜。
3)胶体的分散质离子电荷,比如Fe(OH)3胶体的胶粒带电。
4)胶体粒子有运动。
5)Fe(OH)3胶体的制备向加入1~2mL 溶液,继续煮沸至溶液呈色,停止加热,即制得Fe(OH)3胶体。
该反应的化学方程式是,该制备方法实质上利用了氯化铁的反应,解释其制备原理:。
三、常见物质的性质1、酸性氧化物(酸酐)——某含氧酸脱去一分子或者几分子水,剩下的部分是该酸的酸酐。
常见的酸性氧化物:部分氧化物,如SO2、SO3、CO2等。
写出下列含氧酸的酸酐:H2SO4H2SO3H2CO3H2SiO3HNO3HClO4酸性氧化物的通性①大多数酸酐可与水反应生成相应的酸(注意特例:除外,它不溶于水也不与水反应)SO2与水反应;SO3与水反应②酸酐与强碱反应生成盐和水(注意少量过量问题)少量SO2与碱反应离子方程式;过量SO2与碱反应离子方程式;③酸酐与碱性氧化物反应生成盐二氧化碳与氧化钠反应的化学方程式2、碱性氧化物——某碱脱去一分子或者几分子水,剩下的部分是碱性氧化物。

高中化学:物质的组成、分类知识点物质的组成、性质和分类1.元素:具有相同核电荷数(即质子数)的一类原子的总称。
元素没有数量意义,只论种类,不论个数。
原子:是化学变化最小的微粒。
少数非金属单质如:金刚石、石墨等直接由原子构成。
金属单质也可以认为由原子构成,但实际是由金属阳离子和自由电子构成的。
分子:是构成物质的一种微粒,它是保持物质化学性质的一种微粒。
某些非金属单质(如:氢气、氧气、S8、Br2、I2和Ar等),氢化物(如氨气、水等),酸酐(如SO2、SO3、P2O5等),酸(如硫酸等),和有机物等由分子构成的。
离子:离子是带电荷的原子或原子团。
绝大多数盐、强碱和某些低价态金属氧化物是由离子构成的。
2.元素有两种存在的形式,在单质中的元素称为游离态元素,在化合物中的元素称为化合态元素。
3.混合物:由不同种物质混合而成,没有固定的组成和性质。
纯净物:由同种物质组成,具有固定的组成和性质。
4.单质:同种元素组成的纯净物(元素的游离态)化合物:不同种元素组成的纯净物(元素的化合态)5.氧化物:由氧元素和另一种元素组成的化合物酸:电离时所生成的阳离子全部是氢离子的化合物碱:电离时所生成的阴离子全部是氢氧根离子的化合物盐:由金属离子和酸根离子组成的化合物6.物质的变化物理变化:物质发生变化时,只是形状或状态发生改变,而没有新物质生成,这种变化叫做物理变化。
发生物理变化时,物质的分子(或原子组合)保持不变。
化学变化:物质发生变化时,生成了新的物质,这种变化叫做化学变化。
发生化学变化时,物质组成中的原子(或离子)重新组合,生成了新的物质。
化学变化场伴随着物理变化,有放热、吸热、改变颜色、生成气体和沉淀等现象。
7.物质的性质物理性质:是指物质在物理变化中表现出来的性质。
如:颜色、聚集状态、气味、熔沸点、密度和硬度等。
化学性质:是指物质在发生化学变化中表现出来的性质。
如可燃性、氧化性、还原性、酸碱性和热稳定性等。
8.物质的分类:注意:判断氧化物所属类别时,一定要注意①酸性氧化物不一定是非金属氧化物,如Mn2O7;非金属氧化物也不一定是酸性氧化物,如CO、NO;②碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物,如Mn2O7是酸性氧化物;Al2O3是两性氧化物。

高中化学必修一目录第一章:物质的组成与性质• 1.1 物质的分类与性质– 1.1.1 物质分类的基本原则– 1.1.2 物质的性质及其变化• 1.2 原子的发现与结构– 1.2.1 原子的发现历史– 1.2.2 原子的结构– 1.2.3 原子的性质• 1.3 元素与化合物– 1.3.1 元素的定义与性质– 1.3.2 化合物的定义与性质– 1.3.3 元素与化合物的区别第二章:中学化学实验• 2.1 常用实验器材的使用– 2.1.1 量具的使用方法和注意事项– 2.1.2 常见实验器材的使用• 2.2 实验操作的方法与步骤– 2.2.1 实验基本操作的方法– 2.2.2 实验步骤的设计与控制• 2.3 实验中观察、记录与分析– 2.3.1 观察与记录的方法和要点– 2.3.2 实验结果数据的整理与分析第三章:化学元素及其周期性• 3.1 元素与周期表– 3.1.1 元素的概念与分类– 3.1.2 元素周期律的发现与演化– 3.1.3 周期表的结构与特点• 3.2 主要元素的性质与用途– 3.2.1 金属元素的性质与用途– 3.2.2 非金属元素的性质与用途– 3.2.3 金属与非金属的区别• 3.3 周期性规律与元素周期表– 3.3.1 周期性规律的概念与表述– 3.3.2 周期性规律的实验依据– 3.3.3 元素周期表中的周期性规律第四章:化学方程式与化学计量• 4.1 化学方程式的写法与平衡– 4.1.1 化学方程式的基本写法– 4.1.2 化学方程式的平衡与不平衡• 4.2 化学反应的类型与特征– 4.2.1 化学反应类型的分类– 4.2.2 化学反应的特征及判断• 4.3 化学计量的概念与关系– 4.3.1 化学计量的基本概念– 4.3.2 化学计量的关系及计算方法第五章:氧化还原反应• 5.1 氧化还原反应的基本概念– 5.1.1 氧化还原反应的定义– 5.1.2 氧化还原反应的基本特征• 5.2 氧化还原反应的符号表示– 5.2.1 氧化态与还原态的表示– 5.2.2 氧化还原反应的符号方程式• 5.3 氧化还原反应的应用– 5.3.1 氧化还原反应在实际生活中的应用– 5.3.2 氧化还原反应在工业领域的应用第六章:离子反应与沉淀反应• 6.1 离子反应的概念与类型– 6.1.1 离子反应的定义与基本特征– 6.1.2 离子反应的类型与实例• 6.2 沉淀反应的条件与特点– 6.2.1 沉淀反应的条件与判别方法– 6.2.2 沉淀反应的特点与应用• 6.3 沉淀反应的实验操作与实例– 6.3.1 沉淀反应实验操作步骤– 6.3.2 沉淀反应实例与观察结果以上为《高中化学必修一目录》的内容目录,每一章节都涵盖了相应的知识点和实验操作,希望对您学习高中化学必修一提供帮助。

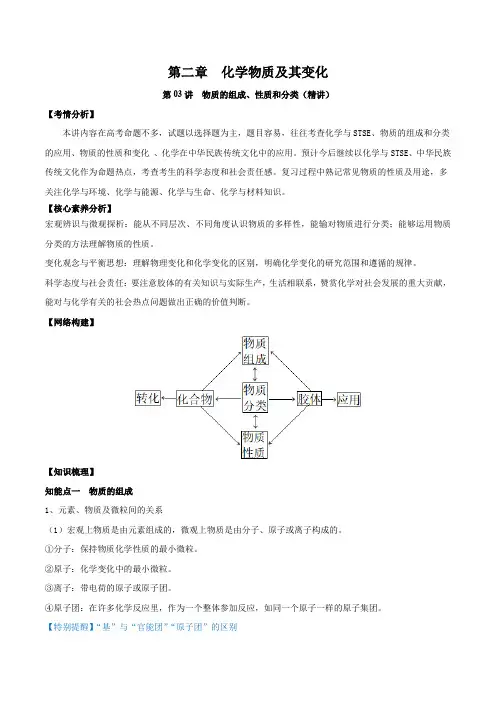
第二章 化学物质及其变化第一讲 物质的组成、性质和分类考点1 物质的组成与分类一、元素、微粒及物质间的关系1.宏观上物质是由元素组成的,微观上物质是由分子、原子或离子构成的。
2.元素:具有相同核电荷数(即质子数)的一类原子的总称。
3.元素与物质的关系元素A――→组成⎩⎪⎨⎪⎧单质:只由一种元素组成的纯净物化合物:由多种元素组成的纯净物4.元素在物质中的存在形态(1)游离态:元素以单质形式存在的状态。
(2)化合态:元素以化合物形式存在的状态。
5.混合物和纯净物(1)纯净物:由同种单质或化合物组成的物质。
(2)混合物:由几种不同的单质或化合物组成的物质。
6.同素异形体(1)同种元素形成的不同单质叫同素异形体。
同素异形体的形成有两种方式:①原子个数不同 ,如O 2和O 3;②原子排列方式不同,如金刚石和石墨。
(2)同素异形体之间的性质差异主要体现在物理性质上,同素异形体之间的转化属于化学变化,但不属于氧化还原反应。
7.元素、微粒及物质间的关系图二、物质的分类1.交叉分类法——从不同角度对物质进行分类(如图为氧化物的分类)2.树状分类法——按不同层次对物质进行逐级分类,各层之间属于包含关系。
考点2物质的性质与变化一、物质的性质与变化二、单质、氧化物、酸、碱、盐的转化关系1.理解物质转化关系图2.形成转化关系一条线:(氢化物→)单质→氧化物→酸或碱→盐。
三、化学反应的分类化学反应⎩⎪⎪⎪⎨⎪⎪⎪⎧按反应物、生成物种类及数目多少分为⎩⎪⎨⎪⎧化合反应分解反应置换反应复分解反应按反应中有无离子参与分为⎩⎪⎨⎪⎧离子反应非离子反应按反应中有无电子转移分为⎩⎪⎨⎪⎧氧化还原反应非氧化还原反应按反应进行的程度和方向分为⎩⎪⎨⎪⎧可逆反应不可逆反应按反应的能量变化分为⎩⎪⎨⎪⎧吸热反应放热反应四、物质变化中的“三馏”“四色”“五解”和“十八化”归类考点3分散系与胶体一、分散系1.概念:把一种(或多种)物质(分散质)分散在另一种(或多种)物质(分散剂)中所得到的体系。

专题二物质的组成、性质和分类课标要求1.认识元素可以组成不同种类的物质,根据物质的组成和性质可以对物质进行分类。
2.同类物质具有相似的性质,一定条件下各类物质可以相互转化。
3.认识元素在物质中可以具有不同价态,可通过氧化还原反应实现含有不同价态同种元素的物质的相互转化。
4.认识胶体是一种常见的分散系。
物质的组成、性质和分类物质的组成、分类与用途(热点角度)2020浙江7月选考,9生活实践理解与辨析结合中华民族优秀文化考查物质的分类及性质(热点角度)2020全国卷Ⅱ,7学习探索归纳与论证结合科研成果等考查物质的组成、性质和变化(热点角度)2019北京,6学术探索分析与推测核心考点核心命题角度考题取样命题情境素养能力高考怎么考物质的组成、性质和分类多结合化学与STSE进行考查,体现化学的实用性;或以前沿科技为载体进行命题,体现化学的创新性;或以古代科技文明、古诗词等为载体进行命题,推介传统文化,增强文化自信。
预计2022年高考会结合与社会热点相关的物质、材料、工艺流程等对物质的性质、应用以及物质之间的相互转化进行考查。
考点1 物质的组成、性质和分类考点帮·必备知识通关考法帮·解题能力提升考法1 物质的性质和变化考点2 分散系及其分类 胶体考点帮·必备知识通关考法帮·解题能力提升考法2 胶体的性质、制备和应用1.物质的组成2.物质的分类(1)常见物质分类标准及分类结果(2)常见的分类方法①树状分类法——按不同层次对物质进行逐级分类,各层之间属于包含关系高中阶段,无机化合物的分类中常涉及的元素有H、O、Na、Mg、Al、K、Ca、Ba、S、N、C、Si、Cl、Br、I等,这些元素的常见化合物分类如下:②交叉分类法——从不同角度对物质进行分类③“价—类”二维图法——从元素在不同化合物中呈现的化合价进行分类。
碳及其化合物的“价—类”二维图如下。
(3)有关物质分类中的易混易错点①纯净物和混合物的区别a.只含一种元素的物质不一定是纯净物。

4 高中化学知识总结第一部分 高中化学基本概念和基本理论一.物质的组成、性质和分类:(一)掌握基本概念1.分子分子是能独立存在并保持物质化学性质的一种微粒。
( 1)分子同原子、离子一样是构成物质的基本微粒.( 2)按组成分子的原子个数可分为:单原子分子如: He 、Ne 、Ar 、Kr③金属晶体中:钠、铁、钾、铜4.元素元素是具有相同核电荷数(即质子数)的同— 类原子的总称。
( 1)元素与物质、分子、原子的区别与联系: 物质是由元素组成的(宏观看) ;物质是由分子、原子或离子构成的(微观看) 。
( 2)某些元素可以形成不同的单质(性质、结构不同) — 同素异形体。
( 3)各种元素在地壳中的质量分数各不相同,2. 原子双原子分子如: O 2、H 2、HCl 、NO多原子分子如: H 2O 、P 4、C 6H 12O 6占前五位的依次是: O 、Si 、 Al 、Fe 、Ca 。
5.同位素是指同一元素不同核素之间互称同位素,即原子是化学变化中的最小微粒。
确切地说,在化学反应中原子核不变,只有核外电子发生变具有相同质子数,不同中子数的同一类原子互称同位素。
如 H 有三种同位素: 1 2 31H 、 1H 、 1H (氕、化。
( 1)原子是组成某些物质(如金刚石、晶体硅、二氧化硅等原子晶体)和分子的基本微粒。
( 2)原子是由原子核 (中子、质子 )和核外电子构成的。
3. 离子离子是指带电荷的原子或原子团。
( 1)离子可分为:阳离子: Li +、Na +、H +、NH + 阴离子: Cl –、O 2–、 OH –、SO 42–( 2)存在离子的物质:①离子化合物中: NaCl 、CaCl 2、Na 2SO 4②电解质溶液中:盐酸、 NaOH 溶液氘、氚)。
6.核素核素是具有特定质量数、 原子序数和核能态, 而且其寿命足以被观察的一类原子。
( 1)同种元素、可以有若干种不同的核素 —同位素。
( 2)同一种元素的各种核素尽管中子数不同, 但它们的质子数和电子数相同。

高中化学基础知识:物质的组成和分类物质的组成:1、分子和由分子构成的物质:(1)分子是构成物质的一种能独立存在的微粒,它坚持着这种物质的化学性质。
分子有一定的大小和质量;分子间有一定距离;分子在不停地运动着;(物理变化是分子运动形状改动的结果),分子间存在分子间作用力(范德华力)和在一些分子间存在氢键。
(2)由分子构成的物质(在固态时均为分子晶体)。
如:干冰、水、硫酸等。
2、原子和原子构成的物质:(1)原子是参与化学变化的最小微粒。
化学反响的实质是原子间重新组合,是原子运动形状的变化。
原子有一定的种类、大小和质量,由原子构成的物质,原子间有一定间隙,原子不停地运动着,原子间有一定的作用力。
(2)由原子构成的晶体,如金刚石、晶体硅等。
3、离子和由离子构成的物质:离子是带电的原子或原子团,绝大少数盐类,强碱,低价金属氧化物等都是由阳离子和阴离子构成的化合物。
注:离子和原子在结构和性质上均不相反。
4、纯真物和混合物:纯真物:由同一种物质组成的物质,即由同种分子或微粒组成,有固定的组成和一定的性质。
混合物:由不同种物质组成的物质,即由不同种分子或微粒组成,无一定的组成,没有固定的熔、沸点。
5、物质的性质和变化:物理变化:没有生成新物质的变化。
如:三态变化、金属导电、蒸馏和分馏、挥发和升华、吸附和盐析、电泳、潮解、溶液及盐的焰色反响、粉碎、凝聚等。
物理性质:不需求经过化学变化就表现出来的性质,如:物质的颜色、形状、气息、密度、硬度、熔沸点、溶解度、导电性等。
化学变化:生成新物质的变化,物质在发作化学变化时,普通都随同着物理变化,但化学变化占优势。
如:风化、老化、裂化、裂解、硝化、磺化、钝化、酯化、皂化、水泥的硬化、硬水的硬化、同素异形体之间的转化等;脱水、脱氧、脱氢、脱硫等;干馏、熄灭、粉尘的爆炸等;电解、电镀、原电池反响、电化学腐蚀等。
化学性质:物质在化学变化进程中表现出来的性质,如物质的氧化性、恢复性、酸碱性等。
物质的组成分类和性质一、物质的组成:宏观组成:宏观上物质由元素组成的,如单质是由同种元素组成的纯净物,化合物是由不同种元素组成的纯净物。
微观构成:微观上物质由分子、原子、离子等基本粒子构成。
分子是保持物质化学性质的一种微粒,原子是化学变化中的最小微粒,一般来说,原子是由质子、中子、核外电子构成。
二、物质的分类:物质分类中的氧化物:1、酸性氧化物不一定是非金属氧化物,如Mn2O7;非金属氧化物也不一定是酸性氧化物,如CO、NO2、碱性氧化物一定是金属氧化物,但是金属氧化物不一定是碱性氧化物,如Mn2O7为酸性氧化物,Al2O3为两性氧化物,Na2O2为过氧化物等3、酸酐一般能与水直接反应生成对应的酸,但SiO2、Mn2O7不能与水直接反应。
4、一种酸酐可以对应多种酸,如HPO3和H3PO4的酸酐均为P2O5。
三、分散系1.分散系(1)概念:一种(或多种)物质分散到另一种(或多种)物质中所得到的混合体系。
(2)组成:由分散质和分散剂组成。
(3)分类:根据分散质粒子的大小,可以分为溶液、胶体和浊液。
2.胶体(1)定义:分散质粒子直径介于1~100nm 之间的分散系。
(2)特征:均一、稳定,(填“能”或“不能”)透过滤纸,(填“能”或“不能”)透过半透膜。
(3)性质:①丁达尔现象:“光柱”形成——区分胶体与溶液的一种物理方法。
②布朗运动:胶体颗粒不断地做无规则的运动。
③电泳:在外加电场作用下,胶粒在分散剂中向电极做定向移动的现象。
电泳现象证明了胶体微粒带有电荷。
胶体带电规律:A、金属氢氧化物、金属氧化物的胶粒带正电(吸附阴离子);B、非金属氧化物、金属硫化物、硅酸、土壤胶体微粒带负电(吸附阳离子,故一般不宜在水田施用硝态氮肥)。
④胶体的凝聚:向胶体中加入少量电解质,使胶粒聚集形成较大颗粒的沉淀而从分散剂中析出的现象。
(此外加热、将两种带相反电荷胶粒的胶体混合也可使其凝聚)实例:①MgCl2用于止血;②豆浆里加盐卤(MgCl2·6H2O)或石膏(CaSO4·2H2O)溶液使之凝聚成豆腐;③水泥里加石膏能调节水泥浆的硬化速率;④在江河与海的交汇处形成的沙洲;⑤用明矾、氯化铁等净水;⑥不同种类的墨水混合使用时有沉淀产生,使墨水失效。
高中化学物质分类化学物质是构成物质世界的基本单位,它们按照不同的性质和用途可以被分类。
在高中化学中,我们常常会遇到各种各样的化学物质,接下来我们将按照不同的分类方式来介绍这些化学物质。
1.按照物质的组成和性质分类化学物质按照其组成和性质的不同可以分为纯物质和混合物两大类。
纯物质是指由一种化学物质组成的物质,可以进一步分为元素和化合物两类。
元素是由同一种原子构成的纯物质,如氧气、氢气等。
化合物是由不同元素组合而成的纯物质,如水、盐酸等。
混合物是由两种或两种以上的化学物质按照一定比例混合而成的物质,可以进一步分为均质混合物和非均质混合物两类。
均质混合物是指组成物质的各个组分在微观上呈现均匀分布的混合物,如盐水、空气等。
非均质混合物是指组成物质的各个组分在微观上呈现不均匀分布的混合物,如沙水、果汁中的果肉等。
2.按照物质的酸碱性分类化学物质按照其酸碱性质的不同可以分为酸、碱和中性物质三大类。
酸是指能够产生氢离子(H+)的物质,如盐酸、硫酸等。
碱是指能够产生氢氧根离子(OH-)的物质,如氢氧化钠、氢氧化钙等。
中性物质是指既不具有酸性也不具有碱性的物质,如水、氧气等。
3.按照物质的物态分类化学物质按照其物态的不同可以分为固体、液体和气体三大类。
固体是指具有一定形状和体积的物质,其分子之间的相互作用力较大,如铁、盐等。
液体是指具有一定体积但没有一定形状的物质,其分子之间的相互作用力较弱,如水、酒精等。
气体是指既没有一定形状也没有一定体积的物质,其分子之间的相互作用力非常弱,如氧气、氢气等。
4.按照物质的用途分类化学物质按照其不同的用途可以分为无机物和有机物两大类。
无机物主要是指不含碳元素的化学物质,如水、盐等。
有机物是指含碳元素的化学物质,如葡萄糖、脂肪酸等。
有机物在生物体内广泛存在,具有重要的生物学功能。
总结起来,高中化学中的化学物质可以按照其组成和性质、酸碱性、物态和用途等不同方式进行分类。
这些分类方式有助于我们更好地理解和学习化学知识,为进一步研究和应用化学提供了基础。
高中化学知识点总结:物质的组成、性质和分类〔一〕掌握根本概念1.分子分子是能够独立存在并保持物质化学性质的一种微粒。
〔1〕分子同原子、离子一样是构成物质的根本微粒.〔2〕按组成分子的原子个数可分为:单原子分子如:He、Ne、Ar、Kr…双原子分子如:O2、H2、HCl、NO…多原子分子如:H2O、P4、C6H12O6…2.原子原子是化学变化中的最小微粒。
确切地说,在化学反响中原子核不变,只有核外电子发生变化。
〔1〕原子是组成某些物质〔如金刚石、晶体硅、二氧化硅等原子晶体〕和分子的根本微粒。
〔2〕原子是由原子核〔中子、质子〕和核外电子构成的。
3.离子离子是指带电荷的原子或原子团。
〔1〕离子可分为:阳离子:Li+、Na+、H+、NH4+…阴离子:Cl–、O2–、OH–、SO42–…〔2〕存在离子的物质:①离子化合物中:NaCl、CaCl2、Na2SO4…②电解质溶液中:盐酸、NaOH溶液…③金属晶体中:钠、铁、钾、铜…4.元素元素是具有一样核电荷数〔即质子数〕的同—类原子的总称。
〔1〕元素与物质、分子、原子的区别与联系:物质是由元素组成的〔宏观看〕;物质是由分子、原子或离子构成的〔微观看〕。
〔2〕某些元素可以形成不同的单质〔性质、构造不同〕—同素异形体。
〔3〕各种元素在地壳中的质量分数各不一样,占前五位的依次是:O、Si、Al、Fe、Ca。
5.同位素是指同一元素不同核素之间互称同位素,即具有一样质子数,不同中子数的同一类原子互称同位素。
如H有三种同位素:11H、21H、31H〔氕、氘、氚〕。
6.核素核素是具有特定质量数、原子序数和核能态,而且其寿命足以被观察的一类原子。
〔1〕同种元素、可以有假设干种不同的核素—同位素。
〔2〕同一种元素的各种核素尽管中子数不同,但它们的质子数和电子数一样。
核外电子排布一样,因而它们的化学性质几乎是一样的。
7.原子团原子团是指多个原子结合成的集体,在许多反响中,原子团作为一个集体参加反响。
知识和技能要求(一)基本概念和基本理论1.物质的组成、性质和分类(1)物质的分子、原子、离子、元素等概念的涵义;了解原子团的定义。
(2)理解物理变化与化学变化的区别与联系。
(3)理解混合物和纯净物、单质和化合物、金属和非金属的概念。
(4)以白磷、红磷为例,了解同素异形体的概念。
(5)理解酸、碱、盐、氧化物的概念及其相互联系。
2.化学用语(1)熟记并正确书写常见元素的名称、符号、离子符号。
(2)理解化合价的涵义。
能根据化合价正确书写化学式(分子式),并能根据化学式判断化合价。
(3)掌握电子、原子结构示意图、分子式、结构式和结构简式的表示方法。
(4)理解质量守恒定律的涵义。
能正确书写化学方程式、热化学方程式、离子方程式、电离方程式、电极反应式。
3.化学中常用计量(1)理解原子量、分子量①的涵义。
(2)掌握物质的量、摩尔质量、物质的量浓度、气体摩尔体积(相应单位为mol、g·mol-1、mol·L-1、L·mol-1)的涵义。
理解阿伏加德罗常数的涵义。
掌握物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况下)之间的相互关系。
4.化学反应基本类型(1)掌握化学反应的四种基本类型:化合、分解、置换、复分解。
(2)理解氧化和还原、氧化性和还原性、氧化剂和还原剂等概念。
能判断氧化还原反应中电子转移的方向和数目,并能配平反应方程式。
5.溶液(1)了解溶液、悬浊液、乳浊液的涵义。
(2)了解溶液的组成、理解溶液中溶质的质量分数的概念。
了解溶液形成过程,溶解时的吸热或放热现象。
(3)了解饱和溶液、不饱和溶液的概念。
理解溶解度的概念。
理解温度对溶解度的影响及溶解度曲线。
(4)了解结晶、结晶水、结晶水合物、风化、潮解的概念。
(5)了解胶体的概念及其重要性质和应用。
6.物质结构(1)理解原子的组成及同位素的概念,掌握原子序数、核电荷数、质子数、中子数、核外电子数,以及质量与质子数、中子数之间的相互关系。
高中化学知识点总结物质的组成性质和分类高中化学知识点总结:物质的组成、性质和分类化学作为一门自然科学,研究物质的组成、性质和变化规律。
在高中化学的学习过程中,我们积累了许多关于物质的基本概念和知识点。
本文将对物质的组成、性质和分类进行总结,希望对化学的学习者有所帮助。
一、物质的组成物质是由不同种类的原子或分子组成的。
原子是构成物质的基本粒子,它由质子、中子和电子组成。
元素是由具有相同原子序数的原子组成的,可以用元素符号表示,如氢(H)、氧(O)等。
化合物是由不同元素的原子按照一定的比例和方式结合而成。
物质的组成还可以根据物质的形态进行分类。
常见的物态有固态、液态和气态。
固态物质具有固定的形状和体积,原子或分子之间的相互作用力较强;液态物质具有固定的体积但可流动,原子或分子之间的相互作用力相对较弱;气态物质具有可压缩性和可流动性,原子或分子之间的相互作用力较弱。
二、物质的性质物质的性质可以分为物理性质和化学性质。
物理性质是物质自身固有的性质,可以通过观察和测量进行判断,而不改变物质的组成。
常见的物理性质有颜色、硬度、密度、熔点和沸点等。
化学性质是物质参与化学反应时表现出来的性质,会导致物质的组成发生变化。
化学性质包括可燃性、氧化性、还原性和酸碱性等。
物质的性质还可以根据其可溶性进行分类。
溶解是指固体、液体或气体溶质与溶剂之间的混合过程。
可溶性是指物质在一定条件下能否溶解于某种溶剂中。
常见的可溶性规律包括“相似相溶原则”和“亲水性和疏水性原则”。
三、物质的分类根据物质的组成和化学性质,可以将物质分为元素和化合物。
元素是由相同原子组成的物质,可以根据其在元素周期表中的位置进行分类,如金属元素、非金属元素和半金属元素等。
化合物是由不同元素的原子组成的物质,可以根据其化学式和结构进行分类,如无机化合物和有机化合物。
根据物质的物理性质和可溶性,可以将物质分为溶液、悬浮液和胶体。
溶液是由溶质溶解于溶剂中而形成的均匀透明的混合物,如盐水、糖水等。