物质的组成、性质和分类资料
- 格式:docx
- 大小:193.98 KB
- 文档页数:15

高中化学:物质的组成、性质和分类知识点考点1 物质的组成1.元素——宏观概念,说明物质的宏观组成。
元素是质子数相同的一类原子的统称。
质子数相同的微粒不一定是同一种元素,因为微粒的含义要比原子广泛。
2.分子、原子、离子——微观概念,说明物质的微观构成。
(1)分子是保持物质化学性质的一种微粒。
(单原子分子、双原子分子、多原子分子)(2)原子是化学变化中的最小微粒。
(不是构成物质的最小微粒)(3)离子是带电的原子或原子团。
(基:中性原子团)3.核素——具有一定数目的质子和一定数目的中子的一种原子同位素——具有相同质子数和不同中子数的原子互称为同位素同素异形体——同种元素形成的结构不同的单质特别提醒:1.离子与基团:2.同位素与同素异形体:[知识规律]物质到底是由分子、原子还是离子构成?这与物质所属的晶体类型有关。
如金刚石(C)、晶体Si都属原子晶体,其晶体中只有原子;NaCl、KClO3属离子晶体,其晶体中只有阴阳离子;单质S、P4属分子晶体,它们是由原子形成分子,进而构成晶体的。
具体地:(1)由分子构成的物质(分子晶体):①非金属单质:如H2、X2、O2、O3、N2、P4、S、C60、稀有气体等②非金属氢化物:如HX、H2O、NH3、H2S等③酸酐:如SO2、CO2、SO3、P2O5、N2O5 等④酸类:如HClO4、HClO、H2SO4、H3PO4、H2SiO3等⑤有机物:如烃类、烃的衍生物、糖类、氨基酸等⑥其它:如NO、N2O4、Al2Cl6等(2)由原子直接构成的物质(原子晶体):稀有气体、金刚石、晶体硅、二氧化硅、碳化硅、石墨(混合型晶体)等;(3)由阴阳离子构成的物质(离子晶体):绝大多数盐、强碱、低价金属氧化物。
(4)由阳离子和自由电子构成的物质(金属晶体):金属单质、合金考点二物理变化和化学变化1.物理变化和化学变化的比较:(1)特征:有无新物质生成(2)本质:有无化学键的断裂和形成(3)现象:物理变化→大小、形状、状态改变化学变化→发光、发热、变色、析出沉淀等(4)典型实例:物理变化:⑴升华⑵萃取⑶分液⑷蒸馏(分馏)⑸吸附⑹渗析⑺盐析⑻胶体聚沉⑼电泳⑽金属导电 (11)焰色反应(12)电离等化学变化:⑴风化⑵裂化⑶硫化⑷老化⑸炭化⑹干馏⑺脱水⑻蛋白质变性⑼水解⑽同素异形体互变(11)电解 (12)熔融盐导电(13)电解质溶液导电 (14)水泥硬化等。

课时4物质的组成、性质和分类知识点一物质的组成与分类【考必备·清单】1.物质的组成(1)元素、物质及微粒间的关系(2)理解几组概念名称含义原子、分子和离子①原子是化学变化中的最小微粒。
②分子是保持物质化学性质的一种微粒,一般分子由原子通过共价键构成,但稀有气体是单原子分子。
③离子是带电荷的原子或原子团。
元素具有相同核电荷数(即质子数)的同一类原子的总称,在自然界中存在游离态和化合态两种形式。
单质和化合物①单质是由同种元素组成的纯净物。
②化合物是由不同种元素组成的纯净物。
纯净物和混合物①纯净物:由同种单质或化合物组成的物质。
②混合物:由几种不同的单质或化合物组成的物质。
同素异形体同种元素组成的不同单质。
物理性质差别较大;同素异形体之间的转化属于化学变化。
[名师点拨]只含一种元素的物质不一定是单质,如O2和O3的混合物、金刚石与石墨的混合物等。
只含一种元素的纯净物才是单质。
2.简单分类法(1)树状分类法①明确分类标准是对物质正确树状分类的关键[名师点拨]酸、碱、盐、氧化物的含义酸电离出的阳离子全部是H+的化合物是酸,分为强酸与弱酸、含氧酸与无氧酸等碱电离出的阴离子全部是OH-的化合物是碱,分为强碱与弱碱、可溶性碱与难溶性碱等盐由金属阳离子(或铵根离子)与酸根离子组成的化合物是盐,分为可溶性盐与难溶性盐,酸式盐、碱式盐与正盐等氧化物由两种元素组成的化合物,其中一种是氧元素,分为金属氧化物与非金属氧化物,酸性氧化物、碱性氧化物与两性氧化物等②树状分类法在无机物分类中的应用(2)交叉分类法——从不同角度对物质进行分类(如图为氧化物的分类)[名师点拨]①碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物,如Mn2O7为酸性氧化物。
②酸性氧化物不一定是非金属氧化物,如Mn2O7;非金属氧化物也不一定是酸性氧化物,如CO、NO。
③酸性氧化物、碱性氧化物不一定都能与水反应生成相应的酸、碱,如SiO2、Fe2O3。


物质的组成、性质及分类一、物质的组成1、元素:具有(即质子数)的一类原子的总称。
元素没有数量意义,只论,不论个数。
2、分子:分子是保持物质性质的一种微粒。
原子:原子是变化中的最小微粒。
在化学变化中,原子不可再分,但原子的要发生变化。
少数非金属单质如:金刚石、石墨等直接由原子构成。
金属单质也可以认为由原子构成,但实际是由和构成的。
离子:带的原子或原子团。
绝大多数盐、强碱和某些低价态金属氧化物是由离子构成的。
注:元素有两种存在的形式,在单质中的元素称为元素,在化合物中的元素称为元素。
二、物质的分类1、基本概念(1)混合物:由不同种物质混合而成,没有固定的组成和性质。
(2)纯净物:由同种物质组成,具有固定的组成和性质。
(3)单质:同种组成的纯净物(元素的游离态)(4)化合物:组成的纯净物(元素的化合态)酸:电离时所生成的阳离子全部是的化合物碱:电离时所生成的阴离子全部是的化合物盐:由和组成的化合物氧化物:由和另一种元素组成的化合物注:1、酸性氧化物:与碱反应生成盐和水的氧化物;碱性氧化物:于酸反应生成盐和水的氧化物2、___________________叫同素异形体。
同素异形体的形成有两种方式:①原子个数不同,如O2和O3;②原子排列方式不同,如金刚石和石墨。
2、常见的分类方法常用的两种是______ ______法和_____ _______法。
注:1、酸性氧化物不一定是非金属氧化物,如2、非金属氧化物也不一定是酸性氧化物,如3、碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物,如4、酸性氧化物、碱性氧化物不一定都能与水反应生成相应的酸、碱。
如题型一、物质的分类1.下列物质分类正确的是( )A.SO2、Si2O、CO均为酸性氧化物B.稀豆浆、硅酸、氯化铁溶液均为胶体C.烧碱、冰醋酸、四氯化碳均为电解质D.福尔马林、水玻璃、氨水均为混合物2.下列有关物质性质的应用正确的是( )A.液氨汽化时要吸收大量的热,可用作制冷剂B.二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸C.生石灰能与水反应,可用来干燥氯气D.氯化铝是一种电解质,可用于电解法制铝3.下列变化属于物理变化的是()A 煤的干馏B 石碱的风化C 丁烷的裂化D 石油的分馏4.下列有关物质的性质和该性质的应用均正确的是( )A.常温下浓硫酸能使铝发生钝化,可在常温下用铝制贮罐贮运浓硫酸B.二氧化硅不与任何酸反应,可用石英制造耐酸容器C.二氧化氯具有还原性,可用于自来水的杀菌消毒D.铜的金属活泼性比铁的弱,可在海轮外壳上装若干铜块以减缓其腐蚀5.通过复习总结,下列归纳正确的是()A.Na2O、NaOH、Na2CO3、NaCl、Na2SO4、Na2O2都属于钠的含氧化合物B.简单非金属阴离子只有还原性,而金属阳离子不一定只有氧化性C.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物D.物质发生化学变化一定有化学键断裂与生成,并伴有能量变化,而发生物理变化就一定没有化学键断裂与生成,也没有能量变化6.下列物质与常用危险化学品的类别不对应的是( )A.H2SO4、NaOH——腐蚀品B.CH4、C2H4——易燃液体C.CaC2、Na——遇湿易燃物品D.KMnO4、K2Cr2O7——氧化剂7.下列物质间的转化可由一步反应完成的是()A SiO2转变成H2SiO3B Cu(OH)2转变成Fe(OH)2C CaCO3转变成Na2CO3D Cu转变成Cu(NO3)28.下列有关物质性质的描述不符合事实的是( )A.有机物不导电B.金刚石是自然界最硬的物质C.SO2可用作食品防腐剂D.NO可用于某些疾病的治疗9.分类是化学学习和研究的常用手段,下列分类依据和结论都正确的是()A.H2O、HCOOH、Cu2(OH)2CO3均含有氧元素,都是氧化物B.HClO、H2SO4(浓)、HNO3均具有氧化性,都是氧化性酸C.HF、CH3COOH、CH3CH2OH都易溶于水,都是电解质D.HCOOH、H2CO3、H2SO4分子中均含有两个氢原子,都是二元酸10A. ①②B.②③C.③④D.②④三、分散系及其分类1、分散系:_一种(或多种)物质分散到另一种(或多种)物质中所得到的体系。

物质的分类知识点总结一、物质的基本概念物质是构成万物的基本要素,是宇宙中自然存在的一切实体的总称,是占据一定空间,有一定质量的任何事物的总称,是构成一切物体的基本成分。
物质是由微观粒子组成的,包括原子、分子等微粒。
物质是具有一定质量、占据一定空间、具有可观察性和可度量性的,是人们认识和利用的客观存在。
物质性质是物质的固有属性,成为物质被认识的依据。
物质的三态:固、液、气。
物质的基本概念包括物质的组成、性质和分类。
二、物质的组成1.原子原子是构成一切物质的基本微粒,是化学元素的最小单位,化学反应中不会分解的微粒。
原子是由质子、中子和电子组成。
2.分子分子是原子按照一定比例结合而成的,分子的组成是由原子组成的。
分子在化学反应中会发生改变,化学反应中发生的都是分子的变化。
分子的构成有原子殊,分子中原子的种类与比例确定了分子的性质。
3.离子离子是由失去或者获得电子而具有电荷的粒子,可以是单个原子,也可以是分子,称为单一离子,或者多个原子或分子部分组成的有电荷的团体,称为复合离子。
离子在水溶液中自由移动,具有导电性和电化学反应性。
三、物质的性质1.物质的物理性质物质的物理性质是指不改变物质本质情况下,其所具有的固有性质,可以通过物理方法进行观察和度量。
物质的物理性质包括:颜色、气味、密度、熔点、沸点、导电性、磁性等。
2.物质的化学性质物质的化学性质是指物质在与其他物质发生化学反应时所表现出的性质。
物质的化学性质是通过化学反应和实验才能得以确认。
物质的化学性质包括:与其他物质发生反应、氧化还原性、酸碱性、水解性等。
3.物质的结构性质物质的结构性质是指物质内部微观结构和组成的性质。
物质的结构性质决定了物质的各种物理和化学性质。
物质的结构性质包括:原子和分子的结构、离子的组合方式等。
四、物质的分类1.物质的分类方法物质的分类可以通过不同的角度和属性来进行分类,包括化学性质、物理性质、组成结构等方面的分类。
物质的分类方法包括:按组成结构分类、按化学性质分类、按物理性质分类等。


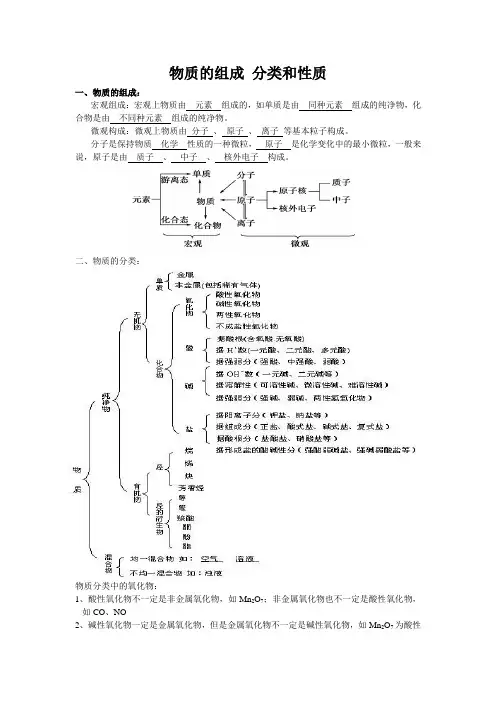
物质的组成分类和性质一、物质的组成:宏观组成:宏观上物质由元素组成的,如单质是由同种元素组成的纯净物,化合物是由不同种元素组成的纯净物。
微观构成:微观上物质由分子、原子、离子等基本粒子构成。
分子是保持物质化学性质的一种微粒,原子是化学变化中的最小微粒,一般来说,原子是由质子、中子、核外电子构成。
二、物质的分类:物质分类中的氧化物:1、酸性氧化物不一定是非金属氧化物,如Mn2O7;非金属氧化物也不一定是酸性氧化物,如CO、NO2、碱性氧化物一定是金属氧化物,但是金属氧化物不一定是碱性氧化物,如Mn2O7为酸性氧化物,Al2O3为两性氧化物,Na2O2为过氧化物等3、酸酐一般能与水直接反应生成对应的酸,但SiO2、Mn2O7不能与水直接反应。
4、一种酸酐可以对应多种酸,如HPO3和H3PO4的酸酐均为P2O5。
三、分散系1.分散系(1)概念:一种(或多种)物质分散到另一种(或多种)物质中所得到的混合体系。
(2)组成:由分散质和分散剂组成。
(3)分类:根据分散质粒子的大小,可以分为溶液、胶体和浊液。
2.胶体(1)定义:分散质粒子直径介于1~100nm 之间的分散系。
(2)特征:均一、稳定,(填“能”或“不能”)透过滤纸,(填“能”或“不能”)透过半透膜。
(3)性质:①丁达尔现象:“光柱”形成——区分胶体与溶液的一种物理方法。
②布朗运动:胶体颗粒不断地做无规则的运动。
③电泳:在外加电场作用下,胶粒在分散剂中向电极做定向移动的现象。
电泳现象证明了胶体微粒带有电荷。
胶体带电规律:A、金属氢氧化物、金属氧化物的胶粒带正电(吸附阴离子);B、非金属氧化物、金属硫化物、硅酸、土壤胶体微粒带负电(吸附阳离子,故一般不宜在水田施用硝态氮肥)。
④胶体的凝聚:向胶体中加入少量电解质,使胶粒聚集形成较大颗粒的沉淀而从分散剂中析出的现象。
(此外加热、将两种带相反电荷胶粒的胶体混合也可使其凝聚)实例:①MgCl2用于止血;②豆浆里加盐卤(MgCl2·6H2O)或石膏(CaSO4·2H2O)溶液使之凝聚成豆腐;③水泥里加石膏能调节水泥浆的硬化速率;④在江河与海的交汇处形成的沙洲;⑤用明矾、氯化铁等净水;⑥不同种类的墨水混合使用时有沉淀产生,使墨水失效。

物质的组成、性质和分类物质的组成、性质和分类1.元素:具有相同核电荷数(即质子数)的一类原子的总称。
元素没有数量意义,只论种类,不论个数。
原子:是化学变化最小的微粒。
少数非金属单质如:金刚石、石墨等直接由原子构成。
金属单质也可以认为由原子构成,但实际是由金属阳离子和自由电子构成的。
分子:是构成物质的一种微粒,它是保持物质化学性质的一种微粒。
某些非金属单质(如:氢气、氧气、S8、Br2、I2和Ar等),氢化物(如氨气、水等),酸酐(如SO2、SO3、P2O5等),酸(如硫酸等),和有机物等由分子构成的。
离子:离子是带电荷的原子或原子团。
绝大多数盐、强碱和某些低价态金属氧化物是由离子构成的。
2.元素有两种存在的形式,在单质中的元素称为游离态元素,在化合物中的元素称为化合态元素。
3.混合物:由不同种物质混合而成,没有固定的组成和性质。
纯净物:由同种物质组成,具有固定的组成和性质。
4.单质:同种元素组成的纯净物(元素的游离态)化合物:不同种元素组成的纯净物(元素的化合态)5.氧化物:由氧元素和另一种元素组成的化合物酸:电离时所生成的阳离子全部是氢离子的化合物碱:电离时所生成的阴离子全部是氢氧根离子的化合物盐:由金属离子和酸根离子组成的化合物6.物质的变化物理变化:物质发生变化时,只是形状或状态发生改变,而没有新物质生成,这种变化叫做物理变化。
发生物理变化时,物质的分子(或原子组合)保持不变。
化学变化:物质发生变化时,生成了新的物质,这种变化叫做化学变化。
发生化学变化时,物质组成中的原子(或离子)重新组合,生成了新的物质。
化学变化场伴随着物理变化,有放热、吸热、改变颜色、生成气体和沉淀等现象。
7.物质的性质物理性质:是指物质在物理变化中表现出来的性质。
如:颜色、聚集状态、气味、熔沸点、密度和硬度等。
化学性质:是指物质在发生化学变化中表现出来的性质。
如可燃性、氧化性、还原性、酸碱性和热稳定性等。
8.物质的分类:金属:钠、铁混合物酸性氧化物CO2、SO2单质非金属:氯气、硫物质成盐氧化物碱性氧化物Na2O、CuO稀有气体:氖、氩纯净物氧化物两性氧化物Al2O3、ZnO不成盐氧化物:NO、CO、NO2无氧酸:HCl、H2S化合物酸含氧酸:H2SO4、H3PO4可溶性碱:NaOH、KOH、Ba(OH)2、Ca(OH)2碱不溶性碱:Mg(OH)2、Cu(OH)2正盐:Na2CO3、K2S酸式盐:NaHCO3、NaHSO4、CaHPO4盐碱式盐:Cu2(OH)2CO3、Mg(OH)Cl复盐:KAl(SO4)2·12H2O络盐:Na3AlF6注意:判断氧化物所属类别时,一定要注意①酸性氧化物不一定是非金属氧化物,如Mn2O7;非金属氧化物也不一定是酸性氧化物,如CO、NO;②碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物,如Mn2O7是酸性氧化物;Al2O3是两性氧化物。


高中化学知识点总结物质的组成性质和分类高中化学知识点总结:物质的组成、性质和分类化学作为一门自然科学,研究物质的组成、性质和变化规律。
在高中化学的学习过程中,我们积累了许多关于物质的基本概念和知识点。
本文将对物质的组成、性质和分类进行总结,希望对化学的学习者有所帮助。
一、物质的组成物质是由不同种类的原子或分子组成的。
原子是构成物质的基本粒子,它由质子、中子和电子组成。
元素是由具有相同原子序数的原子组成的,可以用元素符号表示,如氢(H)、氧(O)等。
化合物是由不同元素的原子按照一定的比例和方式结合而成。
物质的组成还可以根据物质的形态进行分类。
常见的物态有固态、液态和气态。
固态物质具有固定的形状和体积,原子或分子之间的相互作用力较强;液态物质具有固定的体积但可流动,原子或分子之间的相互作用力相对较弱;气态物质具有可压缩性和可流动性,原子或分子之间的相互作用力较弱。
二、物质的性质物质的性质可以分为物理性质和化学性质。
物理性质是物质自身固有的性质,可以通过观察和测量进行判断,而不改变物质的组成。
常见的物理性质有颜色、硬度、密度、熔点和沸点等。
化学性质是物质参与化学反应时表现出来的性质,会导致物质的组成发生变化。
化学性质包括可燃性、氧化性、还原性和酸碱性等。
物质的性质还可以根据其可溶性进行分类。
溶解是指固体、液体或气体溶质与溶剂之间的混合过程。
可溶性是指物质在一定条件下能否溶解于某种溶剂中。
常见的可溶性规律包括“相似相溶原则”和“亲水性和疏水性原则”。
三、物质的分类根据物质的组成和化学性质,可以将物质分为元素和化合物。
元素是由相同原子组成的物质,可以根据其在元素周期表中的位置进行分类,如金属元素、非金属元素和半金属元素等。
化合物是由不同元素的原子组成的物质,可以根据其化学式和结构进行分类,如无机化合物和有机化合物。
根据物质的物理性质和可溶性,可以将物质分为溶液、悬浮液和胶体。
溶液是由溶质溶解于溶剂中而形成的均匀透明的混合物,如盐水、糖水等。
高中化学物质的分类知识点总结高中化学物质的分类知识点总结一、物质的组成、性质和分类:(一)掌握基本概念1.分子分子是能够独立存在并保持物质化学性质的一种微粒。
(1)分子同原子、离子一样是构成物质的基本微粒。
(2)按组成分子的原子个数可分为:单原子分子:Ne 、C、He 、Kr……双原子分子:H2 、O2、HCl、No……多原子分子:H2O、P4 、C6H12O6……2.原子原子是化学变化中的最小微粒,确切的说,化学反应中原子核不变,只有核外电子发生变化。
(1)原子是组成某些物质(如金刚石、晶体硅、二氧化硅等原子晶体)和分子的基本微粒。
(2)原子是由原子核(中子、质子)和核外电子组成的。
3.离子离子是指带电荷的原子或原子团。
(1)离子可分为阳离子和阴离子阳离子:Li+、Na+、H+、NH4+……阴离子:Cl-、O2-、OH-、SO4-……(2)存在离子的物质:①离子化合物中:NaCl、CaCl2、CaSo4……②电解质溶液中:盐酸、氯化钠溶液中……③金属晶体中:钠、铁、钾、铜……4.元素元素是具有相同核电荷数的(即质子数)的同一类原子的总称。
(1)元素与物质、分子、原子的区别与联系;物质是由元素组成的(宏观看);物质是由原子、分子、或离子构成的(微观看)。
(2)某些元素可以形成不同的单质(性质、结构不同)同素异形体。
(3)各元素在地壳中质量分数各不相同,占前五位的是:O、Si、Al、Fe、Ga。
5.同位素同位素指同一元素不同核素之间互称同位素,即具有相同质子数不同中子数的同一类原子互称为同位素。
如氢(H)有三种同位素:11H、21H、31H(氕、氘、氚)。
6.核素核素是具有特定质量数、原子序数和核能态,而且其寿命足以被观察的一类原子。
(1)同种元素,可以有若干种不同的核素—同位素。
(2)同一种元素的各种核素尽管中子数不同,但他们质子数与电子数相同。
核外电子排布相同,因而他们的化学性质几乎相同。
7.原子团原子团是指多个原子结合成的集体,在许多反应中,原子团作为一个集体参加反应。
物质的组成与性质物质是构成我们周围世界的基本单位。
它们以不同的形式和性质存在,通过它们的组成和结构,我们能够了解它们的性质和行为。
在本文中,我们将讨论物质的组成、分类和性质。
一、物质的组成物质由原子和分子组成。
原子是最基本的单位,它们与其他原子结合形成分子。
原子由质子、中子和电子组成。
质子和中子位于原子核中,而电子则围绕核心旋转。
原子的种类由其核中所含有的质子数决定,这被称为原子序数。
例如,氢原子的原子序数为1,氧原子的原子序数为8。
分子是由两个或多个原子结合而成的,它们可以是相同类型的原子,如氧气(O2)和氮气(N2),也可以是不同类型的原子,如水(H2O)和二氧化碳(CO2)。
分子通过共用或交换电子来结合在一起。
二、物质的分类物质可以根据其组成和性质进行分类。
最常见的分类方法是将物质分为纯物质和混合物。
纯物质是由同一种类型的粒子组成的物质。
它们可以是单一的原子或分子,例如金属元素铁(Fe)和氧气(O2)。
纯物质还可以是化合物,由不同类型的原子组成,如水(H2O)和盐(NaCl)。
混合物由两种或更多种类型的物质混合而成,它们保留了各自成分的性质。
混合物可以是均匀的或不均匀的。
均匀混合物也被称为溶液,其中溶剂和溶质彼此完全混合。
例如,盐水是水作为溶剂,溶解了盐作为溶质的溶液。
三、物质的性质物质的性质可以分为物理性质和化学性质。
物理性质是可以通过观察和测量来确定的性质。
它们包括颜色、形状、密度、熔点和沸点等。
物理性质可以用来识别物质并区分它们之间的差异。
化学性质指的是物质在与其他物质发生反应时所表现出来的性质。
它们包括物质的可燃性、反应性、氧化性等。
化学性质可以描述物质与其他物质之间的相互作用和变化。
物质的性质还可以分为基本性质和特定性质。
基本性质是与物质的组成和结构无关的性质,而特定性质则是由物质的组成和结构决定的。
总结起来,物质以原子和分子的形式存在,根据其组成和性质被分类为纯物质和混合物。
物质的性质可以分为物理性质和化学性质,它们描述了物质的外观和行为。
物质的组成、分类、性质一、物质的组成1.元素——宏观概念,说明物质的宏观组成。
元素是质子数相同的一类原子的统称。
质子数相同的微粒不一定是同一种元素,因为微粒的含义要比原子广泛。
2、同位素:具有相同质子数和不同中子数的同种元素的不同种原子,互称同位素。
“同位”是指在周期表中处于同一位置。
同位素的特征是原子序数相同而质量数不同。
大多数元素都有几种甚至十几种的同位素。
人们把具有一定数目的质子和一定数目的中子的一种原子叫做核素,同一元素的不同核素之间互称为同位素。
(1)同位素的实例H有三种同位素:11H、12H、13H;O有三种同位素:816O、817O;118O有三种同位素:612C、613C、614C ;Sn有十种同位素:50112Sn、50114Sn、50115Sn····50124Sn, U有二种同位素:92235、U92238U 。
目前已知的同位素达数千种。
(2)同位素的稳定性(3)同位素的性质:a.天然同位素有稳定的百分组成b.化学性质几乎相同(同种元素的同位素)(4)同位素的应用:用612C作相对原子质量和阿伏加德罗常数的标准;示踪原子:用614C测岩石的年龄;放射治疗,如60C。
等核能,如2H,235U等⑶核素:具有一定数目的质子和一定数目的中子的一种原子叫做核素。
即质子数、中子数不完全相同的一种原子就称为一种核素。
例如:11H、12H、13H、612C、613C、614C、92235、U92238U 都各自独立称为核素,即8种核素(但属于3种元素)。
注意:同一种元素的不同核素之间互称同位素。
3、同素异形体:由同种元素所形成的几种性质不同种单质叫做同素异形体。
如O2(氧气)和O3(臭氧),红磷(P)和白磷(P4),金刚石和石墨等。
(1)同素异形体的物理性质不同,化学性质相似。
②性质不同的原因是结构不同或组成不同。
(2)同素异形体之间可以相互转化,属于化学变化,但不属于氧化还原反应。
如:【例】16O和18O是氧元素的两种核素,AN表示阿伏伽德罗常数,下列说法正确的是A.162O与182O互为同分异构体B. 16O与18O核外电子排布方式不同C.通过化学变化可以实现16O与18O间的相互转化D.标准状况下,1.12L 162O和1.12L182O均含有0.1AN个氧原子解析:A中的物质是同一种物质,都是氧气,故A错;B中的两种氧原子的电子数相等,核外电子排布也相等,故B错;之间的转化,16O,18O是原子核的变化,不化学变化,故C错;1.12L标准状况下2O的物质的量为0.05mol,含有氧原子数为0.1AN,故D正确。
1.下列各组物质中,互为同位素的是()A.重氢、超重氢B.氧、臭氧C.红磷、白磷D.乙酸、丙酸2.有下列各组物质:A.O2和O3(臭氧)B. C.CH3CH2CH2CH3和CH3CH(CH3)2D.和E.葡萄糖和果糖F.(CH3)2CH2与C(CH3)4G.淀粉和纤维素 H.液氯与氯气(1)_______组两物质互为同位素(2)_______组两物质互为同素异形体(3)_______组两物质属于同系物(4)_______组两组物质互为同分异构体(5)_______组中的物质是同一物质(6)D中任意一者与氯气反应的一个化学方程式___________答案:Ⅰ.(1)B;(2)A;(3)F;(4)CE;(5)DH;(6)CH2Br2+Cl2→CHBr2Cl+HCl4.分子和由分子构成的物质⑴分子是构成物质的一种能独立存在的微粒,它保持着这种物质的化学性质分子有一定的大小和质量;分子间有一定距离;分子在不停地运动着(物理变化是分子运动状态改变的结果);分子间有分子间作用(范德华力)。
⑵由分子构成的物质(在固态时为分子晶体)。
一些非金属单质(如H2、O2、Cl2、S、惰性气体等);气态氢化物;酸酐(SiO2除外);酸类和大多数有机物等。
5.原子和由原子构成的物质⑴原子是参加化学变化的最小微粒。
化学反应的实质是原子的拆分和化合,是原子运动形态的变化原子有一定的种类、大小和质量;由原子构成的物质中原子间也有一定间隔;原子不停地运动着;原子间有一定的作用力。
⑵由原子构成的物质(固态时为原子晶体)。
金刚石、晶体硅、二氧化硅、碳化硅(SiC )等。
元素与原子主要区别(1)定义不同:元素是原子核内质子数相同的一类原子的总称,而原子是组成自然界物质如单质和化合物分子的基本粒子。
(2)范畴不同:原子是微观粒子,元素一般属于宏观范畴。
(3)量的概念不同:元素只讲种类,不讲个数,而原子既讲种类,又讲个数。
(4)在化学反应中的变化不同:在任何化学反应中,元素的种类不会发生变化,而原子却可变化成离子、分子,离子也可以变成原子。
元素与原子联系(1)元素和原子是群体与个体的关系。
如一个一个的氧原子所构成的氧原子集体就是元素。
(2)原子是体现元素化学性质的最小微粒。
也就是说,一个原子具有与该原子所属元素完全相同的化学性质。
如1个钠原子与钠元素的化学性质完全相同。
6.离子和由离子构成的物质⑴离子是带有电荷的原子或原子团。
带正电荷的阳离子如Na +、Fe 3+、H 3O +、NH 4+、 [Ag(NH 3)2]+等;带负电荷的阴离子如Cl -、S 2—、OH —、SO 42—、[Fe(CN)6]3—等。
⑵由离子构成的物质(固态时为离子晶体)。
绝大多数盐类(AlCl 3等除外);强碱类和低价金属氧化物等是由阳离子和阴离子构成的化合物。
【注意】离子和原子的区别和联系:离子和原子在结构(电子排布、电性、半径)和性质(颜色,对某物质的不同反应情况,氧化性或还原性等)上均不相同。
阳离子 原子 阴离子(简单阳、阴离子)2.顺式Pt (NH 3)2Cl 2(式量为300)是临床广泛使用的抗肿瘤药物。
下列有关该物质的说法中正确的是A .由4种元素组成B .含有NH 3分子C .Pt 的化合价为+4D .Pt 元素的质量百分含量为65% 答案:AD解析:题目以临床医学广泛使用的搞肿瘤药物为背景考查学生对物质类别及组成的认识。
Pt(NH 3)2Cl 2药物组成不可能有NH 3分子,否则会逸出且NH 3有毒,故B 错。
因NH 3为0价,故Pt 为+2价,C 错。
得 ne-失 ne-得 ne -失 ne -二、物质的分类混合物(同种物质)1、纯净物和混和物常见的混合物包括:⑴高分子化合物(如蛋白质、淀粉、纤维素、聚合物等);•⑵分散系(包括溶液、胶体、浊液)⑶同分异构间的混合体(如二甲苯总是混合物,含邻、间、对三种)⑷同素异形体间的混合体(注:由同位素原子组成的物质是纯净物,如H2O和D2O混合后仍未纯净物)。
⑸其他:①氨水、氯水、王水、天然水、硬水、软水、水玻璃、福尔马林、盐酸、浓硫酸;②爆鸣气、水煤气、天然气、焦炉气、高炉煤气、石油气、裂解气、空气;③钢、生铁、普钙、漂白粉、碱石灰、黑火药、铝热剂、水泥、铁触媒、玻璃、煤;④煤焦油、石油及其各种馏分、植物油和动物油。
例1.下列物质中,属于纯净物的是( )A双氧水溶液B.空气C.水D.石灰石例2.下列物质中,属于混合物的是( )A.天然气 B.冰水混合物 C.二氧化碳D.胆矾1下列物质中属于纯净物的是( )A. 啤酒B. 蒸馏水C. 精制碘盐D. 酱油2下列物质中,属于纯净物的是( )A,福尔马林B,医用消毒酒精C,乙醛D,聚乙烯3.下列物质中,属于纯净物的是()A.海水B.蒸馏水C.空气D.生铁2、单质和化合物1、单质:由同种元素组成的纯净物。
如氧气、氮气、碳等。
化合物无机化合物有机化合物:烃、烃的衍生物等氧化物氢化物酸、碱盐类:正盐、酸纯净物(不同种物质)物质单质:金属单质、非金属单质(包括稀有气体)酸性氧化物碱性氧化物两性氧化物不成盐氧化物过氧化物2、化合物:由不同元素组成的纯净物。
如水、氧化铜、高锰酸钾等。
3、氧化物:由两种元素组成,且其中一种元素是氧元素化合物。
如氧化镁、二氧化碳。
例1单质区别于化合物的判断依据是( ) (A)同种物质组成(B)同种元素组成(C)同种分子组成(D)同种微粒组成例2.下列关于化合物的叙述,正确的是( ) (A)化合物不一定是指纯净物(B)化合物一定含有两种以上元素组成的物质(C)物质不是单质就一定是化合物(D)物质中含有几种元素就一定是化合物1.下列属于同一种物质的是( )(A)金刚石、石墨(B)石灰水、氢氧化钙(C)生石灰、熟石灰(D)二氧化碳、干冰2.从海水可获得的在常温下为液体的单质是A.Mg B.KC.Br2 D.I23.某合作学习小组讨论辨析以下说法:①粗盐和酸雨都是混合物;②沼气和水蒸气都是可再生能源;③冰和干冰既是纯净物又是化合物;④不锈钢和目前流通的硬币都是合金;⑤盐酸和食醋既是化合物又是酸;⑥纯碱和熟石灰都是碱;⑦豆浆和雾都是胶体。
上述说法正确的是A.①②③④B.①②⑤⑥C.③⑤⑥⑦D.①③④⑦4.同素异形现象同素异形现象:同种元素形成的单质性质不同的现象同素异形体:同种元素组成的性质不同的几种单质。
例如:C元素的同素异形体有:金刚石、石墨、C60,O元素的同素异形体有:O2、O3,P元素的同素异形体有:红磷、白磷同素异形体在一定条件下可以相互转化,其转化过程破坏原有化学键,因而属于化学变化。
同素异形体在纯氧中充分燃烧的产物是唯一的,因此可以由此两个方面证明其互为同素异形体。
4、化合物: 由不同元素组成的纯净物。
如水、氧化铜、高锰酸钾等不同元素组成的纯净物叫化合物。
它又分为有机化合物和无机化合物两大类。
无机化合物的初步分类见前页表(1)氢化物:由氢和另一种元素形成的化合物。
一般由非金属元素形成的氢化物,其固体属分子晶体,熔点较低,常温呈气态,称气态氢化物;碱金属及碱土金属(ⅡA)与氢形成的氢化物则属于离子型氢化物,其中氢元素为-1价。
(2)氧化物:由氧和另一种元素形成的化合物。
根据其性质可进一步分为: A .碱性氧化物-与酸反应生成盐和水的氧化物。
一般低价金属氧化物,特别是活泼金属氧化物(ⅠA 、ⅡA 族)属于此类氧化物B .酸性氧化物-与碱反应生成盐和水的氧化物。
一般非金属氧化物,特别是高价非金属氧化物(CO2、SO2、SO3)和高价金属氧化物(Mn2O7、CrO3)属于此类氧化物C .两性氧化物-既能跟酸起反应又能跟碱起反应,生成盐和水的氧化物。
如Al2O3、ZnO 、Beo 等。
注意:a 酸性氧化物、碱性氧化物(包括两性氧化物)的对应(化合价一致)水化物是含氧酸或碱。
b .少数几种氧化物如CO 、NO 等,既不能跟酸,也不能与碱反应生成盐和水,叫做不成盐氧化物。
c .酸性氧化物、碱性氧化物分别可以看成是含氧酸、碱失去水的剩余部分,又称酸酐,酸酐(其中相应元素R 的化合价相同)),如SO3是硫酸的酸酐,SO2是亚硫酸的酸酐,N2O5是硝酸的酸酐。