配合物结构晶体分子
- 格式:ppt
- 大小:3.37 MB
- 文档页数:60





物质结构与性质高考热点归纳配位数的确定一、各种典型配合物中配位数的判断1.配位数可以等同于中心离子(或原子)与配位原子形成的配位键键数,也可以等同于配位体的数目。
如[Ag(NH3)2]NO3、[Ag(CN)2]-、[Cu(NH3)4]SO4、[Cu(H2O)4]2+、[Zn(NH3)4]2+、[Zn(CN)4]2-、K3[Fe(SCN)6]、[Fe(CN)6]3-、[FeF6]3-等配合物或配离子中的中心离子与配位体的数目以及配位原子形成的配位键键数均相等,其中Ag+离子的配位数为2,Cu2+离子与Zn2+离子的配位数均为4,Fe3+离子的配位数为6。
一般规律:一般配合物的配位数可以按中心离子电荷数的二倍来计算。
又如Ni(CO)4、Fe(CO)5、Cr(CO)6等羰基化合物中Ni、Fe、Cr原子的配位数分别为4、5、6。
[Co(NH3)4(H2O)2]Cl2、[CrCl(H2O)5]Cl2中Co2+离子与Cr3+离子的配位数均为6。
说明:羰基化合物中的中心原子呈电中性,此类配合物的配位数由化学式直接判断。
Co2+离子与Cr3+离子的电荷数分别为2、3,但配位数都是6。
所以,配合物的配位数不一定按中心离子(或原子)的电荷数判断。
2.当中心离子(或原子)与多基配体配合时,配位数可以等同于配位原子的数目,但不是配位体的数目。
如[Cu(EN)2]中的EN是乙二胺(NH2CH2CH2NH2)的简写,属于双基配体,每个乙二胺分子有2个N原子与Cu2+离子配位,故Cu2+离子的配位数是4而不是2。
3.当中心离子(或原子)同时以共价键与配位键结合时,配位数不等于配位键的键数。
如[BF4]-、[B(OH)4]-、[AlCl4]-、[Al(OH)4]-等配离子中,B、Al原子均缺电子,它们形成的化学键,既有共价键,又有配位键,配位数与配位键的键数不相等,配位数均为4。
又如Al2Cl6(如下左图所示)中Al原子的配位数为4。
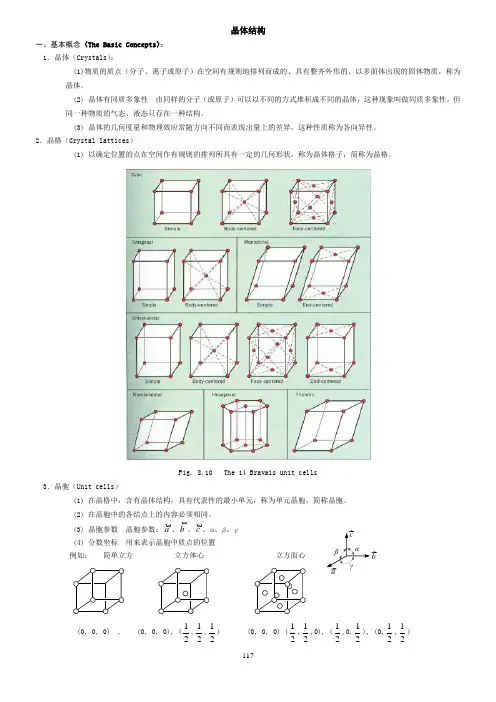
117晶体结构一、基本概念(The Basic Concepts ): 1.晶体(Crystals ):(1)物质的质点(分子、离子或原子)在空间有规则地排列而成的、具有整齐外形的、以多面体出现的固体物质,称为晶体。
(2) 晶体有同质多象性 由同样的分子(或原子)可以以不同的方式堆积成不同的晶体,这种现象叫做同质多象性。
但同一种物质的气态、液态只存在一种结构。
(3) 晶体的几何度量和物理效应常随方向不同而表现出量上的差异,这种性质称为各向异性。
2.晶格(Crystal lattices )(1) 以确定位置的点在空间作有规则的排列所具有一定的几何形状,称为晶体格子,简称为晶格。
Fig. 8.10 The 14 Bravais unit cells3.晶胞(Unit cells )(1) 在晶格中,含有晶体结构,具有代表性的最小单元,称为单元晶胞,简称晶胞。
(2) 在晶胞中的各结点上的内容必须相同。
(3) 晶胞参数 晶胞参数:a、b、c、α、β、γ (4) 分数坐标 用来表示晶胞中质点的位置例如: 简单立方 立方体心 立方面心(0, 0, 0) , (0, 0, 0), (21,21,21) (0, 0, 0) (21,21,0), (21,0,21), (0,21,21) αβγbc a118在分数坐标中,绝对不能出现1,因为1即0。
这说明晶胞是可以前后、左右、上下平移的。
等价点只需要一个坐标来表示即可,上述三个晶胞中所含的质点分别为1、2、4,所以分数坐标分别为1组、2组和4组。
(5) 晶面指数 晶面在三维空间坐标上的截距的倒数(h 、k 、l )来表示晶体中的晶面,称为晶面指数,如立方晶系中(100),(110),(111)面分别为(100) (110)(111)lFig. 8.12 Selected planes and their Miller indices for cubic system用X-ray 的衍射可以测量晶体中的面间距,2d ·sin θ = n ·λ。

配合物结构一、配位化合物的定义由提供孤电子对(NH3、H2O、X「)或n电子(H2C= CH2、| 、)的物种与提供适当空轨道的物种(金属原子或金属离子)组成的化合物称为配位化合物,简称为配合物。
二、配位化合物的组成1 .配合物由内界(inner)和外界(outer)组成。
外界为简单离子,配合物可以无外界,但不可以无内界。
例如:Fe(CO)5 Pt(NH3)2Cl22 .内界由中心体(center)和配位体(ligand)组成。
(1) 中心体:提供适当的空轨道的原子或离子,绝大部分是d区或ds区元素。
用M表示。
(2) 配位体(L)(简称配体):提供孤对电子对或n电子的离子,离子团或中性分子。
三、配位化合物的分类 (Classification )1. Classical complexes :配体提供孤电子对,占有中心体的空轨道而形成的配合物。
例如:Ag(NH 3)2 , Cu(CN) 42. n -complexes :配体提供n电子,占有中心体的空轨道而形成的配合物。
例如:Fe(C5H5)2, K[PtCl 3(C2H4)](第一个n配合物,Zeise's salt)出匚CH2 IMM配体提供:2个n电子4个n电子6个n电子四、配位体(L) Ligand1.根据配体中配位原子的不同,配体可分类成:(1) 单基(齿)配体(unidentate ligand ):配体中只含有一个配位原子;例如:NH3、H2。
、X「、(py)N(2) 多基(齿)配体(multidentate ligand ):配体中含有两个或两个以上的配位原子。
由单齿配体组成的配合物,称为简单配合物;由多齿配体组成的配合物,称为螯合物(chelate)。
2 .一些常见的配体:(1) 单基配体:X : F (fluoro)、Cl (chloro)、Br (bromo)、I (iodo)、H2O (aquo)、CO (carbonyl)、NO (nitrosyl)、C5H5N (py)、OH (hydroxo)(2) 双基配体:en (乙二胺)H2NCH2CH2NH2 (ethylenediamine)(oxalate ion^N Ci giy C (氨基乙酸根)O(2,2 -d ipyridyl )(3) 多基配体:EDTA (乙二胺四乙酸)(六齿) (H4Y)HOOCH2C CH2COOHNCH 2CH2N、(ethyle nediami netetracetato)HOOCH2C CH2COOH五、配位数(Coordination Number1.中心原子(或离子)所接受的配位原子的数目,称为配位数2 .若单基配体,则配位数=配体数;若多基配体,则配位数=配体数配位原子数/每个配体3 .确定配位数的经验规则一EAN规则(Effective atomic number rule )或十八电子(九轨道)规则(1) 含义:a. EAN规则:中心体的电子数加上配体提供给中心体的电子数等于某一稀有气体的电子构型( 36, 54,86)+配体提供的电子数=18, (n 1)d10nEnp6b.十八电子规则:中心体的价电子数c .九轨道规则:五个 (n 1)d 轨道(或者五个nd 轨道),1个ns 轨道和3个np 轨道(9个价轨道)都充满电子。


第四节配合物与超分子课程目标1.了解配位键的特点及配合物理论,能说明简单配合物的成键情况。
2.了解几种常见的配离子的性质。
3.了解超分子特点和应用图说考点基础知识[新知预习]一、配合物理论简介1.实验探究配合物实验操作实验现象有关离子方程式滴加氨水后,试管中首先出现________,氨水过量后沉淀逐渐________,得到深蓝色透明溶液,此时若滴加乙醇,析出__________Cu2++2NH3·H2O===Cu (OH)2↓+2NH错误!Cu(OH)2+4NH3===[Cu(NH3)4]2++2OH-[Cu(NH3)4]2++SO2-,4+H2O错误![Cu(NH3)4]SO4·H2O↓溶液颜色变为________Fe3++3SCN-===Fe(SCN)32。
配位键(1)概念:____________由一个原子单方面提供跟另一个原子共用的共价键,即“__________________",是一类特殊的共价键。
(2)形成条件:电子对给予体具有__________,而接受体有__________。
(3)表示配位键可以用A→B表示,其中A是________孤电子对的原子,B是________孤电子对的原子。
例如[Cu(NH3)4]2+可表示为________________________。
3.配位化合物通常把________(或原子)与某些分子或离子(称为________)以________结合形成的化合物称为________________。
二、超分子1.定义超分子是由两种或两种以上的分子通过________形成的分子聚集体。
2.应用(1)分离C60和C70:将C60和C70的混合物加入一种超分子“杯酚"中,能够将体积较小的________装下。
(2)冠醚识别碱金属离子:根据教材P99表3-6可知:18。
冠-6超分子可识别的碱金属离子是________。
[即时性自测]1.判断正误(正确的打“√”,错误的打“×”)(1)形成配位键的条件是一方有空轨道,另一方有孤电子对.()(2)配位键是一种特殊的共价键。


《2021-2022学年高二化学同步精品学案(新人教版选择性必修2)》第三章 晶体结构与性质 第四节 配合物与超分子【复习引入】已知AlCl 3和双聚氯化铝(Al 2Cl 6)的结构式如下: Cl —Al |Cl—Cl Cl Cl \/Al /\Cl Cl \/Al /\Cl Cl(1)AlCl 3中Al 原子的杂化方式 sp 2 ,Al 2Cl 6中Al 原子的杂化方式 sp 3 。
(2)双聚氯化铝(Al 2Cl 6)分子中有一种特殊的共价键,你能说明它形成的原因吗? (3)在NH 4+中也存在类似的共价键,用电子式表示NH 3 + H + =NH 4+的形成过程H ··N ··H····H +H +→[H ··N ··H··H··H]+。
一、配合物 1.配位键(1)概念:由一个原子单方面提供孤电子对,而另一个原子提供空轨道而形成的化学键,即““电子对给予—接受””键。
(2)特点:①配位键是一种特殊的共价键(其本质也是σ键);配位键同样具有共价键的饱和性和方向性;②以NH 4+的形成过程为例,尽管配位键与其它三条共价键不同,但形成NH 4+后,这四个共价键的键长、键角、键能完全相同,表现的化学性质也完全相同,所以NH 4+空间构型为正四面体,NH 4+的结构式也可表示:⎣⎢⎡⎦⎥⎤H —N |H|H —H +。
2.配合物【实验3-2】【深度思考】①实验证明,上述实验中呈蓝色的物质是水合铜离子,可表示为[Cu(H 2O)4]2+,叫做四水合铜离子。
②结合化学键的相关知识,分析Cu 2+与H 2O 是如何结合的呢?③根据该离子的球棍模型,写出对应的结构简式⎣⎢⎡⎦⎥⎤H 2O —Cu |H 2O |H 2O—OH 22+。
(1)配合物的定义:通常把金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以配位键结合形成的化合物称为配位化合物,简称配合物。
配位场理论ligand field theory说明和解释配位化合物的结构和性能重要的理论有价键理论、晶体场理论、分子轨道理论和配位场理论。
配位化合物的价键理论根据配位化合物的性质,按杂化轨道理论用共价配键和电价配键解释配位化合物中金属离子和配位体间的结合力。
例如呈现反磁性,是由于中心离子有未充满的d轨道和s,p空轨道,这些空轨道通过杂化组成杂化轨道,由配位体提供孤对电子;配位体L与中心离子M之间形成L→M的σ键。
是顺磁性的。
中心离子的未成对电子数目和自由离子一样,认为金属离子和配位体以静电吸引力结合在一起。
价键理论简明地解释配位化合物的几何构型和配位化合物的磁性等性质。
价键理论没有提到反键轨道,不能满意解释配位化合物的光谱数据。
晶体场理论是静电作用模型。
把中心离子(M)和配位体(L)的相互作用看作类似离子晶体中正负离子的静电作用。
当L接近M时,M中的d轨道受到L负电荷的静电微扰作用,使原来能级简并的d轨道发生分裂。
按微扰理论可计算分裂能的大小,因计算较繁,定性地将配位体看作按一定对称性排布的点电荷与M的d轨道电子云产生排斥作用。
由于d轨道分布的特点,在配位场中原来5个能级简并的d轨道能级发生分裂,引起电子排布及其他一系列性质的变化,比如电子将重新分布,体系能量会降低,据此解释配位化合物的各种性质。
例如八面体配位离子中,d轨道分裂成两组:低能级的dxy,dxz,dyz,它们三者的能量相等,称为t2g(2g为下标)轨道,此二者的能量相等;高能级的dx2-y2d,dz2,称为eg(g为下标)轨道。
这两组能级间差值称为晶体场分裂能Δ ,配体场强越大,分裂能值越大。
d电子根据Δ和成对能(P)相对大小填在这两组轨道上,形成强场低自旋和弱场高自旋结构。
在不同构型的配合物中,中心离子d轨道能级分裂情况不同。
以此成功地解释了配位化合物的结构、光谱、稳定性及磁性等一系列性质。
配位化合物的分子轨道理论是用分子轨道理论的观点和方法处理金属离子和配位体成键作用。
第三章配合物结构主要内容:1.配合物价键理论的基本要点、配合物的几何构型与中心离子杂化轨道的关系。
2.内轨型、外轨型配合物的概念;中心离子价电子排布与配离子稳定性、磁性的关系。
3.配合物晶体场理论的基本要点;高自旋、低自旋配合物等;推测配合物的稳定性、磁性。
4.配合物的颜色与 d-d 跃迁的关系。
配合物的组成配合物:是由中心离子(或原子)与一定数目的阴离子或中性分子形成具有一定的空间构型和稳定性的复杂化合物。
例如: [Ag(NH3)2]OH, [Cu(NH3)4]SO4,Ni(CO)41.中心离子(或原子)中心离子(或原子)也称为形成体,具有空的价电子轨道,通常是金属离子和原子,也有少数是非金属元素。
例如:Cu2+,Ag+,Fe3+,Fe,Ni,BⅢ,PⅤ……配位体简称配体,通常是非金属的阴离子或分子,例如:F-,Cl-,Br-,I-,OH-,CN-,H2O,NH3,CO……2.配位体和配位原子单齿配体:配体中只有一个配位原子。
多齿配体:具有两个或多个配位原子的配体。
例如:乙二胺(en ) 2 2 2 2H N CH CH N H ∙∙∙∙乙二酸根(草酸根) -242O C 乙二胺四乙酸根 EDTA (Y 4-)配位原子:与形成体成键的原子。
配位数:配位原子数单齿配体:形成体的配位数等于配体的数目;多齿配体:形成体的配位数等于配体的数目与基数的乘积。
3. 中心离子(或原子)的配位数[] Cu(en)22+Cu 2+的配位数等于4。
例如:CH N H NH C H CuCH N H NH C H 2222222 22+Ca2+的配位数为6,配位原子分别是4个O,2个N。
从溶液中析出配合物时,配离子常与带有相反电荷的其他离子结合成盐,这类盐称为配盐。
配盐的组成可以划分为内层和外层。
配离子属于内层,配离子以外的其他离子属于外层。
外层离子所带电荷总数等于配离子的电荷数。
配合物的化学式和命名配酸:×××酸配碱:氢氧化×××配盐:先阴离子后阳离子,简单酸根加“化”字,复杂酸根加“酸”字。
[fe(phen)3](clo4)2的晶体结构
铁三聚氰胺氯酸盐(Fe(phen)3(ClO4)2)是一种重要的有机配合物,它具有独
特的晶体结构。
它的晶体结构由一个铁原子和三个聚氰胺分子组成,这三个聚氰胺分子分别与铁原子形成六面体结构,而铁原子则与六个氯酸根离子形成八面体结构。
这种晶体结构使得铁三聚氰胺氯酸盐具有良好的稳定性,并且具有良好的电磁性能。
铁三聚氰胺氯酸盐的晶体结构也具有许多有趣的特性。
首先,它的晶体结构具
有良好的热稳定性,可以在高温下稳定存在。
其次,它的晶体结构具有良好的电磁性能,可以用于制造电子元件。
此外,它的晶体结构还具有良好的光学性能,可以用于制造光学元件。
铁三聚氰胺氯酸盐的晶体结构也可以用于制造药物。
它的晶体结构具有良好的
抗菌性,可以有效抑制细菌的生长,从而有效治疗细菌感染。
此外,它的晶体结构还具有良好的抗炎性,可以有效抑制炎症反应,从而有效治疗炎症性疾病。
总之,铁三聚氰胺氯酸盐的晶体结构具有许多有趣的特性,可以用于制造电子
元件、光学元件和药物。
它的晶体结构具有良好的热稳定性、电磁性能、光学性能和抗菌性,可以有效抑制细菌的生长和抑制炎症反应,从而有效治疗细菌感染和炎症性疾病。