磁珠纯化DNA的原理
- 格式:pdf
- 大小:408.63 KB
- 文档页数:7

磁珠法分离纯化DNA原理及其步骤日期:2012-05-22 来源:互联网标签:核酸纯化核酸分离磁珠法纯化DNA摘要: 磁珠法纯化DNA主要是利用利息交换吸附材料吸附核酸,从而将核酸和蛋白质等其细胞中其他物质分离。
本文主要概述了磁珠法纯化DNA原理、核酸分离与纯化的原则、核酸分离与纯化的步骤。
欢度大力神杯之夏,参与BRAND竞猜活动,获赠BRAND产品!GeneCopoeia:qPCR mix免费试用体验活动开始!磁珠法纯化DNA主要是利用利息交换吸附材料吸附核酸,从而将核酸和蛋白质等其细胞中其他物质分离。
本文主要概述了磁珠法纯化DNA原理、核酸分离与纯化的原则、核酸分离与纯化的步骤。
磁珠法纯化DNA原理磁珠法核酸纯化技术采用了纳米级磁珠微珠,这种磁珠微珠的表面标记了一种官能团,能同核酸发生吸附反应。
硅磁(Magnetic Silica Particle)就是指磁珠微珠表面包裹一层硅材料,来吸附核酸,其纯化原理类型于玻璃奶的纯化方式。
离心磁珠是指磁珠微珠表面包裹了一层可发生离心交换的材料(如DEAE,COOH)等,从而达到吸附核酸目的。
不同性质的磁珠微珠所对应的纯化原理是不一致。
使用磁珠法来纯化核酸的最大优点就是自动化。
磁珠在磁场条件下可以发生聚集或分散,从而可彻底摆脱离心等所需的手工操作流程。
Omega拥有全面的磁珠法核酸分离试剂盒,基于这种技术的试剂盒,名称前都有’Mag-Bind’。
核酸分离与纯化的原则核酸在细胞中总是与各种蛋白质结合在一起的。
核酸的分离主要是指将核酸与蛋白质、多糖、脂肪等生物大分子物质分开。
在分离核酸时应遵循以下原则:保证核酸分子一级结构的完整性:排除其他分子污染。
核酸分离与纯化的步骤大多数核酸分离与纯化的方法一般都包括了细胞裂解、酶处理、核酸与其他生物大分子物质分离、核酸纯化等几个主要步骤。
每一步骤又可由多种不同的方法单独或联合实现。
1. 细胞裂解:核酸必须从细胞或其他生物物质中释放出来。

磁珠法纯化D N A原理磁珠法核酸纯化技术采用了纳米级磁珠微珠,这种磁珠微珠的表面标记了一种官能团,能同核酸发生吸附反应。
硅磁(Magnetic Silica Particle)就是指磁珠微珠表面包裹一层硅材料,来吸附核酸,其纯化原理类型于玻璃奶的纯化方式AMPure bead :NaCl,7% PEG8000标准的AMPure xp是用来筛选掉100bp的DNA片段,通过改变PEG8000的含量可改变至(MAX 300bp,MIN 50bp),PEG8000的浓度越高越能筛选出片段小的DNA Streptavidin magnetic bead (链霉亲和素磁珠):Streptavidin(SA)链霉亲和素,magnetic磁性的,亲和素能与生物素之间存在强度最高的非共价作用(称作BAS系统)二者结合形成复合物的解离常数很小,呈不可逆反应性;而且酸、碱、变性剂、蛋白溶解酶以及有机溶剂均不影响其结合。
玻璃奶:是一种白色硅颗粒,能到50kb大小的DNA(双链,单链,线状,超螺旋),结合原理:在高盐状态下,玻璃奶周围的负电荷被打破,并允许DNA磷酸负电荷与玻璃奶特异性结合,在低盐时(H20或1X TE)溶解分离DNA<100bp时,高盐状态下结合率高;DNA>100bp时,低盐状态下结合率高;pH<时,结合率高。
氧化硅羟基磁珠:此种微球具有核壳结构,即超顺磁性核心以及无机氧化硅外壳,硅烷醇集团(羟基)在chaotropic(盐酸胍、异硫酸氰胍等)存在条件下,能够与溶液中的核酸通过疏水作用、氢键作用和静电作用等发生特异性结合,而不与蛋白质和其它杂质结合氧化硅羧基磁珠:该磁珠表面修饰有羧基官能团,能够在特殊试剂(如EDC)作用下将蛋白、寡聚核苷酸等生物配体共价偶联到磁珠表面,可应用在蛋白纯化,核酸纯化,亲和层析等领域。

磁珠法提取dna原理
磁珠法提取DNA原理是利用磁性珠子及其表面修饰的特定分子与DNA之间的亲和性来实现DNA的富集和分离。
具体原理如下:
1. 磁性珠子的选择:选择具有一定磁性的微米级珠子作为DNA富集的固相载体。
这些磁性珠子通常由磁性材料(如Fe3O4)制成,可以通过磁力来进行分离和收集。
2. 磁性珠子表面修饰:在磁性珠子表面修饰特定的分子,通常是寡核苷酸(如单链DNA、RNA或寡聚核苷酸)或核酸结合蛋白,使其具有与目标DNA相互作用的能力。
修饰的分子上还可以加入亲和标记物(如亲和素或抗体),以便进一步增强富集效果。
3. DNA结合:将修饰后的磁性珠子与DNA样品混合,通过与DNA靶标相互作用,使目标DNA与磁性珠子表面的修饰分子结合,并形成稳定的DNA-珠子复合物。
4. 分离和富集:在结合后,应用外加的磁场或磁力来分离磁性珠子及其结合的DNA-珠子复合物。
由于磁性珠子的磁性,可以迅速将其吸附到反应容器的侧壁上,然后将上清液排除,实现DNA的富集和纯化。
5. 磁珠洗脱:在磁性珠子上吸附的DNA可以通过改变离心管内磁场或洗涤条件来洗脱,得到纯化的DNA产物,然后可以进一步进行下游分析,如PCR扩增、测序等。
总之,磁珠法通过磁性珠子的特性以及表面修饰分子与DNA之间的亲和性,实现了对DNA的高效富集和纯化,成为DNA提取和纯化领域中常用的方法。

dna提取磁珠法
DNA提取磁珠法是一种高效、快速、简便的DNA提取方法。
该方法
利用磁珠表面的亲和性分子与DNA的亲和性结合,将DNA分离出来。
该方法具有操作简单、提取效率高、纯度高等优点,被广泛应用于生
物学、医学、农业等领域。
DNA提取磁珠法的原理是利用磁珠表面的亲和性分子与DNA的亲和
性结合,将DNA分离出来。
首先,将样品加入到含有磁珠的混悬液中,磁珠表面的亲和性分子与DNA结合,形成磁珠-DNA复合物。
然后,利用磁力将磁珠-DNA复合物沉淀到底部,将上清液倒掉。
最后,用
缓冲液洗涤磁珠-DNA复合物,将DNA从磁珠上解离出来。
DNA提取磁珠法具有以下优点:
1. 操作简单:该方法只需要几个简单的步骤,不需要复杂的设备和技术,因此操作简单。
2. 提取效率高:该方法可以高效地提取DNA,提取率可以达到90%
以上。
3. 纯度高:该方法可以提取高质量的DNA,纯度可以达到1.8以上。
4. 适用范围广:该方法适用于多种样品类型,包括血液、组织、细胞等。
DNA提取磁珠法在生物学、医学、农业等领域有广泛的应用。
在生物学领域,该方法可以用于基因克隆、基因测序、基因表达分析等。
在医学领域,该方法可以用于疾病诊断、药物研发等。
在农业领域,该方法可以用于植物基因组学研究、动物育种等。
总之,DNA提取磁珠法是一种高效、快速、简便的DNA提取方法,具有操作简单、提取效率高、纯度高等优点,被广泛应用于生物学、医学、农业等领域。

磁珠法核酸纯化技术采用了纳米级磁珠微珠,这种磁珠微珠的表面标记了一种官能团,能同核酸发生吸附反应。
硅磁(Magnetic Silica Particle)就是指磁珠微珠表面包裹一层硅材料,来吸附核酸,其纯化原理类型于玻璃奶的纯化方式。
离心磁珠是指磁珠微珠表面包裹了一层可发生离心交换的材料(如DEAE,COOH)等,从而达到吸附核酸目的。
不同性质的磁珠微珠所对应的纯化原理是不一致。
使用磁珠法来纯化核酸的最大优点就是自动化。
磁珠在磁场条件下可以发生聚集或分散,从而可彻底摆脱离心等所需的手工操作流程。
Omega拥有全面的磁珠法核酸分离试剂盒,基于这种技术的试剂盒,名称前都有’Mag-Bind’。
核酸分离与纯化的原则核酸在细胞中总是与各种蛋白质结合在一起的。
核酸的分离主要是指将核酸与蛋白质、多糖、脂肪等生物大分子物质分开。
在分离核酸时应遵循以下原则:保证核酸分子一级结构的完整性;排除其他分子污染。
核酸分离与纯化的步骤大多数核酸分离与纯化的方法一般都包括了细胞裂解、酶处理、核酸与其他生物大分子物质分离、核酸纯化等几个主要步骤。
每一步骤又可由多种不同的方法单独或联合实现。
1. 细胞裂解:核酸必须从细胞或其他生物物质中释放出来。
细胞裂解可通过机械作用、化学作用、酶作用等方法实现。
(1) 机械作用:包括低渗裂解、超声裂解、微波裂解、冻融裂解和颗粒破碎等物理裂解方法。
这些方法用机械力使细胞破碎,但机械力也可引起核酸链的断裂,因而不适用于高分子量长链核酸的分离。
有报道超声裂解法提取的核酸片段长度从< 500bp ~> 20kb 之间,而颗粒匀浆法提取的核酸一般< 10kb。
(2) 化学作用:在一定的p H 环境和变性条件下,细胞破裂,蛋白质变性沉淀,核酸被释放到水相。
上述变性条件可通过加热、加入表面活性剂(SDS、Triton X-100 、Tween 20 、NP-40 、CTAB、sar-cosyl 、Chelex-100 等) 或强离子剂(异硫氰酸胍、盐酸胍、肌酸胍) 而获得。

dna分离纯化方法及原理
1. 酚-氯仿抽提法:这是一种传统的 DNA 提取方法。
原理是利用酚和氯仿的混合物来溶解细胞膜和蛋白质,使 DNA 与其他细胞成分分离开来。
然后通过离心和有机溶剂的萃取,将 DNA 从混合物中提取出来。
2. 硅胶柱层析法:该方法基于 DNA 与硅胶柱子之间的吸附和解吸作用。
将待提取的样本加载到硅胶柱上,通过柱子的吸附作用,使 DNA 与其他杂质分离开来。
然后用适当的洗脱缓冲液将 DNA 从柱子上洗脱下来。
3. 磁珠法:这是一种利用磁性颗粒结合 DNA 的方法。
将磁珠与样本混合,使 DNA 与磁珠结合。
通过外部磁场的作用,可以将磁珠与结合的 DNA 分离开来,从而实现 DNA 的纯化。
4. 质粒抽提法:这种方法适用于提取质粒 DNA。
通过碱处理破坏细菌细胞壁和细胞膜,使质粒 DNA 从细菌细胞中释放出来。
然后通过离心和沉淀等步骤,将质粒 DNA 与其他杂质分离开来。
5. 超声波法:利用超声波的能量,将细胞破碎,使 DNA 释放到溶液中。
然后通过离心和沉淀等步骤,将 DNA 与其他杂质分离开来。
这些方法的原理基于不同的物理、化学或生物学原理,旨在从复杂的生物样本中选择性地分离和纯化 DNA。
选择合适的方法取决于样本类型、纯度要求和实验目的等因素。
在 DNA 分离纯化过程中,还需要注意操作规范、防止污染,并进行质量控制和检测,以确保获得高质量的 DNA 用于后续的分析和实验。

dna纯化方法
DNA纯化方法
DNA纯化是分子生物学中的一个重要步骤,它是从混合物中分离出DNA分子的过程。
DNA纯化方法有很多种,其中常用的方法包括酚/氯仿法、离心柱法、磁珠法等。
酚/氯仿法是最常用的DNA纯化方法之一。
它的原理是利用酚和氯仿的密度差异,将DNA分子从其他杂质中分离出来。
具体操作步骤如下:首先将细胞裂解,使DNA分子释放到溶液中;然后加入等体积的酚/氯仿混合液,混合均匀后离心分层;最后将上层的DNA溶液取出,加入等体积的异丙醇,沉淀DNA分子。
离心柱法是一种快速、简便的DNA纯化方法。
它利用离心柱的特殊结构,将DNA分子从其他杂质中分离出来。
具体操作步骤如下:首先将细胞裂解,使DNA分子释放到溶液中;然后将DNA溶液加入离心柱中,离心分离DNA分子和其他杂质;最后将离心柱中的DNA分子洗涤、洗脱,得到纯净的DNA分子。
磁珠法是一种高效、自动化的DNA纯化方法。
它利用磁珠表面的亲和分子与DNA分子的特异性结合,将DNA分子从其他杂质中分离出来。
具体操作步骤如下:首先将细胞裂解,使DNA分子释放到溶液中;然后加入磁珠,使其与DNA分子结合;最后利用磁力将磁珠与DNA分子分离,得到纯净的DNA分子。
DNA纯化方法有很多种,每种方法都有其优缺点。
在选择纯化方法时,需要根据实验的具体要求和样品的特点进行选择。

磁珠纯化原理TTA standardization office【TTA 5AB- TTAK 08- TTA 2C】磁珠法纯化D N A原理磁珠法核酸纯化技术采用了纳米级磁珠微珠,这种磁珠微珠的表面标记了一种官能团,能同核酸发生吸附反应。
硅磁(Magnetic Silica Particle)就是指磁珠微珠表面包裹一层硅材料,来吸附核酸,其纯化原理类型于玻璃奶的纯化方式AMPure bead : NaCl,7% PEG8000标准的AMPure xp是用来筛选掉100bp的DNA片段,通过改变PEG8000的含量可改变至(MAX 300bp,MIN 50bp),PEG8000的浓度越高越能筛选出片段小的DNA Streptavidin magnetic bead (链霉亲和素磁珠):Streptavidin(SA)链霉亲和素,magnetic磁性的,亲和素能与生物素之间存在强度最高的非共价作用(称作BAS系统)二者结合形成复合物的解离常数很小,呈不可逆反应性;而且酸、碱、变性剂、蛋白溶解酶以及有机溶剂均不影响其结合。
玻璃奶:是一种白色硅颗粒,能到50kb大小的DNA(双链,单链,线状,超螺旋),结合原理:在高盐状态下,玻璃奶周围的负电荷被打破,并允许DNA磷酸负电荷与玻璃奶特异性结合,在低盐时(H20或1X TE)溶解分离DNA<100bp时,高盐状态下结合率高;DNA>100bp时,低盐状态下结合率高;pH<时,结合率高。
氧化硅羟基磁珠:此种微球具有核壳结构,即超顺磁性核心以及无机氧化硅外壳,硅烷醇集团(羟基)在chaotropic(盐酸胍、异硫酸氰胍等)存在条件下,能够与溶液中的核酸通过疏水作用、氢键作用和静电作用等发生特异性结合,而不与蛋白质和其它杂质结合氧化硅羧基磁珠:该磁珠表面修饰有羧基官能团,能够在特殊试剂(如EDC)作用下将蛋白、寡聚核苷酸等生物配体共价偶联到磁珠表面,可应用在蛋白纯化,核酸纯化,亲和层析等领域。
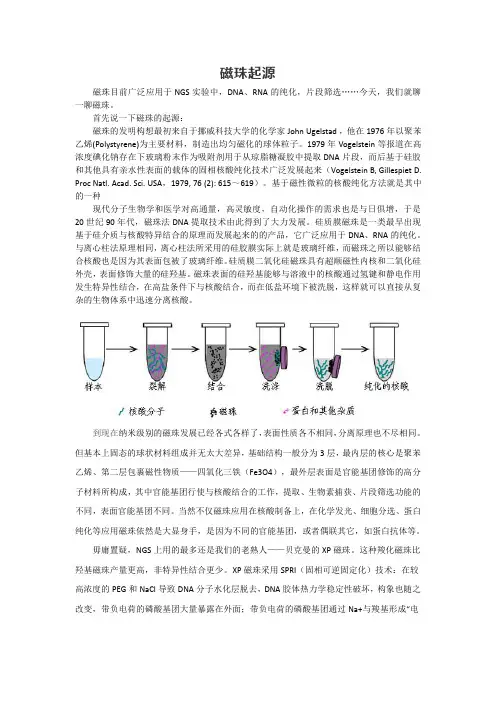
磁珠起源磁珠目前广泛应用于NGS实验中,DNA、RNA的纯化,片段筛选……今天,我们就聊一聊磁珠。
首先说一下磁珠的起源:磁珠的发明构想最初来自于挪威科技大学的化学家John Ugelstad,他在1976年以聚苯乙烯(Polystyrene)为主要材料,制造出均匀磁化的球体粒子。
1979年Vogelstein等报道在高浓度碘化钠存在下玻璃粉末作为吸附剂用于从琼脂糖凝胶中提取DNA片段,而后基于硅胶和其他具有亲水性表面的载体的固相核酸纯化技术广泛发展起来(Vogelstein B,Gillespiet D. Proc A,1979,76(2):615~619)。
基于磁性微粒的核酸纯化方法就是其中的一种现代分子生物学和医学对高通量,高灵敏度,自动化操作的需求也是与日俱增,于是20世纪90年代,磁珠法DNA提取技术由此得到了大力发展。
硅质膜磁珠是一类最早出现基于硅介质与核酸特异结合的原理而发展起来的的产品,它广泛应用于DNA、RNA的纯化。
与离心柱法原理相同,离心柱法所采用的硅胶膜实际上就是玻璃纤维,而磁珠之所以能够结合核酸也是因为其表面包被了玻璃纤维。
硅质膜二氧化硅磁珠具有超顺磁性内核和二氧化硅外壳,表面修饰大量的硅羟基。
磁珠表面的硅羟基能够与溶液中的核酸通过氢键和静电作用发生特异性结合,在高盐条件下与核酸结合,而在低盐环境下被洗脱,这样就可以直接从复杂的生物体系中迅速分离核酸。
到现在纳米级别的磁珠发展已经各式各样了,表面性质各不相同,分离原理也不尽相同。
但基本上固态的球状材料组成并无太大差异,基础结构一般分为3层,最内层的核心是聚苯乙烯、第二层包裹磁性物质——四氧化三铁(Fe3O4),最外层表面是官能基团修饰的高分子材料所构成,其中官能基团行使与核酸结合的工作,提取、生物素捕获、片段筛选功能的不同,表面官能基团不同。
当然不仅磁珠应用在核酸制备上,在化学发光、细胞分选、蛋白纯化等应用磁珠依然是大显身手,是因为不同的官能基团,或者偶联其它,如蛋白抗体等。

xp磁珠纯化dna原理
XP磁珠纯化DNA是一种利用磁性珠子对DNA进行纯化的技术。
这项技术依赖于磁珠表面的化学修饰,使其能够选择性地结合DNA分子,然后利用磁场来分离目标DNA并去除杂质。
以下是XP磁珠纯化DNA的基本原理:
1.磁珠表面的功能化
•表面修饰:XP磁珠经过特定的化学修饰,表面附有特定的配体或功能基团。
这些配体能够与DNA序列上的特定区域( 如末端、亲和基序列等)选择性结合。
2.DNA结合与分离
•DNA结合:经过修饰的XP磁珠在适当的条件下与DNA结合,形成DNA-磁珠复合物。
•磁场分离:应用外部磁场,XP磁珠对DNA产生磁性吸引力,使DNA-磁珠复合物沉积到底部。
同时,去除非目标分子和杂质。
3.洗脱与纯化
•洗脱DNA:在磁场作用下,从DNA-磁珠复合物中洗脱目标DNA。
洗脱过程中,一些离子、缓冲液等也可能用来调控DNA的洗脱条件。
•纯化DNA:经过洗脱后,可以得到纯化的目标DNA,而其他杂质则留在磁珠上或在洗脱液中。
4.应用和优势
•高效:XP磁珠纯化DNA具有高效、快速、可靠的特点,适用于多种规模的DNA纯化。
•选择性:由于磁珠表面功能化的选择性,可实现对特定DNA片段的选择性捕获和纯化。
•自动化:可以与自动化系统结合,提高样品处理的吞吐量和一致性。
XP磁珠纯化DNA是一种常用的DNA分离和纯化技术,在分子生物学、基因组学、医学诊断等领域有着广泛的应用。
其快速高效的特点使其成为研究实验室和生物技术应用中常用的工具。

链霉亲和素磁珠原理
链霉亲和素磁珠原理是一种基于链霉亲和素和磁性珠子的结合反应原理。
链霉亲和素是一种特异性结合DNA的蛋白质,它可以与DNA序列特异性地相互作用,从而实现DNA的捕获和富集。
磁性珠子则是一种具有磁性的微珠,通过外加磁场可以实现对其运动的控制。
在链霉亲和素磁珠的原理中,首先将链霉亲和素分子固定在磁性珠子的表面。
然后将含有目标DNA的样品与链霉亲和素磁珠混合,由于链霉亲和素和DNA之间的特异性相互作用,目标DNA会与链霉亲和素结合在一起。
接下来,通过外加磁场的作用,链霉亲和素磁珠可以被吸附在反应容器的壁上或磁性架上,而其他非特异性结合物质则会被洗脱掉。
这样就可以将目标DNA分离出来,实现其富集和纯化。
最后,通过改变环境条件,例如改变盐浓度或pH值,可以破坏链霉亲和素和DNA之间的结合,释放出目标DNA。
通过这种原理,可以快速、高效地富集和纯化目标DNA,为后续的分析和应用提供了基础。
需要注意的是,在文中不能再出现与标题相同的文字,这样以避免重复和冗余。
磁珠法原理磁珠法是一种基于磁性颗粒与目标物质的特异性相互作用而实现分离、富集和检测的方法。
它在生物医学领域中被广泛应用于DNA/RNA提取、蛋白质纯化、细胞分离和药物筛选等研究中。
磁珠法的原理可以简单概括为三个步骤:样品预处理、磁珠捕获和磁珠分离。
样品预处理是为了去除干扰物质和增强目标物质的特异性。
在DNA/RNA提取中,样品可能含有细胞碎片、蛋白质、酶、盐和有机物等杂质,这些杂质会干扰下一步的磁珠捕获。
因此,需要对样品进行预处理,包括细胞破碎、蛋白酶消化和溶液调节等步骤。
接下来,磁珠捕获是磁珠法的核心步骤。
磁珠是一种具有磁性的微小颗粒,通常由聚合物或金属氧化物制成。
磁珠表面常常修饰有特定的生物分子,如抗体、寡核苷酸或亲和标记。
在磁珠捕获过程中,样品中的目标物质与磁珠表面的生物分子发生特异性结合。
例如,在蛋白质纯化中,可以利用亲和标记修饰的磁珠与目标蛋白质的特异性结合来实现纯化。
而在DNA/RNA提取中,可以使用具有亲和标记的寡核苷酸磁珠与目标DNA/RNA的互补序列结合。
通过这种特异性结合,可以快速高效地将目标物质富集在磁珠上。
磁珠分离是将富集了目标物质的磁珠从样品中分离出来。
由于磁珠具有磁性,可以通过外加磁场将磁珠从样品中分离出来,而不需要离心等传统的分离方法。
磁珠分离的优势在于操作简便、快速高效,并且不需要复杂的设备。
总结起来,磁珠法利用磁珠与目标物质的特异性相互作用,实现了对目标物质的选择性富集和分离。
它具有操作简便、高灵敏度、高纯度和高通量等优点,在生物医学研究和临床诊断中得到了广泛应用。
磁珠法的原理和应用研究不断发展,相信将为人们带来更多的实验手段和分析技术。
1.DNA与磁珠作用原理分选磁珠的作用原理是基于一种固相载体可逆化固定(SPRI)的分离纯化方法.磁珠体系中一般包括:磁珠、DNA、聚乙二醇(PEG)、以及盐离子等,在一定浓度的PEG和盐离子环境中,DNA可吸附到羧基修饰的高分子磁珠概况(即固相载体),该过程是可逆的,在适当条件下,结合的DNA分子可以被洗脱回收.纳米级另外磁珠概况性质分歧,分离原理也不尽相同,但基本上固态的球状资料组成并没有太年夜不同,基础结构一般分为3层,最内层的核心是聚苯乙烯、第二层包裹磁性物质——四氧化三铁(Fe3O4),最外层概况是羧基(-COOH)修饰的高分子资料所构成,其中羧基行使与核酸结合的工作.在整个体系中,PEG是影响DNA回收的决定性因素(其他因素还包括DNA年夜小和浓度、盐离子浓度、孵育时间等等).DNA在一定浓度的PEG存在条件下,NaCl或MgCl2增进条件下,使DNA发生脱水反应,分子构象会发生急剧变动,由线状被压缩形成卷曲球状,继而聚集沉淀,同时随PEG分子量、浓度以及盐浓度的分歧,分歧长度的DNA可以被选择性的沉淀出来.在磁珠体系中,特定分子量的PEG的功能主要是与盐离子共同作用,改变分歧长度DNA的分子构象,同时增加体系的粘稠水平,使磁珠存在其中处于悬浮状态,不容易沉降,增加磁珠在空间位置的碰撞与排斥,从而增加核酸与磁珠的聚集效率与效果,除此之外,PEG与卵白质具有相容性,也可去除样品中的卵白质.当处于PEG和盐离子环境中的DNA,因脱水作用而发生分子构象改变后,会流露出磷酸骨架上年夜量的带负电荷的磷酸基团,与概况带负电荷的羧基磁珠结合,但如何解释负负电荷之间的作用,目前还不得而知.但普遍认为,这是由于带正电荷的盐离子的作用(如Na+).带负电的磷酸基团借由解离的盐离子(如Na+)与羧基形成离子桥,使DNA被特异性吸附到羧基磁珠概况.当PEG和盐类被去除之后,加入水性分子,会快速充沛水化DNA,解除其三者之间的离子相互作用,使得吸附到磁珠的DNA被纯化出来.磁珠的呈现,使得核酸制备的实验可以实现自动化,同时相较于传统的回收方式,还具有3个明显的优势:1)效率更高,以DNA为例,1μL磁珠的承载量可达7μg;2)防止使用有机溶剂,如酚类、氯仿等等,更加平安;3)把持简单,无需离心,也更有利于保管核酸的完整性.2.卵白酶K的作用卵白酶K具有降解卵白的功能,而细胞膜主要是由卵白质构成的富有弹性的半透性膜,因此卵白酶K能够裂解细胞,从而DNA能够释放出来.3. 无水乙醇沉淀DNA用无水乙醇沉淀DNA,这是实验中最经常使用的沉淀DNA的方法.乙醇的优点是可以任意比和水相混溶,乙醇与核酸不会起任何化学反应,对DNA很平安,因此是理想的沉淀剂.当加入乙醇时,乙醇会夺去DNA周围的水分子,使DNA失水而易于聚合.4.TE缓冲液溶解DNA采纳Tris-HCl(pKa=8.0)的缓冲系统,由于缓冲液是TrisH+/Tris,不存在金属离子的干扰作用,故在提取或保管DNA时,年夜都采纳Tris-HCl系统,而且TE缓冲液中的EDTA更能稳定DNA的活性. 5.为什么用酚与氯仿抽提DNA时,还要加少量的异戊酵?在抽提DNA时,为了混合均匀,必需剧烈振荡容器数次,这时在混合液内易发生气泡,气泡会阻止相互间的充沛作用.加入异戊醇能降低分子概况张力,所以能减少抽提过程中的泡沫发生.同时异戊醇有助于分相,使离心后的上层水相,中层变性卵白相以及下层有机溶剂相维持稳定.。
dna clean beads纯化原理
DNA clean beads是一种用于DNA纯化的磁珠,其纯化原理主要是利用磁性珠体与DNA分子之间的静电作用、亲水作用和
疏水作用等相互作用力来实现DNA的吸附和洗脱。
首先,DNA clean beads通常具有一层特定的表面涂层,例如
硅酸盐、硅胶或聚合物等,这些材料能够与DNA分子上的磷
酸基团、羟基或氨基等部分发生静电作用,从而吸附DNA分子。
在DNA分子与磁珠发生静电作用后,通过离心可以将DNA clean beads与其他杂质物质分离。
其次,DNA clean beads也具有亲水性表面,这使得DNA分子能够与水分子之间发生亲水作用,从而将DNA分子固定在磁
珠上。
在DNA分子与磁珠上形成稳定的水合层后,水溶液中
的非DNA杂质可以通过洗涤步骤将其去除。
最后,DNA clean beads表面也具有疏水性,这使得DNA分子在特定条件下与磁珠表面发生疏水作用,从而被固定在磁珠上。
疏水作用有助于去除水溶液中的亲水杂质,进一步提高纯化效果。
综上所述,DNA clean beads通过静电作用、亲水作用和疏水
作用等相互作用力,实现DNA分子的吸附和洗脱,从而实现DNA的纯化。
磁珠法纯化DNA原理磁珠法核酸纯化技术采用了纳米级磁珠微珠,这种磁珠微珠的表面标记了一种官能团,能同核酸发生吸附反应。
硅磁(Magnetic Silica Particle)就是指磁珠微珠表面包裹一层硅材料,来吸附核酸,其纯化原理类型于玻璃奶的纯化方式AMPure bead :1.2M NaCl,7% PEG8000标准的AMPure xp是用来筛选掉100bp的DNA片段,通过改变PEG8000的含量可改变至(MAX 300bp,MIN 50bp),PEG8000的浓度越高越能筛选出片段小的DNA Streptavidin magnetic bead (链霉亲和素磁珠):Streptavidin(SA)链霉亲和素,magnetic磁性的,亲和素能与生物素之间存在强度最高的非共价作用(称作BAS系统)二者结合形成复合物的解离常数很小,呈不可逆反应性;而且酸、碱、变性剂、蛋白溶解酶以及有机溶剂均不影响其结合。
玻璃奶:是一种白色硅颗粒,能0.2kb到50kb大小的DNA(双链,单链,线状,超螺旋),结合原理:在高盐状态下,玻璃奶周围的负电荷被打破,并允许DNA磷酸负电荷与玻璃奶特异性结合,在低盐时(H20或1X TE)溶解分离DNA<100bp时,高盐状态下结合率高;DNA>100bp时,低盐状态下结合率高;pH<7.0时,结合率高。
氧化硅羟基磁珠:此种微球具有核壳结构,即超顺磁性核心以及无机氧化硅外壳,硅烷醇集团(羟基)在chaotropic(盐酸胍、异硫酸氰胍等)存在条件下,能够与溶液中的核酸通过疏水作用、氢键作用和静电作用等发生特异性结合,而不与蛋白质和其它杂质结合氧化硅羧基磁珠:该磁珠表面修饰有羧基官能团,能够在特殊试剂(如EDC)作用下将蛋白、寡聚核苷酸等生物配体共价偶联到磁珠表面,可应用在蛋白纯化,核酸纯化,亲和层析等领域。
磁珠纯化原理磁珠纯化技术是一种利用磁性材料的特性来实现生物分离和纯化的方法。
它在生物医学领域中得到了广泛的应用,可以用于DNA、RNA、蛋白质等生物大分子的纯化和富集。
磁珠纯化原理是基于磁性颗粒在外加磁场的作用下对生物大分子的亲和性吸附和分离,其操作简便、效率高,成为生物分离技术中的重要手段。
首先,磁珠纯化原理的关键在于磁性颗粒的表面修饰。
磁性颗粒表面通常会修饰有特定的亲和基团,这些亲和基团可以与目标生物大分子具有特异性的结合,实现对目标分子的选择性捕获。
例如,对于DNA的纯化,可以选择修饰有亲和基团的磁性颗粒,使其能够与DNA特异性结合,而对于蛋白质的纯化,则可以选择具有与目标蛋白质特异结合能力的磁性颗粒。
其次,磁珠纯化原理的关键在于外加磁场的作用。
当磁性颗粒与目标生物大分子结合后,通过外加磁场的作用,可以实现磁性颗粒和非目标物质的分离。
在外加磁场的作用下,磁性颗粒会被吸引到磁场区域,而非目标物质则会被排斥到磁场外的区域,从而实现了目标分子的纯化和富集。
另外,磁珠纯化原理的关键在于洗脱步骤的设计。
在磁珠纯化过程中,为了获得高纯度的目标分子,通常需要进行洗脱步骤,将目标分子从磁性颗粒上解离并收集。
洗脱步骤的设计需要考虑到目标分子与磁性颗粒的结合强度,以及洗脱缓冲液的选择,以确保目标分子能够高效地从磁性颗粒上洗脱并得到高纯度的产物。
总的来说,磁珠纯化原理是基于磁性颗粒的表面修饰、外加磁场的作用和洗脱步骤的设计,实现对生物大分子的选择性捕获、分离和纯化。
这种技术不仅操作简便、效率高,而且可以实现对目标分子的高度富集和纯化,因此在生物医学领域中具有广泛的应用前景。
随着磁性材料和生物分离技术的不断发展,相信磁珠纯化技术将在生物医学领域中发挥越来越重要的作用。
dna纯化磁珠高温失效-概述说明以及解释1.引言DNA纯化磁珠是一种在分子生物学实验中常用的工具,它能够高效地富集和纯化目标DNA分子。
然而,在实验过程中,高温条件下可能会导致DNA纯化磁珠失效,影响实验结果的准确性和可靠性。
本文旨在探讨高温对DNA纯化磁珠的影响,分析其可能的失效原因,并提出改进方法与应对策略,以帮助实验室工作者更好地应对这一问题。
策略": {} }}}请编写文章1.1 概述部分的内容1.2 文章结构本文将分为三个主要部分,分别是引言、正文和结论。
在引言部分,我们将首先概述DNA纯化磁珠及其在实验室工作中的重要性,然后介绍本文的结构和目的,为读者提供一个整体的背景和框架。
接着在正文部分,我们将详细讨论DNA纯化磁珠的原理,探讨高温对其性能的影响,并分析可能导致高温失效的原因。
这部分将通过科学理论和实证研究来支撑论点,为读者提供深入的了解和分析。
最后在结论部分,我们将总结DNA纯化磁珠高温失效的影响,并提出可能的改进方法和应对策略。
此部分将为实验室工作者提供一些实用的建议和启示,帮助他们更好地应对类似问题。
通过以上结构的分析,我们将系统地探讨DNA纯化磁珠在高温环境下的性能问题,并为解决这一问题提供一些建议和思路,以期对实验室工作者和科研人员有所帮助。
1.3 目的本文的目的在于探讨DNA纯化磁珠在高温条件下的失效问题。
通过对DNA纯化磁珠的原理、高温对其影响以及可能的失效原因进行分析,我们希望能够深入了解DNA纯化磁珠在高温环境下的表现和特性。
同时,我们将总结其高温失效对实验室工作的影响,并提出可能的改进方法和应对策略,以提高实验室工作的效率和质量。
通过本文的研究,我们希望能为实验室科研工作者提供有价值的参考,帮助他们更好地应对DNA纯化磁珠在高温条件下可能出现的问题,保障实验室工作的顺利进行和科研成果的准确性与可靠性。
2.正文2.1 DNA纯化磁珠的原理DNA纯化磁珠是一种用于分离和纯化DNA分子的工具,它利用磁珠表面的功能化修饰分子与DNA分子之间的亲和力来实现DNA的快速分离和富集。
磁珠起源磁珠目前广泛应用于NGS实验中,DNA、RNA的纯化,片段筛选……今天,我们就聊一聊磁珠。
首先说一下磁珠的起源:磁珠的发明构想最初来自于挪威科技大学的化学家John Ugelstad,他在1976年以聚苯乙烯(Polystyrene)为主要材料,制造出均匀磁化的球体粒子。
1979年Vogelstein等报道在高浓度碘化钠存在下玻璃粉末作为吸附剂用于从琼脂糖凝胶中提取DNA片段,而后基于硅胶和其他具有亲水性表面的载体的固相核酸纯化技术广泛发展起来(Vogelstein B,Gillespiet D. Proc A,1979,76(2):615~619)。
基于磁性微粒的核酸纯化方法就是其中的一种现代分子生物学和医学对高通量,高灵敏度,自动化操作的需求也是与日俱增,于是20世纪90年代,磁珠法DNA提取技术由此得到了大力发展。
硅质膜磁珠是一类最早出现基于硅介质与核酸特异结合的原理而发展起来的的产品,它广泛应用于DNA、RNA的纯化。
与离心柱法原理相同,离心柱法所采用的硅胶膜实际上就是玻璃纤维,而磁珠之所以能够结合核酸也是因为其表面包被了玻璃纤维。
硅质膜二氧化硅磁珠具有超顺磁性内核和二氧化硅外壳,表面修饰大量的硅羟基。
磁珠表面的硅羟基能够与溶液中的核酸通过氢键和静电作用发生特异性结合,在高盐条件下与核酸结合,而在低盐环境下被洗脱,这样就可以直接从复杂的生物体系中迅速分离核酸。
到现在纳米级别的磁珠发展已经各式各样了,表面性质各不相同,分离原理也不尽相同。
但基本上固态的球状材料组成并无太大差异,基础结构一般分为3层,最内层的核心是聚苯乙烯、第二层包裹磁性物质——四氧化三铁(Fe3O4),最外层表面是官能基团修饰的高分子材料所构成,其中官能基团行使与核酸结合的工作,提取、生物素捕获、片段筛选功能的不同,表面官能基团不同。
当然不仅磁珠应用在核酸制备上,在化学发光、细胞分选、蛋白纯化等应用磁珠依然是大显身手,是因为不同的官能基团,或者偶联其它,如蛋白抗体等。
毋庸置疑,NGS上用的最多还是我们的老熟人——贝克曼的XP磁珠。
这种羧化磁珠比羟基磁珠产量更高,非特异性结合更少。
XP磁珠采用SPRI(固相可逆固定化)技术:在较高浓度的PEG和NaCl导致DNA分子水化层脱去,DNA胶体热力学稳定性破坏,构象也随之改变,带负电荷的磷酸基团大量暴露在外面;带负电荷的磷酸基团通过Na+与羧基形成“电桥”,使得DNA被特异吸附到带羧基的磁珠表面。
同时由于磁珠具有超顺磁性,可以通过外加磁场进行收集操作。
去上清后,磁珠可用酒精洗涤,最后用TE洗脱DNA。
SPRI成就了贝克曼尖端的磁珠纯化技术。
这项技术是由人类基因组计划主要负责人之一Trevor Hawkins博士(美国能源部的人类基因组计划的前任主任)领导发明,用于人类基因组计划的样品准备工作。
Trevor Hawkins博士也曾在西门子诊疗、皇家飞利浦电子公司和通用电气等企业担任高级主管人,在医疗保健领域工作了超过25年,他专注提升医疗技术与创新,贡献巨大,单说SPRI专利现在仍然是生命科学和诊断的磁珠应用领域中最重要的专利之一。
起初SPRI这个专利并不在贝克曼的手里,而是,在Agencourt公司手里。
为了实现在生物医学方面实现核酸提取的自动化和高通量,在2005年贝克曼与Agencourt达成协议,以1.5亿美金的金额成功收购Agencourt公司。
在实现了强强联合后,贝克曼在自动化核酸纯化领域至今一直引领,在NGS兴起后,XP磁珠被广泛用于文库构建工作中,而后贝克曼也推出专用的更为精准的片筛磁珠Agencourt SPRIselect。
顺便说一下,Agencourt公司是两个著名体系的开创者:Agencourt Bioscience的主营产品是用于生化医疗研究的核酸纯化产品。
Agencourt还有另一个重要部门则是APG,发开基于磁珠的大规模并行克隆连接DNA测序法,2006年它被贝克曼1.2亿美元转卖给了ABI。
贝克曼一直持有Agencourt品牌,2007年ABI依靠APG的技术也推出一款连接法的测序仪,是的,它就是号称二代测序碱基读取最准确的SOLiD系统。
当然说到XP,大家更好奇的是它片选筛选原理。
XP磁珠体系中包含:磁珠、聚乙二醇(PEG)、以及盐离子等,在一定浓度的PEG和盐离子环境中,DNA可吸附到羧基修饰的高分子磁珠表面(即固相载体),该过程是可逆的,在适当条件下,结合的DNA分子可以被洗脱回收。
构建过几次文库的,就很清楚自己要大多片段的文库,改用多少成XP去双选。
磁珠双选很大程度依赖于PEG。
PEG沉淀蛋白、沉淀DNA,DNA连接反应中低浓度PEG做为聚合剂,增强载体与目的片段碰撞的机会(很多公司的建库试剂盒接头连接后,如果要片段筛选,需要先纯化目的是去除PEG的影响。
为了提高连接效率,连接Buffer含有一定的PEG)。
这些都是分子生物学的经典实验,早已收录分子生物学的圣经——《分子克隆实验指南》。
PEG沉淀大分子是很久以前就发现,因为PEG能够通过吸涨作用,通过空间位置排斥效应,诱导水溶液的大分子聚合(MACROMOLECULAR CROWDING:Biochemical,Biophysical,and Physiological Consequences,1993)。
而Lis是最早利用PEG按DNA分子大小沉淀DNA的,早在1975年发有文章。
(Size fractionation of double-stranded DNA by precipitation with polyethylene glycol,Nucleic Acids Research,1975;Fractionation of DNA Fragments by Polyethylene Glycol Induced Precipitation,1980)Lis and Schleif,1975PEG作为一种分子拥挤试剂,达到一定的浓度时,夺取了一定的水,溶液环境变化,会使较大DNA的结构变紧凑,发生坍塌性的转变而凝聚。
不同长度的DNA构像稳定性不同,在遵循热力学规律的情况,这与溶液环境与分子拥挤试剂的浓度有很大的关系。
即在特定的溶液中,当PEG浓度达到某一临界值是,就会发现一定大小以上的DNA分子构象非连续的突变,发生凝聚(Collapse of single DNA molecule in poly(ethylene glycol)solutions,1995;DNA condensation,Current Opinion in Structural Biology,1996)。
当然其中细节远远没有想象中的简单,至今不能完全研究清楚,有一篇文章标题就是这样:Compatible solute influence on nucleic acids:Many questions but few answers。
做为磁珠Buffer配方,PEG还能保持溶液的粘度,使磁珠保持悬浮不易聚沉。
也不易造成蛋白变性和非特异性吸附。
当然PEG分离效果易受pH、温度等影响,温度低PEG也不易与水相完全互溶(所以磁珠使用前要平衡至室温)。
磁珠的选择随着测序成本超摩尔定律的下降,建库成本逐渐成为NGS推广的主要瓶颈之一,它的优化变得越来越重要。
就整个NGS建库试剂而言,磁珠使用广泛、需求量大,可以说重要性仅次于PCR酶。
XP磁珠无疑是其中的领导者,正是源于市场优势,XP磁珠不仅货期长、价格居高不下;而且包装规格也不灵活,不利于客户配合建库试剂盒合理采购。
因此不少厂商看到了机遇,想推出一款成本低廉、性能优异的磁珠替换XP磁珠。
但是不说,磁珠中层基质不同,磁珠的基本性质会有所不同;修饰的官能团不同,磁珠的吸附特性会有所不同。
即便是相同的封闭基质和官能团,基质的包被工艺不同,会造成基质厚度、孔容、孔径、比表面积不同,所能吸附的颗粒粒径偏好也会有所不同;即便是修饰相同的官能团,官能团修饰工艺不同,会造成官能团密度、臂长不同,所携带的表面电荷、斥力、氢键数量不同,吸附能力会随之改变。
其Buffer配方不同,效果也会有所不同,如Tween-20等润滑剂不同,也会影响磁珠的残留;还有就是不同分子量的PEG吸涨作用强弱不同;笔者亲测PEG8000和PEG3350效果差异巨大。
当然我们使用的时候难以看到以上说的那些,不过依然有简单的办法,评价它们。
放在磁力架上澄清时间,可以评估磁珠的磁响应时间;电镜下可以观察其粒径是否均一,差异明显的普通显微镜下就可以看出差异;震荡起泡多少,可以看出Buffer的不同。
目前市场磁珠种类繁多,从宣传效果上难以看出优劣,但实际纯化效果质量参差不齐,具有良好的片段筛选能力的磁珠更是较少。
不同磁珠片段筛选能力不同,也需要测试,不能照搬XP的条件。
顺便说一下,NEB的Marker有修饰,导致不同大小ladder都会被回收,不能用来测试片筛,Fermants和英俊的都可以用。
当然不同类型的磁珠会有不同的优势。
比如,有的磁珠磁响应性好但是沉降速度快,更适合磁棒式自动提取仪(KingFisher那种);有的磁珠沉降速度慢但是磁响应时间长,更适合移液式自动提取仪(移液工作站)。
磁珠的发展。
化学发光、蛋白纯化等应用上的技术,肯定会超越核酸制备。
然而在NGS领域,磁珠运用也是在不断拓展,简单说几种:KAPA推出“with-bead”策略就更适合自动化建库。
Axygen推出的AxyPrep MagTM PCR Normalizer就可以免去定量的环节,适合于大量样本的自动化建库。
特别是illumina推出的Nextera™DNA Flex Library Preparation Kit的核心技术为Bead-Linked Transposome(BLT),将Nextera的转座体(transposome)链接在磁珠上。
BLT 的On-Bead Tagmentation整合了DNA片段化(fragmentation)、片段接头化(adapter ligation)、和文库定量归一化(library normalization)的步骤,减少手动接触点并节省文库制备时间到2.5小时。
当样本DNA起始量超过BLT的饱和点(大约是100ngDNA),过多的DNA便无法被片段化。
不同于其他种文库制备方法,这样的化学特性使得Nextera DNA Flex片段化结果不会受到DNA定量的准确度影响。
当DNA量介于100-500ng之间,Nextera DNA Flex制备后的文库片段长度和上样量几乎是固定的。
用户可以利用Nextera DNA Flex的广泛样本DNA 起始量,灵活支持各种类型的基因组测序,简化日常操作。