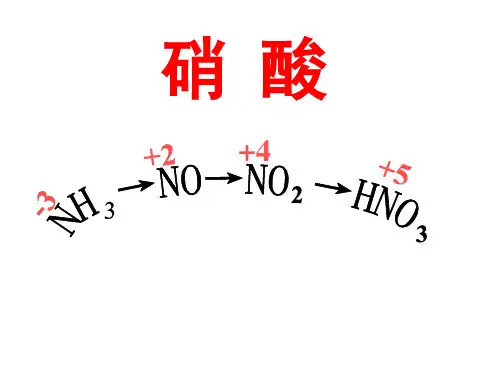
高中化学讲义硝酸的性质
- 格式:ppt
- 大小:2.64 MB
- 文档页数:16


硝酸的分子结构化学式(分子式):HNO3,结构式:HO—NO2。
HNO3是由极性键形成的极性分子,故易溶于水,分子问以范德华力结合,固态时为分子晶体。
硝酸的物理性质和化学性质:物理性质:纯硝酸是无色油状液体, 开盖时有烟雾,挥发性酸[沸点低→易挥发→酸雾]熔点:-42℃,沸点:83℃。
密度:1.5 g/cm3,与水任意比互溶,98%的硝酸为发烟硝酸,69%以上的硝酸为浓硝酸。
化学性质:①具有酸的一些通性:例如:(实验室制CO2气体时,若无稀盐酸可用稀硝酸代替)②不稳定性:HNO3见光或受热发生分解,HNO3越浓,越易分解.硝酸分解放出的NO2溶于其中而使硝酸呈黄色。
有关反应的化学方程式为:③强氧化性:不论是稀HNO3还是浓HNO3,都具有极强的氧化性,HNO3浓度越大,氧化性越强。
其氧化性表现在以下几方面.浓硝酸与稀硝酸的氧化性比较:由铜与硝酸反应的化学方程式知,浓硝酸被还原为NO2,氮的化合价由+5→+4;而稀硝酸被还原为NO,氮的化合价由+5→+2,由此得出稀硝酸具有更强的氧化能力的结论是错误的。
因为氧化剂氧化能力的强弱取决于得电子能力的强弱,而不是本身被还原的程度。
实验证明,硝酸越浓,得电子的能力越强,因而其氧化能力越强。
如稀硝酸能将HI氧化为I2,而浓硝酸可将HI氧化为HIO3。
硝酸在氧化还原反应中,其还原产物可能有多种价态的物质:等,这取决于硝酸的浓度和还原剂还原性的强弱。
除前面的实例外,锌与硝酸可发生如下反应:浓硝酸的漂白作用:在浓硝酸中滴入几滴紫色石蕊试液,微热,可观察到:溶液先变红后褪色,说明浓硝酸具有强氧化性,可以使某些有色物质褪色(氧化漂白)。
但一般不用它作漂白剂,因为它还具有强腐蚀性。
新制氯水或浓硝酸能使淀粉碘化钾试纸先变蓝后褪色,这不是因为它们的漂白性,而是因为发生了如下的化学反应:这是因为过量的氯水或硝酸又把I2氧化成了HIO3而使试纸褪色的。
另外,浓H2SO4遇湿润的蓝色石蕊试纸的现象是先变红后变黑。


高考化学重点知识梳理:硝酸? ? ? ?(一)概述1.硝酸是强酸,具有酸的通性;2.浓、稀硝酸都有强的氧化性,浓度越大,氧化性越强。
3.硝酸属于挥发性酸,浓度越大,挥发性越强(98%以上为发烟硝酸),4.硝酸不太稳固,光照或受热时会分化(长期部署时变黄色的原因?保存注意事项?棕色瓶冷暗处);5.硝酸有猛烈的腐化性,不光腐化肌肤,也腐化橡胶等,6。
产业制硝酸用氨的催化氧化法(三步反响?)。
7.硝酸可与大多数金属反响,通常生成硝酸盐。
8.浓硝酸可氧化硫、磷、碳等非金属成高价的酸或相应的氧化物,本身还原为二氧化氮。
9.硝酸(混以浓硫酸)与苯的硝化反响硝酸(混以浓硫酸)与甲苯的硝化反响(制TNT)10.硝酸与乙醇的酯化反响。
与甘油的酯化反响(二)硝酸与金属反响的“特殊性”及纪律1.浓硝酸与铁、铝的钝化现象(原因及应用:钝化。
常温可以用铝罐车或铁罐车运硝酸)(表现了浓硝酸的什么性质?)2.浓、稀硝酸与活泼金属反响都不生成氢气(原因?)3.浓、稀硝酸能与铜、银等不活泼金属反响(表现了硝酸的什么性质?试管中粘附的铜或银用什么来洗?)4.与金属反响时硝酸的主要还原产物:(1)、与铜、银等不活泼金属反响,浓硝酸生成NO2,而稀硝酸生成NO(2)、与锌、镁等活泼金属反响,还原产物比较纷乱,其价态随金属活泼性增强和酸的浓度降低而降低,最低可得NH4+。
(3)、浓、稀硝酸与金属反响中的作用:表现出——酸性、强氧化性(注意:定量谋略中应用)5.稀硝酸与铁反响,要是硝酸过量,生成三价铁盐,要是铁过量,生成二价铁盐(在硝酸与铁的摩尔比的不同溶液中铁元素存在的形式不同)。
知能训练1.敷衍硝酸的物理性质,下列叙述中,不正确的是()A.可以与水以恣意比互溶B.不易挥发C.有刺激性气味D.质量分数在95%以上的硝酸为发烟硝酸剖析:硝酸是一种易挥发的液体。
答案:B2.(2019宜春高一质检)长期部署的浓硝酸常显黄色。
消除此中的黄色最好的要领是()A.在光亮处部署B.通入适量的空气C.到场足量水D.到场漂白粉剖析:浓硝酸长期部署,HNO3会分化4HNO3=====见光或受热4NO2↑+O2↑+2H2O,产生的NO2溶于此中显黄色,通入适量空气,产生反响:4NO2+O2+2H2O===4HNO3,可消除黄色。



高考化学知识点:硝酸综述1500字硝酸是一种常见的化学物质,它具有较强的氧化性和腐蚀性。
在高考化学中,学生需要了解硝酸的性质、制备方法、应用以及在环境保护方面的问题。
下面是一个关于硝酸的综述,包括以上所提到的内容,总计1500字左右。
硝酸(HNO3)是一种无机化合物,它常见的浓度为60-70%。
硝酸是一种无色液体,在纯度较高的情况下,可以形成无色的单斜晶体。
硝酸的密度较大,是1.41 g/cm³,其中溶液的浓度越高,密度也就越大。
硝酸具有较强的氧化性能,它可以与许多物质发生反应,释放出氧气。
硝酸与还原剂反应时,会放出大量的热量、光和气体,这是因为硝酸分子中的氧原子不稳定。
硝酸还具有强烈的腐蚀性,它可以与金属反应,产生金属硝酸盐,并释放出一些有毒的气体,如NO2。
硝酸的制备方法有多种,常见的方法包括硝酸银法、硝酸钾法和废气法等。
硝酸银法是最常用的制备方法之一,它是通过硝酸与氯化银反应,生成硝酸银,再与氯化钠反应,生成硝酸和氯化银沉淀。
硝酸钾法是通过硝酸与氢氧化钾反应,生成硝酸钾溶液,再经过蒸发和结晶得到硝酸。
废气法是一种环保的制备方法,它是通过吸收硝酸蒸气,然后再经过蒸发和结晶得到硝酸。
硝酸在工业上有广泛的应用。
其中,最重要的用途之一是制造硝酸盐肥料。
由于硝酸具有良好的溶解性和吸湿性,它可以与氮肥和磷肥等混合使用,提高农作物的生产效益。
此外,硝酸还可以用于制造爆炸物,如硝化甘油和硝化纤维等。
硝酸还被用于金属加工和电子行业,用于蚀刻和电路板制造。
然而,硝酸的应用也存在一些环境问题。
一方面,硝酸在空气中会分解,生成一氧化氮(NO)和二氧化氮(NO2)等有毒气体,它们是雾霾和酸雨的主要成分之一。
另一方面,硝酸被使用后产生的废液可能会污染土壤和地下水,对环境造成长期的影响。
因此,为了减少硝酸对环境的污染,应采取一系列措施。
首先,应当加强硝酸生产企业的环境保护意识,控制硝酸废液的排放。
其次,应加强硝酸废液的处理,利用先进的技术对废液进行处理,以减少对环境的影响。


高中化学硝酸的性质教案主题:硝酸的性质教学目标:1. 了解硝酸的分子结构和化学式;2. 掌握硝酸的物理性质和化学性质;3. 能够利用硝酸进行化学实验。
教学重点:1. 硝酸的分子结构和化学式;2. 硝酸的物理性质和化学性质;3. 硝酸的应用。
教学难点:1. 硝酸的分子结构和化学式;2. 硝酸的化学性质的实验操作。
教学内容和步骤:一、引入(5分钟)教师引导学生回顾前几堂课学习的酸碱知识,引出硝酸的概念,激发学生的学习兴趣。
二、讲解硝酸的性质(15分钟)1. 讲解硝酸的化学式和分子结构;2. 介绍硝酸的物理性质和化学性质;3. 引导学生探讨硝酸在实验中的应用。
三、实验演示(20分钟)1. 实验一:硝酸与铜的反应(操作步骤:取一定量的硝酸溶液,加入铜片,观察铜片的变化)2. 实验二:硝酸与碳酸钠的反应(操作步骤:取一定量的硝酸溶液,加入碳酸钠固体,观察气体的产生)3. 实验三:硝酸与氢氧化钠的反应(操作步骤:取一定量的硝酸溶液,加入氢氧化钠固体,观察气体的产生)四、讨论与总结(10分钟)1. 学生讨论实验结果,总结硝酸的化学性质;2. 老师进一步讲解硝酸的应用领域,如制作肥料、强酸等;3. 学生提出问题,老师解答疑惑。
五、作业布置(5分钟)布置作业:整理硝酸的性质,并用硝酸进行一个简单的化学实验。
六、课堂小结(5分钟)总结本节课的重点内容,强化学生对硝酸性质的理解。
教学反思:本节课通过实验演示,激发学生的学习兴趣,提高学生的实验操作能力。
同时,通过讨论与总结环节,加深学生对硝酸性质的理解和应用,达到了预期的教学目标。
“硝酸的性质”教学设计一、教材分析《硝酸的性质》是高中阶段“硫酸的性质”之后,元素化合物中的又一节重要内容,是在新版教材必修第二册第五章第二节的内容,本节由“性质、用途、制法”这一主线,系统全面地简述了知识的内在联系,但这样的课往往不能成为学生看好的课。
然而在有限的40分钟内,让学生活动多起来,时间能否控制,教学任务能否完成,这看似“矛盾”的两个方面成为困扰老师课堂教学的难题。
根据认知冲突理论:学生已有的知识和经验与新知识之间存在某种差异而导致的心理失衡,很容易激起学生的求知欲望。
如何保留原有的知识结构,又让学生主动参与知识的获取过程,关键在于设计能造成学生认知冲突的实验和开放式的问题讨论、实验探究等教学方法,落实“在体验中成长,在探究中发展”的教学目标。
二、学情分析学生已养成比较重视结论(如方程式,产物类型,反应现象……),对过程、方法注意不够,不善于探究。
学生已经具备了“盐酸”和“硫酸”的基本知识,因而在学习过程中,学生会运用模仿、比较等方法,通过实物和实验现象观察,发现问题,提出假说,实施探究。
但在遇到硝酸与金属反应时,产生的气体和颜色变化有些特别而复杂,显得不同于盐酸和稀硫酸,也不和浓硫酸一样,学生会感到困惑。
因此引导的重点应放在探究化学性质上,对物理性质则放在仔细观察、确切表达、原因分析上。
三、素养目标【教学目标】①通过对制备硝酸铜路径的探究,了解硝酸的性质,认识并实现硝酸及其氮的氧化物之间转化,构建物质转化的一般思路。
②通过了解制备硝酸铜的氮循环,构建元素守恒观念,体会化学与工业生产的密切联系,进行可持续发展理念的教育。
【评价目标】①通过硝酸铜制备路线设计诊断并发展学生的设计简单的实验方案探究水平。
②通过对路线设计环节诊断并发展学生的物质类别观、元素价态观。
③通过对路线设计方案不断优化诊断并发展学生的环保意识和社会责任感。
四、教学重点、难点教学重点:一氧化氮、二氧化氮、硝酸的性质教学难点:物质转化的一般思路五、教学方法实验法、分析法六、教学设计思路通过探究由Cu、浓硝酸、蒸馏水为主要原料生产Cu(NO3)2,开展小组合作,围绕生产效率、原料利用率、环境保护等角度不断优化设计方案,来学习硝酸的性质,同时诊断并发展学生的设计简单的实验方案探究水平、物质类别观、元素价态观、环保意识和社会责任感。
精准导学案硝酸的性质课程名称年级学科授课教师日期时段教学目标☆掌握硝酸的酸性、强氧化性;教学时长建议20分钟精准诊查互动导学导学一硝酸的性质知识点讲解硝酸的性质1.物理性质:硝酸是无色易挥发的液体,有刺激性气味。
2.化学性质(1)不稳定性反应:4HNO (浓) 2H O +4NO ↑+O ↑。
(应保存在棕色带有玻璃塞的细口试剂瓶中,置于阴凉处)(2)强氧化性硝酸无论浓、稀都有强氧化性,而且浓度越大,氧化性越强。
按要求完成下列反应的方程式:①与金属反应:稀硝酸与铜反应:3Cu +8HNO (稀)===3Cu(NO )+2NO↑+4H O ;浓硝酸与铜反应:Cu +4HNO (浓)===Cu(NO )+2NO ↑+2H O 。
②与非金属反应:浓硝酸与C 的反应:C +4HNO (浓) CO ↑+4NO ↑+2H O 。
③与还原性化合物反应:硝酸可氧化H S 、SO 、Na SO 、HI 、Fe 等还原性物质。
稀硝酸与FeSO 溶液反应的离子方程式:3Fe +4H +NO ===3Fe +NO↑+2H O 。
3222332233222322222232+42++3— 3+2例题(3)与有机物反应①硝化反应(与反应):+HNO (浓) +H O ;②颜色反应:含有苯基的蛋白质遇到浓硝酸时变黄色。
321.[判断题][难度:★★☆☆☆]判断正误(1)常温下,铁、铝在浓硝酸中的钝化为化学变化( )(2)可用稀硝酸与FeS 固体反应制取H S( )(3)过量的铜与浓硝酸反应,产物中一定有NO( )(4)浓硝酸在光照下久置,会变黄( )(5)浓、稀硝酸都能使蓝色石蕊试纸最终变为红色( )(6)1 mol Fe 溶于过量硝酸,电子转移数为2N ( )(7)由于反应物浓度越大,反应速率越快,因而常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完( )(8)某种pH =0的KNO 溶液中可能含有HNO 、Fe(NO )和CuSO ( )【参考答案】(1)√;(2)×;(3)√;(4)√;(5)×;(6)×;(7)×;(8)×【知 识 点】硝酸的性质【学科能力】辨识记忆2A 333242.[单选题][难度:★★★☆☆]下列有关实验操作、现象和解释或结论都正确的是( )A .①② B .③④ C .②③④ D .②④【参考答案】D【知 识 点】硝酸的性质我爱展示【学科能力】信息整合【题目解析】①中稀硝酸与铁粉反应,铁首先被氧化成Fe ,过量铁粉将Fe 还原,最终得到Fe ,滴入KSCN 溶液不显红色;②中浓硝酸变黄色的原因是硝酸分解生成的二氧化氮溶于硝酸所致;③中Al 箔能与稀硝酸反应放出气体;④中变红表现酸性,而褪色表现的是强氧化性。