高一化学硝酸
- 格式:ppt
- 大小:747.50 KB
- 文档页数:24


化学高一硝酸知识点总结一、硝酸的化学性质硝酸通常是指HNO3,是一种无机酸。
硝酸是一种强氧化性酸,它能和许多金属和非金属反应。
硝酸和硫酸一样都属于强酸,当与水混合时,它发生很强的放热反应。
同时,硝酸也是一种强腐蚀性酸,接触皮肤和黏膜会引起烧伤。
硝酸的溶解度是对其具有很重要的意义。
硝酸在水中是容易溶解的,而且生成的溶液具有特别的氧化性。
硝酸还可以与许多物质发生反应,例如硝化甘油就是硝酸和甘油发生反应的产物。
二、硝酸盐的制备与性质硝酸盐是硝酸的盐类化合物,通常的通式为: R-ONO2。
硝酸盐可以由硝酸和金属氧化物(或碱)反应生成。
硝酸盐一般都是白色晶体,常常在空气中变化25℃以上则失水变质。
硝酸盐的性质由它们的阳离子和硝酸根离子(NO3-)决定。
一般来说,硝酸盐都具有高毒、易燃和爆炸的性质。
硝酸铵(NH4NO3)和硝酸钾(KNO3)在工业上是重要的炸药和火药成分。
三、硝酸与环境保护硝酸被使用在肥料生产中,特别是硝态氮肥。
但大量使用硝酸使土壤中的硝态氮浓度升高,从而造成土壤的环境问题。
过多的硝态氮会导致土壤和水体的污染,使河湖水体富营养化,生态系统遭受破坏,甚至危及人类健康。
因此,环保领域对硝酸和其盐的排放进行了严格的限制。
化肥制造商也加强了相关技术的研发,使硝酸肥料的使用更加科学和环保。
四、金属的硝酸溶液反应硝酸可以溶解大多数金属,产生相应的硝酸盐和氧化物或氢气。
通常,硝酸和活泼金属发生反应尤为激烈。
金属的硝酸溶液反应以铜为例:Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O硝酸还与还原性较强的金属反应时生成亚硝酸盐,如:3Cu + 8HNO3 → 3Cu(NO3)2 +2NO↑+ 4H2O。
五、硝酸与有机化合物的反应硝酸能与许多有机化合物发生反应,主要有硝化反应和硝基化反应。
硝基化合物是亚硝酸盐和含硝基团的有机物,是非常活泼的化合物,有时是爆炸性的。
硝化反应:是指含有活泼氢原子或者含有同位素甲烷,乙烷时,在浓硫酸中加入硝酸,这种反应称为硝化反应。



高一化学第一章第三节硝酸教案一、教学目的1、掌握硝酸的化学性质。
2、了解实验室制NO2、NO的反应原理3、使学生了解硝酸的用途。
二、重点、难点重点:硝酸的氧化性难点:硝酸的氧化性。
三、教学过程设计探究问题框架:1、硝酸的物理性质:(直接给出)反应呢?并与稀硫酸与铜反应进行比较。
【指导学生实验】【总结并板书】3Cu+8HNO3(稀)=3Cu(NO3)2+2NO2↑+4H2O【引导总结】浓硝酸与稀硝酸与铜的作用有何不同;硝酸与硫酸氧化性哪一个较强,从哪几个方面表现。
现象:产生无色气体。
溶液由无色变为蓝色。
铜在不断的溶解。
无色气体遇空气变红棕色。
结论:此无色气体是NO。
因为:此气体遇空气变为了红棕色。
【推导】3Cu+8HNO3(稀)=3Cu(NO3)2+2NO2↑+4H2O【总结】浓硝酸生成NO2、稀硝酸生成NO 气体。
浓硝酸反应速率快,不需加热,稀硝酸反应速率慢,有时需要加热。
浓硫酸与铜反应需要加热,浓硝酸不需加热。
稀硫酸与铜不反应,稀硝酸可以反应。
可见,硝酸的氧化性比硫酸强。
【引导探究】冷浓硝酸与铝、铁活泼金属反应的情况怎样呢?【引导探究】大家回忆,实验室能否用稀硝酸制取氢气?为什么呢?【板书总结】(2)与活泼金属反应在不生成稀硝酸中不生成H2、在浓硝酸中铝、铁钝化。
【讲述】除金、铂以外,其余金属全可被其氧化而溶解。
【介绍】王水的成分:浓硝酸与浓盐酸的混合物,其体积比为1:3。
氧化能力极强,可溶解金和铂。
【实验探究】与浓硫酸一样,铝和铁都浓硝酸中钝化,即浓硝酸把它们的表面氧化成一层薄而致密的氧化膜,常温下可以用铝槽车装运浓硝酸。
【回答】不能,因为硝酸的氧化性很强,NO3-起氧化作用。
而不是H+起氧化作用。
【倾听理解】【引入】请大家用已学知识,推测浓硝酸能否与碳、硫、磷等非金属单质反应?【引导】推测碳与浓硝酸反应的产物,试写反应的化学方程式。
【板书】2、与非金属反应【总结】规律:一般生成最高价酸或氧化物、NO2和H2O。


高一化学关于硝酸的化学方程式化学方程式,2 HNO3 → 2 H2O + 2 NO2 + O2。
硝酸是一种常见的无机化合物,化学式为HNO3。
它是一种强酸,具有强烈的腐蚀性和氧化性。
硝酸在工业上被广泛用作肥料的生产
和金属的腐蚀剂,同时也是一种重要的化学原料。
在化学方程式中,硝酸分解为水、二氧化氮和氧气。
这个反应
可以用以下化学方程式表示,2 HNO3 → 2 H2O + 2 NO2 + O2。
这个方程式告诉我们,当硝酸分解时,会产生水、二氧化氮和
氧气。
这是一个重要的化学反应,因为它展示了硝酸的分解过程,
并且产生了氧气这一重要的氧化剂。
这个方程式也提醒我们,硝酸
是一种强氧化剂,需要在使用时小心操作,以免发生意外。
在学习化学时,理解和掌握化学方程式是非常重要的。
通过化
学方程式,我们可以了解不同物质之间的化学反应过程,以及反应
生成的产物。
因此,对于高中化学学习者来说,掌握硝酸的化学方
程式,了解其性质和反应过程,对于理解化学原理和应用具有重要
意义。
总之,硝酸的化学方程式不仅仅是一种化学符号的组合,更是对硝酸性质和反应过程的重要描述。
通过学习和理解这些化学方程式,我们可以更好地掌握化学知识,为今后的学习和工作打下坚实的基础。

高一化学必修二知识点硝酸高一化学必修二知识点:硝酸引言:化学是我们生活中不可或缺的一部分,它涉及到我们身边的各种物质和化学变化。
在高中化学教学中,硝酸是一个非常重要的知识点。
本文将深入探讨硝酸的性质、制备方法和用途等方面的内容,以帮助学生更好地理解和掌握这一知识点。
一、硝酸的性质硝酸是无机酸的一种,化学式为HNO3。
它是一种无色液体,有着刺激性的气味。
硝酸是一种强酸,具有强烈的腐蚀性,在使用和储存时需要注意安全。
硝酸具有良好的溶解性,可以溶解很多金属、氧化物和碱等物质。
二、硝酸的制备方法硝酸的制备方法主要有以下几种:1. 化学合成法:将浓硫酸与硝酸钾或硝酸银等硝酸盐反应,生成硝酸。
反应方程式为:H2SO4 + KNO3 → HNO3 + KHSO42. 氧化氮化物法:将二氧化氮与水反应,生成硝酸。
反应方程式为:NO2 + H2O → HNO33. 吸收硝酸蒸气法:将硝酸蒸气通过吸收剂,如硫酸,使其与水反应生成硝酸。
这种方法可以高效地制备大量的硝酸。
三、硝酸的用途硝酸具有多种用途,其中的一些主要用途如下:1. 工业应用:硝酸是一种重要的化学原料,在农药、肥料、爆炸物和合成纤维等领域有广泛的应用。
例如,在合成硝化纤维时,硝酸可以与纤维素进行反应,形成硝酸纤维。
2. 医药领域:硝酸也被用作药物的一部分,用于治疗心血管疾病,如心绞痛。
硝酸可以放松血管,增加血流量,从而改善心血管系统的功能。
3. 实验室应用:硝酸在实验室中被广泛应用于化学分析和合成实验中,用于反应试剂、溶液的制备和pH值的调节等用途。
结论:通过本文的介绍,我们可以了解到硝酸的性质、制备方法和用途等方面的知识。
硝酸作为一种常用的化学物质,不仅在工业和实验室中有广泛的应用,还对医药领域有重要意义。
在学习化学的过程中,我们应该加强对硝酸的学习,深入了解其性质和应用,以提高我们对化学的理解和应用能力。
参考文献:1. 何佳佳. 化学必修2 课程标准实验教程. 北京:北京出版社,2018年。

新高一化学硝酸知识点归纳化学是一门关于物质结构、组成和变化的学科。
在高中化学中,硝酸是一个重要的知识点。
本文将对新高一化学中与硝酸相关的知识点进行归纳和探讨。
一、硝酸的定义和性质硝酸是一种无机酸,化学式为HNO3。
它是一种无色液体,在常温常压下很容易挥发。
硝酸能与大多数金属发生反应,产生相应的盐和气体。
例如,与钠反应生成硝酸钠和氢气,化学方程式为:2Na + 2HNO3 → 2NaNO3 + H2↑。
二、硝酸的制备方法硝酸的制备方法有多种,最常见的方法是通过硝酸银和盐酸的反应得到硝酸。
该反应的化学方程式为:AgNO3 + HCl → AgCl + HNO3。
此外,硝酸还可以通过硫酸和硝酸钾的反应得到,该反应的化学方程式为:KNO3 + H2SO4 → KHSO4 + HNO3。
三、硝酸的用途硝酸具有广泛的用途。
首先,硝酸是一种重要的化学原料,广泛用于制备其他化学品,如炸药和肥料等。
其次,硝酸也是一种常见的腐蚀剂,用于清洗金属表面和去除氧化层。
此外,硝酸还用于制备玻璃、草酸和化肥等。
四、硝酸的性质和反应硝酸具有一些独特的性质和反应。
首先,硝酸是一种强酸,在水溶液中能完全离解产生H+离子。
其次,硝酸是一种氧化剂,在许多反应中能够氧化其他物质。
例如,硝酸可以与磷反应生成三硝酸酯,这是一种常见的炸药。
化学方程式为:6HNO3 + P4 →4H3PO4 + 6NO2↑ + O2↑。
此外,硝酸还可以与非金属氢化物反应。
例如,硝酸与氨气反应生成硝酸铵和水,化学方程式为:HNO3 + NH3 → NH4NO3。
还有一种重要的反应是硝酸与碱反应生成相应的盐和水。
例如,硝酸和氢氧化钠反应生成硝酸钠和水,化学方程式为:HNO3 + NaOH → NaNO3 + H2O。
五、硝酸和环境保护硝酸在工业生产和农业中广泛使用,但过量的硝酸对环境和人类健康造成了一定的危害。
硝酸在土壤中的过量积累会导致酸化和氧化反应,从而破坏土壤生态平衡。

化学高一硝酸知识点总结硝酸是一种常见的无机化合物,广泛应用于工业和实验室中。
作为化学高一学生,了解硝酸的性质、制备方法以及它在生活中的应用是非常重要的。
本文将围绕这些方面展开讨论,希望能帮助你更好地理解硝酸的知识。
一、硝酸的性质硝酸的化学式为HNO3,是一种无色透明的液体,有强烈的腐蚀性和氧化性。
它能与金属起反应,产生相应的盐和放出气体,这些气体通常是一氧化氮(NO)和二氧化氮(NO2)。
硝酸的腐蚀性使得它在实验室中常用于清洗试管和玻璃器皿。
此外,硝酸还是一种重要的氧化剂,在许多化学反应中起着重要的作用。
二、硝酸的制备方法1. 传统方法:硝酸可以通过与浓硫酸反应制备。
具体过程是将浓硫酸缓慢地加入浓硝酸中,在加热回流的条件下进行反应。
这种方法制备的硝酸纯度较高,但有气味、刺激性大的缺点。
2. 氮气氧化法:在工业上,氮气和氧气可以在高温高压下直接发生反应,生成氮酸(HNO3)和一氧化氮(NO)。
经过一系列的工艺处理,可以得到高纯度的硝酸。
三、硝酸的应用1. 农业领域:硝酸是一种重要的氮肥原料。
它可以用于制备硝酸铵、硝酸钙等常用的氮肥。
这些氮肥在农田中广泛使用,以增加作物的产量和提高农作物的质量。
2. 化学实验室:硝酸被广泛应用于化学实验室中,用于清洁玻璃仪器、试管和反应器。
此外,硝酸还可用作化学试剂,如氧化剂和脱水剂等。
3. 炸药工业:硝酸是制备炸药的重要原料之一。
它可以与甘油等有机物发生反应,制备出硝酸甘油炸药(TNT)。
虽然硝酸炸药具有很高的爆炸性,但由于其危险性,生活中应避免接触和使用。
4. 医药工业:硝酸在医药工业中也有一定应用。
例如,硝酸甘油可用于治疗心绞痛等心血管疾病,硝酸银可用于治疗眼部感染等。
总结硝酸作为一种广泛使用的无机化合物,其性质和应用领域非常丰富。
通过了解硝酸的性质,我们可以明白它的腐蚀性和氧化性。
在制备硝酸时,我们可以选择传统方法或氮气氧化法。
此外,在农业、化学实验室、炸药工业和医药工业等领域,硝酸也扮演着重要的角色。
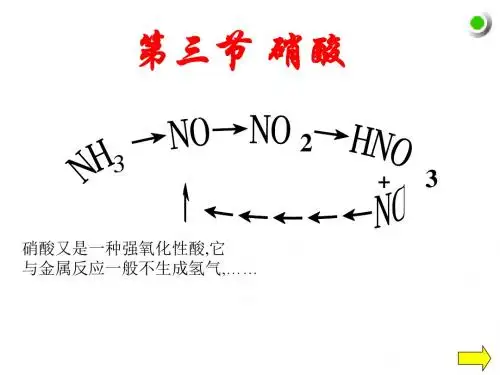
2024年高一化学硝酸教案2024年高一化学硝酸教案1(约2239字)物理性质:1. 纯硝酸是无色油状液体, 开盖时有烟雾, 挥发性酸.2. m.p. -42℃, b.p. 83℃. 密度: 1.5 g/cm3, 与水任意比互溶.3. 常见硝酸a%=63%-69.2% c=14-16mol/l. 呈棕色(分析原因) 发烟硝酸.化学性质:1. 强腐蚀性: 能严重损伤金属、橡胶和肌肤, 因此不得用胶塞试剂瓶盛放硝酸.2. 不稳定性: 光或热4hno3 =====4no2 + o2 + 2h2o所以, 硝酸要避光保存.3. 强酸性: 在水溶液里完全电离, 具有酸的通性.4. 强氧化性: 浓度越大, 氧化性越强.与金属反应:[实验] 在两支试管里分别盛有铜片, 向两支试管理再分别加入浓硝酸和稀硝酸.cu + 4hno3(浓) ==cu(no3)2 + 2no2 ↑+ 2h2o3cu + 8hno3(稀) ==3cu(no3)2 + 2no↑ + 4h2oag + 2hno3(浓) ==agno3 + no2 ↑+h2o3ag + 4hno3(稀) ==3agno3 + no ↑+ 2h2o硝酸能与除金、铂、钛等外的大多数金属反应.通常浓硝酸与金属反应时生成no2, 稀硝酸(钝化反应: 常温下浓硝酸可使铁、铝、铬(都可呈+3价金属化合物)表面形成具有保护性的氧化膜而钝化. 而稀硝酸则与它们反应.fe + 4hno3(稀) ==fe(no3)3 + no + 2h2o王水: 1体积浓硝酸与3体积浓盐酸的'混合溶液.可溶解金、铂.au + hno3 + 4hcl ==haucl4 + no + 2h2om + hno3(12∽14mol/l) ↗no2为主.m + hno3(6∽8mol/l) ↗no为主m + hno3(约2mol/l)↗n2o为主, m较活泼.m + hno3(m + hno3还可能有h2产生(m活泼)与非金属反应: 浓硝酸; 需要加热.c + 4hno3(浓) ==co2 ↑+ 4no2↑ + 2h2o (实验演示) h2s + 8hno3(浓) ==h2so4 + 8no2↑ + 4h2o3h2s + 2hno3(稀) ==3s + 2no + 4h2o (冷)so2 + 2hno3(浓) ==h2so4 + 2no23so2 + 2hno3(稀) + 2h2o ==3h2so4 + 2noh2s、so2以及s2-、so32-都不能与硝酸共存.与有机物反应: 生成硝基化合物和硝酸酯.1. 硝酸的制法: space prefix =o />[设问] 生成硝酸的措施有哪些? 对比优缺点.(三种) 1. 实验室制法: 微热nano3(s) + h2so4(浓) ==nahso4 + hno3[讨论] 1. 反应温度2. 反应装置:3. 收集装置:2. 氨氧化法制硝酸:4nh3 + 5o2 ====4no + 6h2o (氧化炉中)2no + o2 ==2no2 (冷却器中)3no2 + h2o =2hno3 + no (吸收塔)4no2 + o2 + 2h2o ==4hno3 (吸收塔)过程: (1)先将液氨蒸发, 再将氨气与过量空气混合后通入装有铂、铑合金网的氧化炉中, 在800℃左右氨很快被氧化为no. 该反应放热可使铂铑合金网(催化剂)保持赤热状态.2. (2)由氧化炉里导出的no和空气混合气在冷凝器中冷却, no与o2反应生成no2.(3) 再将no2与空气的混合气通入吸收塔. 由塔顶喷淋水, 水流在塔内填充物迂回流下. 塔底导入的no2和空气的混合气, 它们在填充物上迂回向上. 这样气流与液流相逆而行使接触面增大, 便于气体吸收.从塔底流出的硝酸含量仅达50%, 不能直接用于军工、染料等工业, 必须将其制成98%以上的浓硝酸. 浓缩的方法主要是将稀硝酸与浓硫酸或硝酸镁混合后, 在较低温度下蒸馏而得到浓硝酸, 浓硫酸或硝酸镁在处理后再用.2024年高一化学硝酸教案2(约1873字)【学海导航】1、了解硝酸的物理性质。
第五章:评说硫、氮的“功”与“过”第5讲 5.4 化学肥料中的主角——硝酸【教学目标】1.掌握硝酸的物理性质和化学性质(酸性、不稳定性、强氧化性);2.了解硝酸的用途;了解硝酸的工业制法。
课前自学1.硝酸的物理性质色味态:;挥发性: ;水溶性:;发烟硝酸:。
2.推测硝酸的化学性质___________________________________________________________________。
课堂探究知识点一、硝酸1、硝酸的物理性质:纯硝酸为无色、有刺激性气味的液体。
浓HNO3中往往因溶有HNO3分解产生NO2而呈黄色;硝酸沸点低(83℃)、易挥发,在空气中遇水蒸气而产生白雾;69%以上的硝酸为浓硝酸,98%以上的硝酸称为“发烟”硝酸;硝酸易溶于水,以任意比溶于水。
2、硝酸的化学性质:1)强酸性: HNO3 H++NO3-硝酸是一元强酸,具有酸的通性。
⑴跟指示剂反应:紫色石蕊试液遇酸变红色无色酚酞试液遇酸不变色⑵硝酸+碱性氧化物→盐+水Na2O+2HNO3→2NaNO3+H2O⑶硝酸+碱→盐+水NaOH+HNO3→NaNO3+ H2O⑷硝酸+盐→新盐+新酸Na2CO3+2HNO3→2NaNO3+CO2↑+ H2O【过渡】:作为强酸,HNO3和浓硫酸一样不只具有酸的通性还具有一般酸所没有的特性。
这正是我们今天所要重点探讨的。
同学们注意到没有HNO3是装在棕色瓶中的,以前我们还学习过哪些物质是装在棕色瓶中的?这些物质具有哪些共同性质?这说明HNO3具有什么性质?2)不稳定性:4HNO3 _______________ 浓硝酸的储存应_____________________________________________。
(硝酸应保存在玻璃塞的棕色试剂瓶中,并置于阴冷处)3)强氧化性:(1)与金属反应:[温故] 浓硫酸与铜的反应。
−−→ CuSO4+SO2↑+2H2O2H2SO4(浓)+Cu∆[设问] 浓硝酸是否能与铜发生反应?[实验]浓、稀硝酸与铜的反应。
新高一化学硝酸知识点总结在高中化学学习中,硝酸是一个重要的化学品和知识点。
它的制备方法、性质和应用都具有重要的实际意义。
本文将对新高一化学中与硝酸相关的知识点进行总结。
一、硝酸的制备方法硝酸的制备方法有多种,下面将介绍常见的两种方法。
1. 硝化法硝化法是一种重要的制备硝酸的方法。
它是通过硝酸铵和硫酸反应来制备硝酸。
反应的化学方程式为:NH4NO3 + H2SO4 → NH4HSO4 + HNO32. 氧化法氧化法是另一种常见的制备硝酸的方法。
通过将硝基化合物在氧气气氛下进行氧化反应,可以获得硝酸。
氧化法制备硝酸的化学方程式为:2NaNO2 + O2 → 2NaNO3二、硝酸的性质硝酸是强酸,其水溶液呈酸性。
下面将从溶液、氧化性和还原性三个方面介绍硝酸的性质。
1. 溶液硝酸的水溶液是透明的,无色或带有微黄色。
硝酸的水溶液是强酸性溶液,具有腐蚀性。
2. 氧化性硝酸具有较强的氧化性,能将一些金属氧化成相应的金属离子并释放出氧气。
3. 还原性虽然硝酸本身具有氧化性,但在一定条件下,硝酸也具有还原性。
例如,硝酸可以与碱金属或硝酸铅反应生成相应的金属离子和亚硝酸盐。
三、硝酸的应用硝酸在工业生产和实验室中具有广泛的应用。
下面将从肥料生产、炸药和金属加工等方面介绍硝酸的应用。
1. 肥料生产硝酸是制备氮肥的重要原料之一。
在氮肥生产中,硝酸可以与氨气反应生成硝酸铵,用作农田的主要氮肥,提供植物所需的氮元素。
2. 炸药硝酸是一些炸药的重要组成部分,如硝酸甘油炸药(TNG)。
硝酸的氧化性能使得它在炸药领域具有重要的应用,能够提供炸药中所需的氧气。
3. 金属加工硝酸在金属加工中作为腐蚀剂有重要的应用。
例如,硝酸可以与金属铜反应,加工制作出精细的金属制品。
总结:硝酸是高中化学中重要的化学品和知识点,它的制备方法、性质和应用都具有实际意义。
了解硝酸的制备方法有助于理解化学反应的原理,了解硝酸的性质对于实验室操作和工业应用等方面有重要意义。