2018届高考第5章 课时2元素周期律和元素周期表
- 格式:ppt
- 大小:1.81 MB
- 文档页数:49

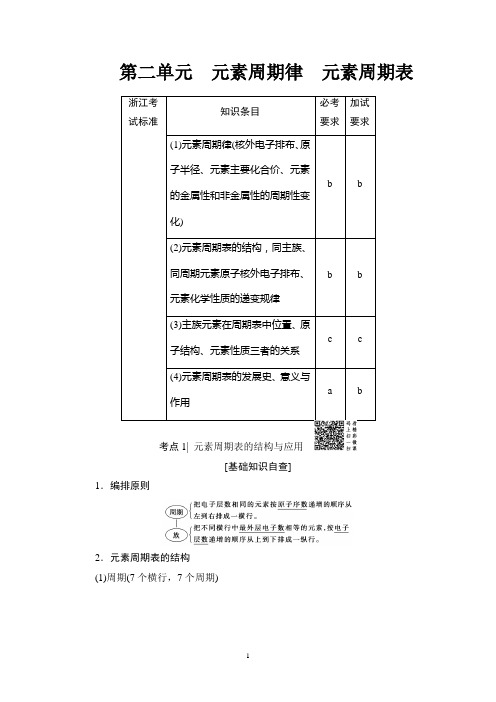
第二单元 元素周期律 元素周期表考点1| 元素周期表的结构与应用[基础知识自查]1.编排原则2.元素周期表的结构(1)周期(7个横行,7个周期)(2)族(18个纵行,16个族)(3)每周期0族元素及其原子序数1.元素周期表的结构2.元素周期表结构中隐含的重要关系(1)常见的等量关系。
①核外电子层数=周期数;②主族序数=最外层电子数=最高正价;③非金属元素:最高正价+|最低负价|=8。
(2)同主族元素的原子序数差的关系。
①位于过渡元素左侧的主族元素,即ⅠA、ⅡA族,同主族、邻周期元素原子序数之差为上一周期元素所在周期所含元素种数;②位于过渡元素右侧的主族元素,即ⅢA~ⅦA族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素种数。
例如,氯和溴的原子序数之差为35-17=18(溴所在第4周期所含元素的种数)。
(3)奇偶关系。
①原子序数是奇数的主族元素,其所在主族序数必为奇数;②原子序数是偶数的主族元素,其所在主族序数必为偶数。
(4)同周期ⅡA族和ⅢA族元素原子序数差。
【特别提醒】周期表中元素的3个规律(1)周期表中的相似规律①同主族元素的性质相似(因为最外层电子数相同);②相邻周期左上、右下位置关系的两元素性质相似(“对角线规则”)。
(2)金属元素无负价,也不能形成简单的阴离子。
(3)非金属元素除氢外,均不能形成简单的阳离子,氢元素既可以形成简单的阴离子(H-)又可以形成简单的阳离子(H+)。
[典型例题讲解](2015·浙江10月份选考)硅元素在周期表中的位置是() A.第2周期ⅣA族B.第3周期ⅣA族C.第3周期ⅥA族D.第2周期ⅥA族【解析】硅原子序数是14,位于第3周期ⅣA族。
【答案】 B(2016·浙江10月选考试题)W、X、Y、Z四种短周期元素,它们在周期表中位置如图所示,下列说法不正确的是()A.W、Y、X三种元素的原子半径依次减小B.Z元素的气态氢化物的热稳定性比Y的高C.W元素与氢元素可能会形成W2H6D.Y元素的单质能从NaZ溶液中置换出Z元素的单质【解析】根据元素在周期表的位置可知,X是O、Y是S、Z是Cl、W是Si。

5.1.2元素周期律和元素周期表(第2课时)一、核心素养发展目标1.能从原子结构的角度理解元素周期表的编排原则,能进行元素在周期表中的位置与原子结构之间的相互推导,提升微观探析能力。
2.了解元素周期表的发展历程及现行元素周期表的结构。
二、教学重难点重点:1.元素周期表的结构;2.碱金属元素与卤族元素的性质及递变性。
难点:碱金属元素与卤族元素的性质及递变性。
三、教学方法实验探究法、总结归纳法、分组讨论法等四、教学过程【导入】展示视频:元素周期表是如何被填满的。
【展示】分别展示不同的元素周期表百变星君——元素周期表祖师级元素周期表NIST(美国国家标准与技术研究院)标准版元素周期表IUPAC(国际纯粹与应用化学联合会)版元素周期表立体版元素周期表图标版元素周期表原子轨道版元素周期表建筑式元素周期表沈阳街头的元素周期表默写版元素周期表【讲解】1.周期(1)特点:每一周期中元素的电子层数相同,即周期序数=电子层数。
(2)分类:短周期和长周期。
(3)2.族(1)主族:共7个,用A表示。
①主族的特点:由短周期和长周期元素共同构成,主族的序数=最外层电子数。
(2)副族:完全由长周期元素构成,共7个。
(3)8、9、10共(4)0族:在元素周期表的第18列。
【问】为什么我们将稀有气体元素称为0族元素?【生】稀有气体很稳定,它们的化合价通常情况下为0。
【讲解】元素周期表结构口诀:七主、七副、零八族【展示】碱金属元素位置Li NaK RbCs最外层均有1个电子2.碱金属元素物理性质的相似性和递变性3.碱金属元素化学性质的相似性和递变性(1)相似性:都是活泼金属,均易失去1个电子,在化合物中均为+1价。
②碱金属的最高价氧化物(R 2O)对应的水化物(ROH),一般都具有强碱性。
【展示】水与碱金属反应的实验视频(3)结论:【展示】氟氯溴碘单质F ClBr I最外层均有7个电子2.卤族元素单质物理性质的相似性和递变性颜色:――――――――――――――――――――――――――→F 2:浅黄绿色 Cl 2:黄绿色 Br 2:深红棕色 I 2:紫黑色均有颜色颜色加深 熔、沸点:―――――――――――――――――――――→F 2:气体 Cl 2:气体 Br 2:液体 I 2:固体均较低逐渐升高 水溶性:―――――――――――――――――――――――――――→F 2:反应 Cl 2:溶解 Br 2:溶解 I 2:微溶除F 2外,都不易溶于水,但都易溶于有机溶剂,如CCl 4、酒精等逐渐减小 3.卤素单质化学性质的相似性和递变性 (1)相似性卤族元素的原子最外层均有7个电子,得电子的能力强,容易得1个电子,其单质都具有较强的氧化性。


第2讲 元素周期律 元素周期表[考纲要求] 1.掌握元素周期律的实质;了解元素周期表(长式)的结构(周期、族)及其应用。
2.以第3周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系。
3.以ⅠA 和ⅦA 族为例,掌握同一主族内元素性质递变规律与原子结构的关系。
4.了解金属、非金属在元素周期表中的位置及其性质的递变规律。
考点一 元素周期表 1.原子序数对于一个原子:原子序数=____________=____________=____________=____________-____________。
2.元素周期表 (1)编排原则:①按____________递增顺序从左到右排列;②将__________相同的元素排成一横行,共有____个横行。
③把________________相同的元素按____________递增的顺序从上到下排成一纵列,共有____列。
(2)周期7个横行,7个周期短周期长周期序号 1 2 3 4 5 6 7元素种数 不完全周期,最多容纳32种元素,目前排了26种元素0族元素原子序数86 (3)族 18列,16个族主族列序 1 2 13 14 15 16 17 族序号 副族 列序 3 4 5 6 7 11 12 族序号第Ⅷ族 第________共3列 0族第______列(4)分区①分界线:沿着元素周期表中______________与____________的交界处画一条斜线,即为金属元素区和非金属元素区分界线(氢元素除外)。
②各区位置:分界线左下方为__________区,分界线右上方为______________区。
③分界线附近元素的性质:既表现__________的性质,又表现____________的性质。
3.元素周期表中的特殊位置(1)过渡元素:元素周期表中部从______族到______族10个纵列共六十多种元素,这些元素都是金属元素。
(2)镧系:元素周期表第____周期中,57号元素镧到71号元素镥共15种元素。
