氢在Gasar工艺常用纯金属中的溶解度
- 格式:pdf
- 大小:193.08 KB
- 文档页数:6
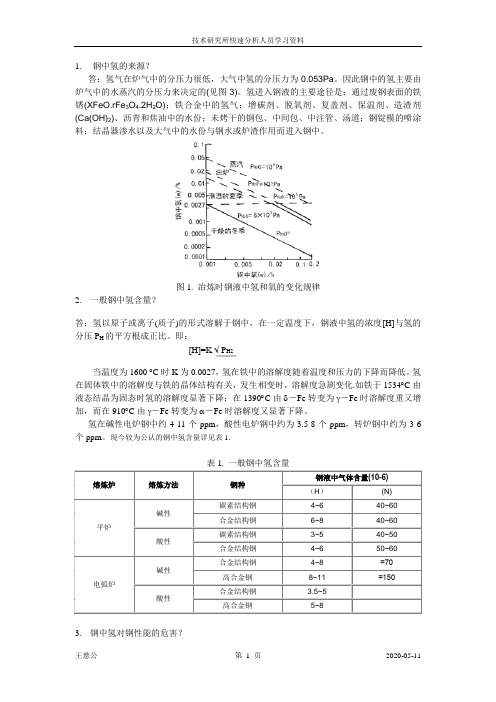
1.钢中氢的来源?答:氢气在炉气中的分压力很低,大气中氢的分压力为0.053Pa。
因此钢中的氢主要由炉气中的水蒸汽的分压力来决定的(见图3)。
氢进入钢液的主要途径是:通过废钢表面的铁锈(XFeO.rFe3O4.2H2O);铁合金中的氢气;增碳剂、脱氧剂、复盖剂、保温剂、造渣剂(Ca(OH)2)、沥青和焦油中的水份;未烤干的钢包、中间包、中注管、汤道;钢锭模的喷涂料;结晶器渗水以及大气中的水份与钢水或炉渣作用而进入钢中。
图1. 冶炼时钢液中氢和氧的变化规律2.一般钢中氢含量?答:氢以原子或离子(质子)的形式溶解于钢中,在一定温度下,钢液中氢的浓度[H]与氢的分压P H的平方根成正比。
即:[H]=K √ P H2当温度为1600 ︒C时K为0.0027,氢在铁中的溶解度随着温度和压力的下降而降低。
氢在固体铁中的溶解度与铁的晶体结构有关,发生相变时,溶解度急剧变化.如铁于1534︒C由液态结晶为固态时氢的溶解度显著下降;在1390︒C由δ-Fe转变为γ-Fe时溶解度重又增加,而在910︒C由γ-Fe转变为α-Fe时溶解度又显著下降。
氢在碱性电炉钢中约4-11个ppm,酸性电炉钢中约为3.5-8个ppm,转炉钢中约为3-6个ppm。
现今较为公认的钢中氢含量详见表1.表1. 一般钢中氢含量3.钢中氢对钢性能的危害?答:氢溶入钢中会降低钢的塑性和韧性。
研究表明,氢含量高不仅会导致钢的伸长率和面缩率急剧降低,还易产生氢致裂纹缺陷。
钢在冷却放置过程中,氢呈过饱和固溶体状态,由于其具有极强的扩散能力,很可能聚集在某些部位,使钢产品的局部压力增高,产生白点,形成内裂,进一步诱发高碳钢的疲劳损伤,严重影响其使用性能。
另一方面,冷却放置时,氢也能扩散到大气中,从而降低钢中的氢含量,减弱其危害。
4. 如何降低钢中氢?答:溶解在钢中的氢和氮以原子状态存在,其溶解反应为:{}[]H H =2%21在一定温度下达到平衡时: []212%H H P H K =[]2%H H P K H ⋅=上式说明氢在钢中的溶解度与作用在钢液面上的氢的分压的平方根成正比,即称西华特定律。

氢气在镍钯溶解度-概述说明以及解释1.引言1.1 概述概述部分的内容应该涵盖对于氢气在镍钯溶解度的简要介绍以及研究背景。
可以按照以下方式进行撰写:概述氢气在镍和钯金属中的溶解度是氢材料学领域中一个重要的研究领域。
镍和钯是两个常用的催化剂和吸氢材料,对于氢能源存储、氢化反应和氢传递等领域具有广泛的应用。
了解氢气在镍和钯中的溶解度对于揭示氢在金属中的吸附、扩散和吸附行为,以及材料的氢化性能具有重要意义。
随着氢能源技术的发展和应用领域的拓展,对于氢气在金属中的溶解度进行深入研究成为研究的热点之一。
目前的研究表明,氢气在镍和钯中的溶解度受到多种因素的影响,如温度、压力、合金成分等。
其中,镍钯合金作为一种重要的氢吸附材料,其表面形貌、晶体结构和杂质掺杂等因素也会对氢气的吸附和扩散行为产生显著影响。
本文将重点探讨氢气在镍和钯金属中的溶解度,通过综合分析已有的研究成果,总结氢气在镍和钯中的溶解度规律,并展望未来研究的方向和发展趋势。
通过对氢在镍、钯金属中的溶解度的深入研究,有望为氢能源技术的进一步发展和应用提供有力的理论和实验支持。
同时,本文还将探讨氢气在镍钯合金中的溶解度与材料性能之间的关联,为材料设计和合金优化提供一定的参考和借鉴。
文章结构部分应该介绍文章的整体结构和内容安排,以便读者能够更好地理解文章的组织和主要内容。
在这个部分,可以简要描述每个章节的主题和目标,以及它们在整体文章中的位置和作用。
可以按照以下方式写作文章结构部分:1.2 文章结构本文按照如下结构展开,以便系统地探讨氢气在镍和钯中的溶解度。
第一部分是引言。
在引言中,我们将概述本文的研究背景和意义,并阐述本文的目的和重要性。
第二部分是正文。
正文分为两个章节,分别讨论氢气在镍和钯中的溶解度。
2.1 氢气在镍中的溶解度。
这一章节将详细介绍氢气在镍中的物理和化学特性,以及氢气在镍中的溶解行为和影响因素。
我们将探讨镍与氢气的相互作用机制,并讨论涉及到氢气溶解度的实验方法和测定结果。

钢中氢气体知识问答(3)1.钢中氢的来源?答:氢气在炉气中的分压力很低,大气中氢的分压力为0.053Pa。
因此钢中的氢主要由炉气中的水蒸汽的分压力来决定的(见图3)。
氢进入钢液的主要途径是:通过废钢表面的铁锈(XFeO.rFe3O4.2H2O);铁合金中的氢气;增碳剂、脱氧剂、复盖剂、保温剂、造渣剂(Ca(OH)2)、沥青和焦油中的水份;未烤干的钢包、中间包、中注管、汤道;钢锭模的喷涂料;结晶器渗水以及大气中的水份与钢水或炉渣作用而进入钢中。
图1. 冶炼时钢液中氢和氧的变化规律2.一般钢中氢含量?答:氢以原子或离子(质子)的形式溶解于钢中,在一定温度下,钢液中氢的浓度[H]与氢的分压P H的平方根成正比。
即:[H]=K √ P H2当温度为1600 ?C时K为0.0027,氢在铁中的溶解度随着温度和压力的下降而降低。
氢在固体铁中的溶解度与铁的晶体结构有关,发生相变时,溶解度急剧变化.如铁于1534?C由液态结晶为固态时氢的溶解度显著下降;在1390?C由δ-Fe转变为γ-Fe时溶解度重又增加,而在910?C由γ-Fe转变为α-Fe时溶解度又显著下降。
氢在碱性电炉钢中约4-11个ppm,酸性电炉钢中约为3.5-8个ppm,转炉钢中约为3-6个ppm。
现今较为公认的钢中氢含量详见表1.表1. 一般钢中氢含量3.钢中氢对钢性能的危害?答:氢溶入钢中会降低钢的塑性和韧性。
研究表明,氢含量高不仅会导致钢的伸长率和面缩率急剧降低,还易产生氢致裂纹缺陷。
钢在冷却放置过程中,氢呈过饱和固溶体状态,由于其具有极强的扩散能力,很可能聚集在某些部位,使钢产品的局部压力增高,产生白点,形成内裂,进一步诱发高碳钢的疲劳损伤,严重影响其使用性能。
另一方面,冷却放置时,氢也能扩散到大气中,从而降低钢中的氢含量,减弱其危害。
4. 如何降低钢中氢?答:溶解在钢中的氢和氮以原子状态存在,其溶解反应为:{}[]H H =2%21在一定温度下达到平衡时: []212%H H P H K =[]2%H H P K H ?=上式说明氢在钢中的溶解度与作用在钢液面上的氢的分压的平方根成正比,即称西华特定律。

氢在钢中的溶解度钢是一种由铁和碳组成的合金,具有高强度和耐腐蚀性能。
然而,钢材在生产、加工和使用过程中,常常会与氢接触,导致氢在钢中的溶解。
氢在钢中的溶解度是指单位体积的钢中可以溶解的氢的质量。
了解氢在钢中的溶解度对于预防氢脆性破坏以及钢材的使用寿命具有重要意义。
氢在钢中的溶解度受多种因素的影响,其中包括温度、压力、氢气浓度、钢的化学成分和结构等。
首先,温度是影响氢在钢中溶解度的重要因素之一。
一般来说,随着温度的升高,钢中氢的溶解度会增加,因为高温可以提供更多的能量,促使氢原子从气相迁移到固相中。
但是,在一定范围内,溶解度也受到反应速率的影响,过高的温度可能会导致氢的释放,从而降低溶解度。
压力也会对氢在钢中的溶解度产生影响。
根据亨利定律,气体在液体中的溶解度与压力成正比。
因此,增加氢气的压力可以促使其在钢中的溶解度增加。
这也是为什么在高压氢气环境中,钢材更容易吸收氢气。
氢气浓度是另一个影响氢在钢中溶解度的因素。
当氢气浓度较高时,其分压也相应增大,从而增加了氢在钢中的溶解度。
因此,在与高浓度氢气接触的环境中,钢材更容易吸收氢气。
钢的化学成分和结构也会对氢在钢中的溶解度产生影响。
一些合金元素,如镍和铬,可以降低氢在钢中的溶解度。
这是因为这些元素与氢形成化合物,减少了氢在钢中的自由状态。
对于钢材的生产和使用,了解氢在钢中的溶解度至关重要。
过高的氢含量可能导致氢脆性破坏,使钢材失去原有的强度和韧性。
因此,在生产过程中,需要采取措施减少氢的吸收,如控制温度、压力和氢气浓度。
此外,也可以通过添加合金元素来降低氢在钢中的溶解度。
在使用过程中,应定期检查钢材中的氢含量,并及时采取措施处理含氢问题,以延长钢材的使用寿命。
氢在钢中的溶解度受温度、压力、氢气浓度、钢的化学成分和结构等多种因素的影响。
了解氢在钢中的溶解度对于预防氢脆性破坏以及延长钢材的使用寿命具有重要意义。
在钢材的生产和使用过程中,应注意控制氢的吸收,并采取相应的措施处理含氢问题。

基于Aspen Plus的氢气在烃类中溶解度的计算韩兴华;董婷;白昊;王艳红【摘要】运用 Aspen Plus闪蒸分离模块建立模拟流程,采用5个物性方程和经验公式计算氢气在十六烷-四氢萘混合溶剂中的溶解度.四氢萘的质量分数为0.226、0.339和0.539,氢气的质量流率为1.5 kg/h,混合溶剂的质量流率为500 kg/h,在温度为453.15,543.15和623.15 K,压力为1~11 MPa条件下,对氢气在十六烷和四氢萘混合溶剂中进行闪蒸平衡分离计算.对比模拟值和测量值,探讨物性方程的使用范围.在温度为543.15 K和673.15 K,压力为3~10 MPa条件下,选取 SRK和PENG-ROB物性方程和经验公式,分别对氢气在十氢萘、四氢萘、十二烷和十六烷中进行溶解度计算.结果表明,在一定的温度和压力下,选择合适的物性方程,运用Aspen Plus闪蒸分离模块可准确计算氢气在烃类中的溶解度.%A simulation model of flash separation unit is established using Aspen Plus.The solubility of hydrogen in hexadecane-1,2,3,4-tetrahydronaphthalene was determined with five property methods a-vailable in Aspen Plus and an empirical equation.The weight percent of 1,2,3,4-tetrahydronaphthalene is 0.226,0.339,0.539,at temperatures of 453.15 K,543.15 K to 623.15 K and pressures from 1 MPa to 1 1 MPa,the flash equilibrium calculation can be achieved when the mass flow of hydrogen is 1 .5 kg/h and the mass flow of mixture is 500 kg/h.The application of the property methods was discussed based on the average absolute deviation between the measured values and experimental results.At tem-perature of 543.15 K and 673.15 K and pressures of 3.0~10 MPa,the flash separator model is built to calculate solubility of hydrogen in hydrocarbons,naphthane,1,2,3,4-tetrahydronaphthalene,dodecane and hexadecane based on SRK,PENG-ROB and empirical equation.The results suggest that the flash separation unit of Aspen Plus can calculate hydrogen solubility in hydrocarbons accurately under a cer-tain temperature and pressure conditions when property methods are chosen correctly.【期刊名称】《中北大学学报(自然科学版)》【年(卷),期】2016(037)005【总页数】6页(P516-521)【关键词】Aspen Plus;物性方程;经验公式;氢气;溶解度【作者】韩兴华;董婷;白昊;王艳红【作者单位】中北大学化工与环境学院,山西太原 030051;中北大学化工与环境学院,山西太原 030051;一重集团大连设计研究院有限公司,辽宁大连 116000;中北大学化工与环境学院,山西太原 030051【正文语种】中文【中图分类】TP391.9汽柴油中微量的含硫组分燃烧后生成的SOx,不仅会导致酸雨,还会使发动机尾气处理系统失效,从而导致机动车尾气中NOx、 CO、颗粒物等有毒物排放. 随着我国将在全国范围内实施车用柴油国IV排放标准(S<50 ppm),超深度加氢脱硫技术备受关注. 工业上多采用氧化铝负载的CoMo和NiMo硫化物为催化剂,过渡金属磷化物、氮化物是目前研究较多的一类高活性加氢精制催化剂[1-2]. 研究工作通常选用模拟油进行实验,即将典型的含硫或含氮化合物溶解在纯溶剂或混合溶剂中,例如十氢萘、十二烷和十六烷等惰性溶剂[3],加氢催化剂的活性与溶剂有关[4-5]. 此外,在众多储氢技术中,将氢气以氢化物形式储存在液体烃类化合物中被认为是一项潜在可行的方案[6]. 而在筛选及评价潜在的有机液体储氢化合物时,氢气的溶解度也是一重要参数. 因此,测定和模拟计算氢气在这些烃类溶剂中的溶解度具有重要的意义.刘晨光等[7]在温度22~250 ℃和压力2~12 MPa 条件下,测定了氢气在甲苯、正庚烷、汽柴油等馏分的溶解度. 罗化峰等[8]分别测定了氢气在混合组分十六烷-四氢萘、四氢萘-喹啉和十六烷-喹啉中的溶解度,并且利用数学模型和P/N/A两种方法计算氢气的溶解度,结果表明数学模型在计算氢气在有机混合溶剂中的溶解度方面具有很好的应用价值. Korsten和Hoffman等[9]根据修正的亨利定律(经验公式),计算氢气和硫化氢在溶剂中的溶解度. 王世丽等[10]运用ChemCAD闪蒸分离模块建立模拟流程,模拟计算氢气在间二甲苯、甲苯、环己烷等溶剂中的溶解度.本研究利用Aspen Plus软件建立模拟流程,进行氢气在烃类中溶解度模拟实验.在模拟过程中,选用SRK、 PENG-ROB、 PSRK、 PR-BM和RK-ASPEN 5个物性方程和经验公式计算氢气在十六烷-四氢萘混合溶剂中的溶解度,对比模拟值、计算值和实验值,探索物性方程的使用范围. 因缺少氢气在十氢萘、四氢萘、十二烷和十六烷中溶解度的实验值,所以选择合适的物性方程和经验公式计算氢气在烃类中的溶解度,为溶剂效应的研究提供理论基础.利用Aspen Plus V8.6建立模拟流程,采用分离过程单元操作,以传质分离单元闪蒸分离器为主要操作单元进行单级气液平衡分离过程计算. 模拟流程建立步骤:点击flash2#、进料流股、产物流股等图标,建立闪蒸流程图;在Properties模块中,选择工程单位、组分、物性方程;在Simulation模块中,定义流股,输入设备参数,运行模拟流程. 流程如图 1 所示.Korsten和Hoffman提出的氢气在溶剂中溶解度计算的经验公式见式(1)、式(4)~式(7)[9]. 式(1)中,H为亨利系数,MPa/(mol·m-3);λ为氢气溶解度系数,(NL H2)/[(kg oil)·(MPa)]; vN为标况下的摩尔体积,22.4 L/mol;ρL为液体的密度,kg/m3. 式(2)和式(3)中[11],E为亨利系数,kPa; Co为溶液的总浓度,kmol/m3;ρS为溶剂密度,kg/m3;MS为溶剂摩尔质量,kg/kmol. 式(4)中,T为温度,℃;ρ20 为溶剂在20 ℃的密度,g/cm3. 式(5)中,ρ0为溶剂在15.6 ℃,压力为 101.3 kPa 的密度,lb/ft3. 式(6)中,ΔρP为压力引起的密度变化,lb/ft3; P为压力,pisa. 式(7)中,ΔPT为温度引起的密度变化,lb/ft3; T为温度,°Ra.[T-520]-[8.1×10-6-0.062 2×10-0.764(ρ0+ΔρP)]·[T-520]2.2.1 模拟值和计算值在流程模拟过程中,不同的软件选用相同的物性方程,模拟计算结果有可能也不一致. 本文采用Aspen Plus V8.6,选取SRK、 PENG-ROB、 PSRK、 PR-BM和RK-ASPEN,并采用经验式(1)~式(7) 计算氢气在间二甲苯溶剂中的溶解度. Aspen Plus V8.6软件中的操作条件如下:以氢气、间二甲苯为主要组分,进料温度为393 K,压力为8 MPa,间二甲苯进料流率为500 kg/h,氢气进料流率为0.5 kg/h;闪蒸分离器操作条件为:温度353 K,压力0.989~4.718 MPa. 将计算出的结果与王世丽运用ChemCAD软件计算结果对比,见表 1. 从表1可看出,压力在0.989~1.968 MPa,Aspen Plus中SRK物性方程比Chem CAD中SRK 方程更接近实际值;压力在2.968~4.718 MPa,Aspen Plus中PENG-ROB物性方程比Chem CAD中PENG-ROB方程更接近测量值[10,12]. PSRK 和RK-ASPEN热力学方程也可用于计算低压下氢气在间二甲苯中的溶解度,但PR-BM方程不适于计算氢气在间二甲苯中的溶解度. 采用经验公式的计算值低于测量值,并且只有在高压4.718 MPa时,与测量值吻合.SRK状态方程适合于低压下正规溶液(烃类所形成的溶液可看作正规溶液) 的模拟计算,而在中高压下,该方法的模拟结果与PENG-ROB相比,偏离较大. 因此,Aspen Plus中SRK和PENG-ROB更适合研究氢气在烃类中溶解度的模拟计算,即选择合适的物性方程,运用Aspen Plus闪蒸分离模块可准确计算氢气在烃类中溶解度. 采用经验公式计算氢气在烃类溶液中的溶解度,不需要考虑氢气和间二甲苯的流率比例. 但进料流股中组分分流率比例选择不合适,软件不能进行闪蒸平衡计算[10],因此经验公式可弥补软件的不足.2.2 氢气在十六烷-四氢萘混合溶剂中的溶解度选取Aspen Plus V8.6中的SRK、 PENG-ROB、 PSRK、 PR-BM和RK-ASPEN 5个物性方程和经验公式,计算氢气在十六烷-四氢萘混合溶剂中的溶解度,模拟和计算结果见表 2. Aspen Plus V8.6操作条件如下:以氢气、十六烷-四氢萘混合溶剂为主要组分,进料温度为623.15 K,压力为11 MPa,混合溶剂的进料流率为500 kg/h,氢气进料流率为1.5 kg/h;闪蒸分离器操作条件为表2中的温度和压力. 从表 2 可看出,SRK和RK-ASPEN方程的模拟值接近,PSRK和PENG-ROB方程的模拟值接近. 在相同温度和压力下,模拟值比计算值更接近测量值. 因此,运用Aspen Plus计算氢气在烃类中的溶解度在一定的条件下是可行的.四氢萘的质量分数为0.226%和0.369%时,在453.15 K,2~10 MPa时,PR-BM方程适于计算氢气的溶解度;在543.15 K,2~10 MPa时,SRK和RK-ASPEN方程适于计算氢气的溶解度,大于10 MPa时,PENG-ROB方程适于计算氢气的溶解度;在623.15 K,3~10 MPa时,PSRK和PENG-ROB方程适于计算氢气的溶解度. 当四氢萘的质量分数为0.539%时,在453.15 K,2~6 MPa 时,PR-BM方程适于计算氢气的溶解度,8~10 MPa时,SRK和RK-ASPEN方程适于计算氢气的溶解度;在543.15 K,4~8 MPa,SRK和RK-ASPEN方程适于计算氢气的溶解度,大于10 MPa时,PENG-ROB方程适于计算氢气的溶解度;在623.15 K,3~5 MPa,SRK和RK-ASPEN方程适于计算氢气的溶解度,7~9 MPa时,PSRK和PENG-ROB方程适于计算氢气的溶解度. 温度在543.15~623.15 K,压力小于 2 MPa,没有合适的物性方程计算氢气的溶解度.2.3 氢气在烃类中的溶解度的计算以十氢萘为环烷烃、十二烷和十六烷为直链烷烃,运用Aspen Plus V8.6和经验公式进行氢气在环烷烃和直链烷烃中溶解度计算. 基于上述结论,以四氢萘和十氢萘为溶剂,在543.15 K,3~8 MPa,选用SRK方程,8~10 MPa,选用PENG-ROB;在623.15 K,3~5 MPa,选用SRK方程,5~10 MPa,选用PENG-ROB方程. 以十二烷和十六烷为溶剂,在543.15 K,2~9 MPa,选用SRK方程,大于 10 MPa,选用PENG-ROB方程;在623.15 K,3~10 MPa,选用PENG-ROB方程. 模拟值和计算值见表3,在相同的温度和压力下,氢气在环烷烃的溶解度模拟值小于在直链烷烃的模拟值. 这一结论也符合刘晨光实验测定的结论,即在相同的温度和压力下,氢气在芳烃中的溶解度小于在直链烷烃中的溶解度[7]. 采用经验公式得出的计算值和运用Aspen Plus运行出的模拟值,两者的数量级相同.若氢气的溶解度不是控制加氢精制反应的主要因素,可采用经验公式计算氢气的溶解度;若氢气的溶解度是主要因素,可运用Aspen Plus软件模拟计算氢气的溶解度.SRK、 PENG-ROB、 PSRK、 PR-BM和RK-ASPEN 5个物性方程都有其使用范围. SRK和RK-ASPEN方程的模拟值接近,PSRK和PENG-ROB方程的模拟值接近. 采用经验公式计算的氢气溶解度小于测量值,但数量级相同. 运用Aspen Plus 闪蒸分离模块建立模拟流程,选择合适的物性方程,进行氢气在十六烷-四氢萘混合溶剂中溶解度的模拟计算,模拟值与测量值接近一致. 氢气在不同溶剂中溶解度的差异,可用于讨论加氢脱硫、加氢脱氮及加氢脱氧等反应过程的溶剂效应,也有助于有机液体储氢载体的选择.【相关文献】[1]Zhao H, Oyama S T, Freund H J, et al. Nature of active sites in Ni2P hydrotreating catalysts as probed by iron substitution[J]. Applied Catalysis B: Environmental, 2015,164(1):204-216.[2]李贵贤,曹彦伟,李梦晨,等. 煤焦油加氢脱氮反应网络及催化剂研究进展[J]. 化工进展,2015,34(5):1283-1290. Li Guixian, Cao Yanwei, Li Mengchen, et al. Research progress in deep hydrodenitrogenation reaction network and its catalysts for coal-tar[J]. Chemical Industry and Engineering Progress, 2015, 34(5):1283-1290. (in Chinese)[3]Chávez L M, Alonso F, Ancheyta J. Vapor-liquid equilibrium of hydrogen-hydrocarbon systems and its effects on hydroprocessing reactors[J]. Fuel, 2014, 138(138):156-175. [4]孙志超. 金属磷化物催化剂制备、改性及其加氢脱硫(氮)反应性能[D]. 大连:大连理工大学,2014.[5]董婷. Ni2P/SiO2催化剂上愈创木酚的加氢脱氧研究[D]. 大连:大连理工大学,2014.[6]Aslam R, Müller K, Müller M, et al. Measurement of hydrogen solubility in potential liquid organic hydrogen carriers[J]. Journal of Chemical & Engineering Data, 2016, 61:643-649.[7]刘晨光,阙国和. 氢气在石油馏分中溶解度的测定[J]. 炼油设计,1999,29(5):33-36. Liu Chenguang, Que Guohe. Determination of hydrogen solubilities in petroleum fractions[J]. Petroleum Refinery Engineering, 1999, 29(5):33-36. (in Chinese)[8]罗化峰,郭剑虹,凌开成,等. 氢气在烃类混合溶剂中高压溶解度的测定[J]. 煤炭转化,2011,34(2):55-58. Luo Huafeng, Guo Jianhong, Ling Kaicheng, et al. Determination on the solubility of hydrogen in hydrocarbon mixtures at high pressures[J]. Coal Conversion, 2011, 34(2):55-58. (in Chinese)[9]Korsten H, Hoffmann U. Three-phase reactor model for hydrotreating in pilot trickle-bed reactors[J]. AIChE Journal, 1996, 42(5):1350-1360.[10]王世丽,刘永刚,张瑞芹. 运用ChemCAD计算氢气在烃类中的溶解度[J]. 现代化工,2013,33(5):114-118. Wang Shili, Liu Yonggang, Zhang Ruiqin. Calculation of hydrogen solubility in hydrocarbons by ChemCAD[J]. Modern Chemical Industry, 2013, 33(5):114-118. (in Chinese)[11]谭天恩,窦梅. 化工原理(下)[M]. 北京:化学工业出版社,2013.[12]赵亮富,赵玉龙,吕朝晖,等. 氢气和一氧化碳在混二甲苯中的溶解度[J]. 化学反应工程与工艺,2000,16(4):396-400. Zhao Liangfu, Zhao Yulong, Lv Chaohui, et al. Solubility of H2 and CO in mixed xylene[J]. Chemical Reaction Engineering and Technology, 2000, 16(4):396-400. (in Chinese)。

氢氧化镍的溶解度-概述说明以及解释1.引言1.1 概述氢氧化镍是一种重要的化学物质,具有广泛的应用价值。
其溶解度是指在特定条件下溶于溶剂中的量,对于氢氧化镍的生产和应用具有重要意义。
本文旨在探讨氢氧化镍的溶解度及其影响因素,以及其在工业生产和科学研究中的应用。
通过对氢氧化镍溶解度的研究,可以更好地理解其性质,为相关领域的技术和产品提供重要的理论基础和实践指导。
1.2 文章结构文章结构部分:本文分为引言、正文和结论三个部分。
在引言部分,将对氢氧化镍的溶解度进行概述,介绍文章的结构和目的。
在正文部分,将详细讨论氢氧化镍的性质、溶解度的影响因素和氢氧化镍的应用。
最后在结论部分,对文章进行总结,展望氢氧化镍溶解度的未来研究方向,并得出结论。
1.3 目的本文的目的是探讨氢氧化镍在溶液中的溶解度,并分析影响氢氧化镍溶解度的因素。
通过对氢氧化镍溶解度的研究,探讨其在工业生产和化学实验中的应用,并对未来可能的技术发展进行展望。
最终旨在为相关领域的科研工作者、工程技术人员和学生提供参考,为氢氧化镍的应用和产业发展做出贡献。
2.正文2.1 氢氧化镍的性质氢氧化镍,化学式为Ni(OH)2,是一种无机化合物,常见的形式是绿色固体。
其具体性质包括:1. 物理性质:氢氧化镍是一种绿色粉末状固体,在常温下不溶于水。
它具有一定的吸湿性,可以在空气中逐渐吸收水分变成氢氧化镍的水合物。
2. 化学性质:氢氧化镍在高温下会发生分解,放出氧气。
它可以被强酸或强碱溶解,生成相应的镍盐。
3. 结构性质:氢氧化镍的晶体结构是层状结构,每一层由Ni(OH)6八面体和NiO6八面体交替排列而成。
在晶体中,氢氧化镍的层状结构能够相互堆叠形成结晶体。
总的来说,氢氧化镍具有一定的稳定性和化学活性,其特有的物理和化学性质使其在许多领域具有重要的应用价值。
2.2 溶解度的影响因素氢氧化镍的溶解度受多种因素影响,包括温度、溶剂、压力和pH值等。
首先,温度是影响氢氧化镍溶解度的重要因素之一。
镁熔液中氢气泡析出动力学模型许四祥;侍海东;张炳刚;徐起兵【摘要】针对镁熔液中氢气泡的析出过程,分析氢气泡析出的动力学特性.考虑多种因素对氢气泡析出影响,对镁熔液中氢气泡上浮运动进行受力分析,利用牛顿第二定律得出氢气泡上浮运动过程中的瞬时加速度方程,并结合气体状态方程、传质边界层方程及流函数等相关性质,推导出镁熔液中氢气泡在析出过程中气泡速度、气泡半径、气泡上浮高度与时间变化关系的动力学模型.采用龙格库塔算法将模型方程在MATLAB中进行编程计算,得到气泡传质速率与时间及气泡半径与时间的关系曲线.研究结果表明:氢气泡形核后析出,随着上浮高度的增加,气泡速度与半径都随之变大,加速度先增大后减小;临近界面处,气泡趋于某一速度值析出并破裂.此模型为镁熔液中氢气泡的形成机理提供了一定的理论基础,对镁合金液态质量控制具有重要意义.【期刊名称】《中南大学学报(自然科学版)》【年(卷),期】2015(046)012【总页数】5页(P4448-4452)【关键词】镁;氢;动力学模型;MATLAB【作者】许四祥;侍海东;张炳刚;徐起兵【作者单位】安徽工业大学机械工程学院,安徽马鞍山,243002;安徽工业大学机械工程学院,安徽马鞍山,243002;安徽工业大学机械工程学院,安徽马鞍山,243002;安徽工业大学机械工程学院,安徽马鞍山,243002【正文语种】中文【中图分类】TG243+.1镁熔液中氢含量已成为影响镁制品综合性能的关键因素之一[1],尤其在铸造镁合金液态质量检测过程中,氢含量直接决定零件成型后质量[2−3],由于镁合金熔炼时吸氢,导致在铸件中出现显微气孔,严重影响其力学性能。
近年来国内外对镁熔液中氢的研究越来越多,张伟华等[4−5]研究了镁等金属熔体中氢气泡的形核机理并通过Gasar工艺法得到了氢在镁等常用纯金属中的溶解度计算公式;许四祥等[6]也对镁及其合金熔液中氢含量进行了研究,得出了纯镁熔液及镁合金熔液中氢含量的数学模型。
图9 氢在铁中的溶解度F ig .9 So lubility of hydrogen in cast iron高温下分解而产生气体。
当铁液与涂料层接触后,发生如下反应:H 2O +Fe →2H +FeO部分原子氢透过已凝固的铸管表皮扩散到液态金属中(因H 原子小、很活泼),使液态金属中的氢浓度提高。
随着温度的降低,氢在液态金属中的溶解度急剧减少,使氢在结晶前沿液相中的浓度迅速增高,如图9所示。
当液态金属中氢的过饱和浓度达到一定程度后,氢就会析出形成气泡,或者当金属液中含有充足的FeO 时,又会发生下列反应:2H +FeO →H 2O +Fe ,生成的水汽泡可能在晶体表面形核。
另外,溶于铁液中的FeO 在降温过程中可能与碳发生反应〔FeO 〕+〔C 〕→〔Fe 〕+CO ,形成气泡。
气泡一旦形成,周围铁液中的氢会迅速向气泡内扩散,使气泡沿着结晶方向长大,当其长大速度与金属晶体界面生长速度相差不大时,就形成了针孔。
因此,在本试验中出现在涂层厚处铸管渗漏较严重的现象,就是上述原因所致。
(3)凹陷的形成机理 由上述分析可知,一面与铸型壁相接触的气体质点,在离心力的作用下,会牢牢地附在型壁上,因此,当某种原因如浇注温度或铸型温度偏低时,会造成铸管局部区域结壳超前。
此时,该部分气体质点将被封闭在铸型壁与铸管壁之间而无法逸出,并且在高温下迅速膨胀,压力骤增。
当气体压力P 汽>P 高+P 型(P 离——离心压力,P 型——铸管塑性变形应力)时,就会使仍然处于塑性状态下的局部管壁被压离铸型而向铸管中心推进,从而形成凹陷。
如果及时将铸型的转速提高,增大P 离,使P 离+P 型>P 汽,凹陷便不会形成,这已被本试验所证实。
四、结论(1)对涂料金属型离心铸造球铁管来说,内腔打点的金属铸型比内腔不打点的金属铸型更容易使铸管外表面产生铸造缺陷。
(2)涂料层厚度是影响铸管外表面质量的重要因素,当涂层达到一定厚度后,随着涂层厚度的增加,铸管外表面的粗糙程度加大。
第一章化学反应与能量检测(时间:90分钟满分:100分)一、选择题(本题包括18个小题,每小题3分,共54分)1中国锅炉燃煤采用沸腾炉逐渐增多,采用沸腾炉的好处在于()匸①增大煤炭燃烧时的燃烧热并形成清洁能源②减少炉中杂质气体(如SQ等)的形成③提高煤炭的热效率并减少CQ的排放④使得燃料燃烧充分,从而提高燃料的利用率B. ①③④ A.①②D.③④ C.②③答案:D2下列反应中,放出热量的是()匸①NaQH溶液中加入盐酸②由乙醇制③铝热反应④由氯酸钾制QD.①④ C.①③ B.②③ A.①②答案:C3下列有关光合作用的说法错误的是()匸A. 将无机物转化为有机物B. 反应物的总能量高于生成物的总能量C. 将太阳能转变为化学能D•是自然界碳元素循环的重要途径答案:B4下列说法中正确的是()1A. 在化学反应中,发生物质变化的同时不一定发生能量变化B. △ H>0表示放热反应,△ H<0表示吸热反应C. △ H的大小与热化学方程式中的各物质的化学计量数无关D. 反应产物的总焓大于反应物的总焓时,△ H>0答案:D5根据以下三个热化学方程式:2H2S(g)+3Q2(g) 2SQ(g)+2H 20(1) △ H=-Q匕1kJ • mol - ;2H 2S(g)+0 2(g)----- 2S(s)+2H 20(1) △ H=- Q1 _ -1-答案:AkJ • mol ;2H2S(g)+O2(g) ------- 2S(s)+2H 2O(g) △ H=-Q kJ • mol。
判断Q、Q、Q三者关系正确的是()B. Q>Q3>Q2 A. Q>Q>QD. Q>Q>Q C. Q>Q>Q6在一定条件下,C0和CH4燃烧的热化学方程式分别为:匸2C0(g)+Q(g)——2CQ(g) △ H=- 566 kJ • mol-1CH4(g)+2O2(g)——CQ(g)+2H 20(1)△ H=- 890 kJ • mol-1由1 mol CO和3 mol CH 4组成的混合气体在上述条件下完全燃烧时,释放的热量为()D.3 867 kJ C.3 236 kJ B.2 953 kJ A.2 912 kJ解析:1 mol CO完全燃烧放出的热量是L kJ,3 mol CH完全燃烧放出的热量是890 kJ X 3,566释放的总热量应当是(t +890X 3) kJ=2 953 kJ 。