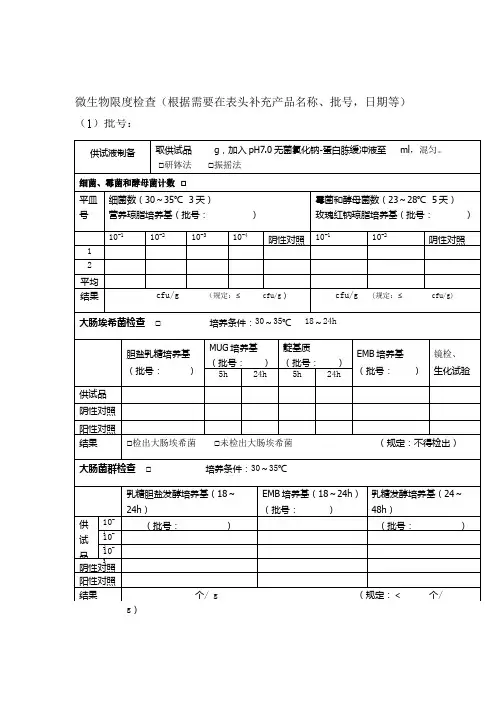
微生物检验记录表
- 格式:doc
- 大小:174.50 KB
- 文档页数:9
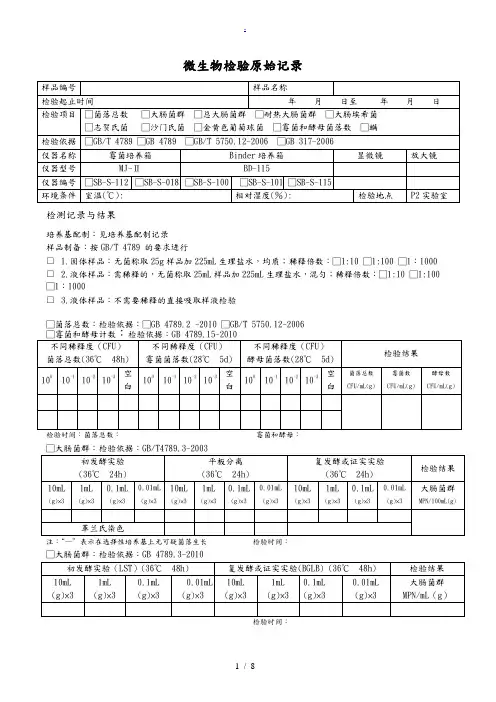
微生物检验原始记录
检测记录与结果
培养基配制:见培养基配制记录
样品制备:按GB/T 4789 的要求进行
□ 1.固体样品:无菌称取25g样品加225mL生理盐水,均质;稀释倍数:□1:10 □1:100 □1:1000 □ 2.液体样品:需稀释的,无菌称取25mL样品加225mL生理盐水,混匀;稀释倍数:□1:10 □1:100 □1:1000
□ 3.液体样品:不需要稀释的直接吸取样液检验
□菌落总数:检验依据:□GB 4789.2 -2010 □GB/T 5750.12-2006
检验时间:菌落总数:霉菌和酵母:
□大肠菌群:检验依据:GB/T4789.3-2003
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
检验时间:
□总大肠菌群:检验依据:GB/T 5750.12-2006
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
□耐热大肠菌群:检验依据:GB/T 5750.12-2006
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
□大肠埃希氏菌:检验依据:GB/T 5750.12-2006
检验时间:
□致病菌□沙门氏菌□志贺氏菌□金黄色葡萄球菌
检验依据 GB 317.4-.10-2006
检测人:复核人:
微生物限度检验记录(复合膜)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:
微生物限度检验记录(铝箔、PVC硬片)
微生物限度检验记录(半成品、成品)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:。
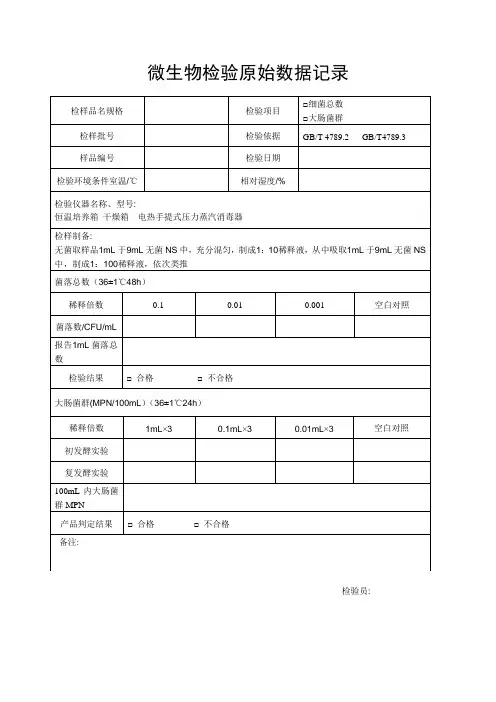
微生物检验原始数据记录
检验员:
检样品名规格 检验项目 □细菌总数 □大肠菌群
检样批号 检验依据 GB/T 4789.2 GB/T4789.3 样品编号 检验日期 检验环境条件室温/℃
相对湿度/%
检验仪器名称、型号:
恒温培养箱 干燥箱 电热手提式压力蒸汽消毒器 检样制备:
无菌取样品1mL 于9mL 无菌NS 中,充分混匀,制成1:10稀释液,从中吸取1mL 于9mL 无菌NS 中,制成1:100稀释液,依次类推 菌落总数(36±1℃48h )
稀释倍数 0.1 0.01 0.001 空白对照
菌落数/CFU/mL
报告1mL 菌落总数
检验结果
□ 合格 □ 不合格
大肠菌群(MPN/100mL )(36±1℃24h )
稀释倍数 1mL ×3
0.1mL ×3
0.01mL ×3
空白对照
初发酵实验 复发酵实验
100mL 内大肠菌群MPN
产品判定结果 □ 合格 □ 不合格 备注:。
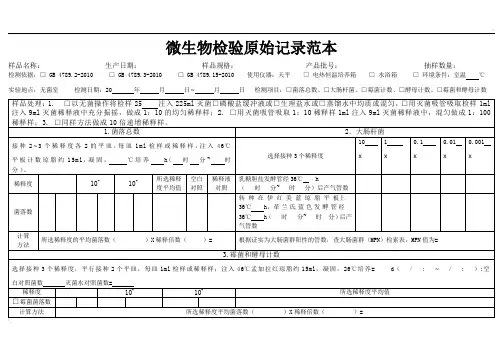
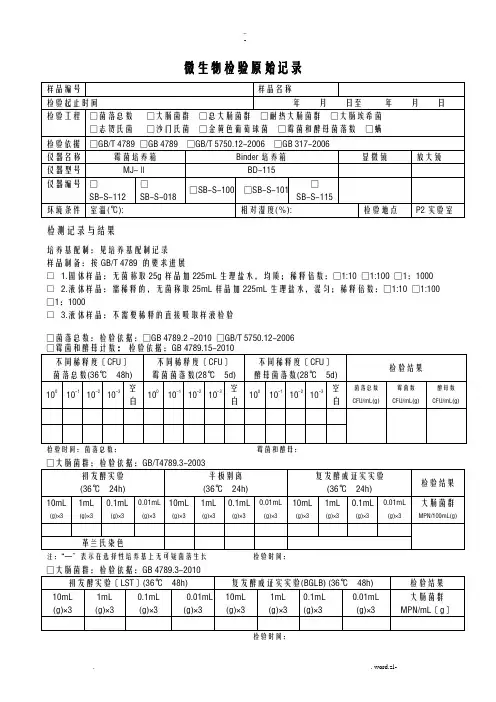
微生物检验原始记录
检测记录与结果
培养基配制:见培养基配制记录
样品制备:按GB/T 4789 的要求进展
□ 1.固体样品:无菌称取25g样品加225mL生理盐水,均质;稀释倍数:□1:10 □1:100 □1:1000 □ 2.液体样品:需稀释的,无菌称取25mL样品加225mL生理盐水,混匀;稀释倍数:□1:10 □1:100 □1:1000
□ 3.液体样品:不需要稀释的直接吸取样液检验
□菌落总数:检验依据:□GB 4789.2 -2010 □GB/T 5750.12-2006
检验时间:菌落总数:霉菌和酵母:
注:“—〞表示在选择性培养基上无可疑菌落生长检验时间:
检验时间:
□总大肠菌群:检验依据:GB/T 5750.12-2006
注:“—〞表示在选择性培养基上无可疑菌落生长检验时间:□耐热大肠菌群:检验依据:GB/T 5750.12-2006
注:“—〞表示在选择性培养基上无可疑菌落生长检验时间:□大肠埃希氏菌:检验依据:GB/T 5750.12-2006
□致病菌□沙门氏菌□志贺氏菌□金黄色葡萄球菌
检验依据GB 317.4-.10-2006
检测人:复核人:微生物限度检验记录〔复合膜〕
检验人:复核人:微生物限度检验记录〔辅料〕
检验人:复核人:
微生物限度检验记录〔铝箔、PVC硬片〕
微生物限度检验记录〔半成品、成品〕
微生物限度检验记录〔辅料〕。
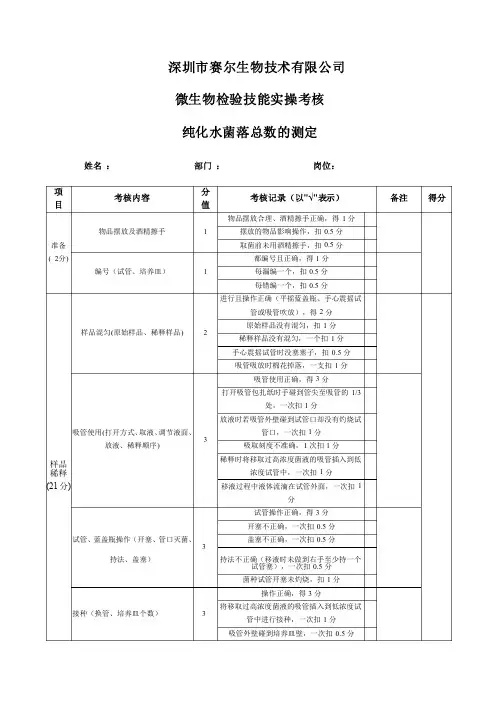
深圳市赛尔生物技术有限公司 微生物检验技能实操考核 纯化水菌落总数的测定姓名 : 部门 : 岗位: 项目考核内容分值考核记录(以"√"表示)备注得分准备准备 ( 2分) 物品摆放及酒精擦手物品摆放及酒精擦手1 物品摆放合理、酒精擦手正确,得1分摆放的物品影响操作,扣0.5分 取菌前未用酒精擦手,扣0.5分编号(试管、培养皿)编号(试管、培养皿)1 都编号且正确,得1分每漏编一个,扣0.5分 每错编一个,扣0.5分样品稀释稀释 (21分) 样品混匀(原始样品、稀释样品) 2 进行且操作正确(平摇蓝盖瓶、手心震摇试管或吸管吹放),得2分原始样品没有混匀,扣1分 稀释样品没有混匀,一个扣1分 手心震摇试管时没塞塞子,扣0.5分 吸管吸放时棉花掉落,一支扣1分吸管使用(打开方式、取液、调节液面、放液、稀释顺序) 3 吸管使用正确,得3分打开吸管包扎纸时手碰到管尖至吸管的1/3处,一次扣1分放液时若吸管外壁碰到试管口却没有灼烧试管口,一次扣1分吸取刻度不准确,1次扣1分稀释时将移取过高浓度菌液的吸管插入到低浓度试管中,一次扣1分移液过程中液体流滴在试管外面,一次扣1分试管、蓝盖瓶操作蓝盖瓶操作(开塞、(开塞、管口灭菌、持法、盖塞)持法、盖塞)3 试管操作正确,得3分开塞不正确,一次扣0.5分盖塞不正确,一次扣0.5分持法不正确(移液时未做到右手至少持一个试管塞),一次扣0.5分菌种试管开塞未灼烧,扣1分接种(换管、培养皿个数)接种(换管、培养皿个数) 3 操作正确,得3分将移取过高浓度菌液的吸管插入到低浓度试管中进行接种,一次扣1分吸管外壁碰到培养皿壁,一次扣0.5分漏接培养皿,一个扣0.5分 试管被污染,每根扣1分加培养基(培养皿持法、加入量、污染皿壁、混匀、)染皿壁、混匀、)4 正确(单手持皿,平端,两指自如开合皿盖,另一只手持培养基瓶),得4分加入培养基量低于10mL ,一次扣0.5分培养基污染皿壁,一次扣1分 培养基瓶接触平皿,一次扣0.5分 培养基有凝块、不透明,一次扣1分酒精灯附近区操作酒精灯附近区操作2 在酒精灯附近区操作,得2分未在酒精灯附近区操作,扣2分空白空白 1 进行,得1分未进行,一个扣0.5分操作熟练程度操作熟练程度3 熟练,得3分较熟练,得2分 一般,得1分 不熟练,得0分培养(3分)琼脂凝固琼脂凝固1 凝固,得1分没有凝固,1个扣0.5分 翻转培养皿翻转培养皿 2 正确培养,得2分培养时未翻转培养皿,一个扣1分清场操作操作 (2分) 实验后台面整理实验后台面整理 1 整理,得1分未整理,扣1分 器皿破损器皿破损 1 未破损,得1分破损,扣1分合计合计考核人:日 期:。

微生物检验原始记录
培养基配制:见培养基配制记录
样品制备:按GB/T 4789 的要求进行
□ 1.固体样品:无菌称取25g样品加225mL生理盐水,均质;稀释倍数:□1:10 □1:100 □1:1000 □ 2.液体样品:需稀释的,无菌称取25mL样品加225mL生理盐水,混匀;稀释倍数:□1:10 □1:100 □1:1000
□ 3.液体样品:不需要稀释的直接吸取样液检验
□菌落总数:检验依据:□GB 4789.2 -2010 □GB/T 5750.12-2006
检验时间:菌落总数:霉菌和酵母:
□大肠菌群:检验依据:GB/T4789.3-2003
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
检验时间:
□总大肠菌群:检验依据:GB/T 5750.12-2006
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
检验时间
□致病菌□沙门氏菌□志贺氏菌□金黄色葡萄球菌
□螨:检验依据 GB 317.4-.10-2006
检测人:复核人:
微生物限度检验记录(复合膜)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:
微生物限度检验记录(铝箔、PVC硬片)
检验人:复核人:
微生物限度检验记录(半成品、成品)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:。
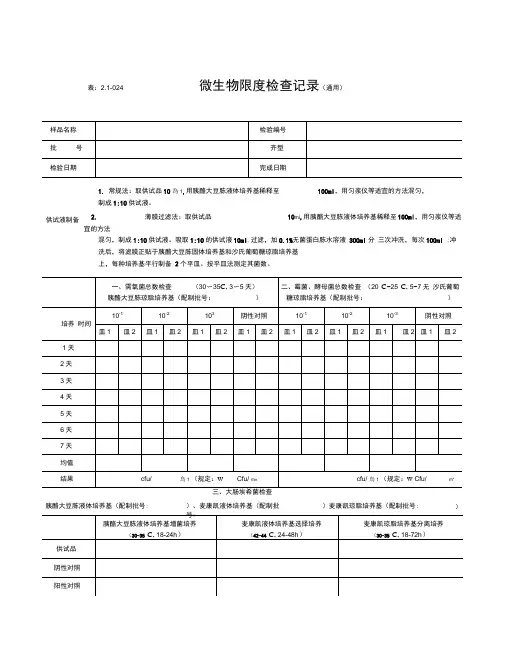
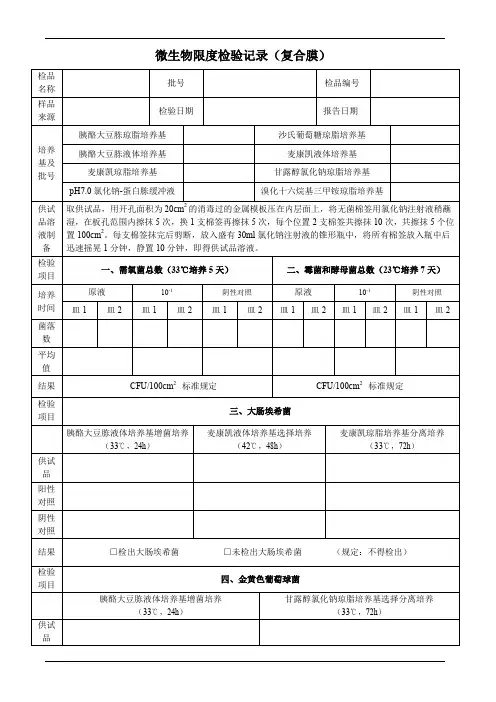
表:2.1-024微生物限度检查记录(通用)1. 常规法:取供试品10為1,用胰酪大豆胨液体培养基稀释至 100ml ,用匀浆仪等适宜的方法混匀,制成1:10供试液。
2. 薄膜过滤法:取供试品10mi ,用胰酪大豆胨液体培养基稀释至 100ml ,用匀浆仪等适宜的方法混匀,制成1:10供试液。
吸取1:10的供试液10ml ,过滤,加0.1%无菌蛋白胨水溶液 300ml 分 三次冲洗,每次100ml ;冲洗后,将滤膜正贴于胰酪大豆胨固体培养基和沙氏葡萄糖琼脂培养基 上,每种培养基平行制备 2个平皿。
按平皿法测定其菌数。
胰酪大豆胨液体培养基(配制批号:)、麦康凯液体培养基(配制批)麦康凯琼脂培养基(配制批号: )供试液制备微生物限度检查记录、需氧菌总数检查30〜353〜5)、霉菌、酵母菌总数检查20C〜25C,5〜7天)三糖铁琼脂斜面穿刺接种 (18〜24h )三、控制菌检查 (30-35 C )检验者:表:2.1-024号:结论本品经按《中国药典》2015年版“非无菌产品微生物限度检查法”进行检验,结果审核者:微生物限度检查记录(丸剂)供试液制备供试液。
胰酪大豆胨增菌 (18〜24h )RV 沙门选择培养木糖赖氨酸脱氧胆酸分离培养(18〜48h )胰酪大豆胨液体培养基(配制批号:)麦康凯琼脂培养基(配制批号:)四、沙门菌检查 (30 °C 〜35C ) 胰酪大豆胨液体培养基(配制批号: )、RV 沙门增菌液体培养基(配制批号: ),木糖赖氨酸脱氧胆酸盐琼脂培养基(配制批号:)、三糖铁琼脂(配制批号:五、耐胆盐革兰阴性菌检杳胰酪大豆胨液体培养基(配制批号:)、肠道菌增菌液体培养基(配制批号:),紫红胆盐葡萄糖琼脂培养基(配制批号:审核者:检验者: 表:2.1-024阴性对照阳性对照三、大肠埃希菌检查)、麦康凯液体培养基(配制批结果□检出大肠埃希菌□未检出大肠埃希菌(规定:不得检出/g)四、沙门菌检查(30°C〜35C)胰酪大豆东液体培养基(配制批号:)、肠道菌增菌液体培养基(配制批号:),紫红胆盐葡萄糖琼脂培养基(配制批号:、表: 2.1-024 微生物限度检查记录(蛇胆川贝液)三、大肠埃希菌检查胰酪大豆胨液体培养基(配制批号:)、麦康凯液体培养基(配制批号:)麦康凯琼脂培养基(配制批号:)胰酪大豆胨液体培养基(配制批号:)、RV沙门增菌液体培养基(配制批号:),木糖赖氨酸脱氧胆酸盐琼脂培养基(配制批号:)、三糖铁琼脂(配制批号:)审核者:检验者:表:2.1-024 微生物限度检查记录(30〜353〜5天)、霉菌、酵母菌总数检查20C〜25C, 5〜7天)1、 口服液体药用聚酯瓶:取数个试瓶,加入1/2标示容量的氯化钠注射液,将盖旋紧,振摇1分钟,即得供试液。
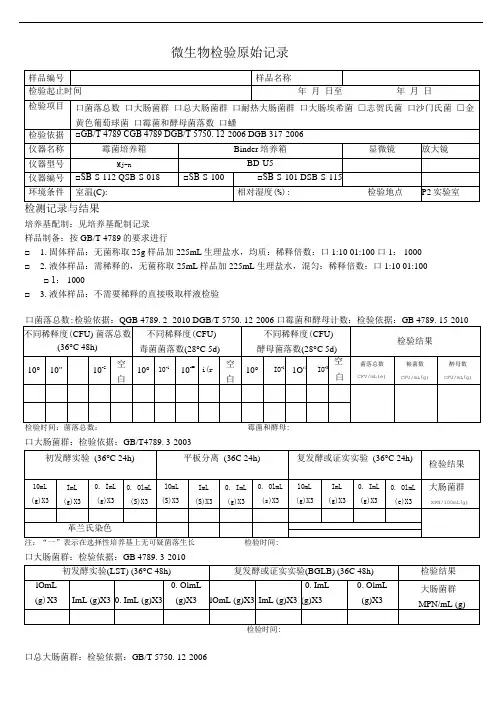
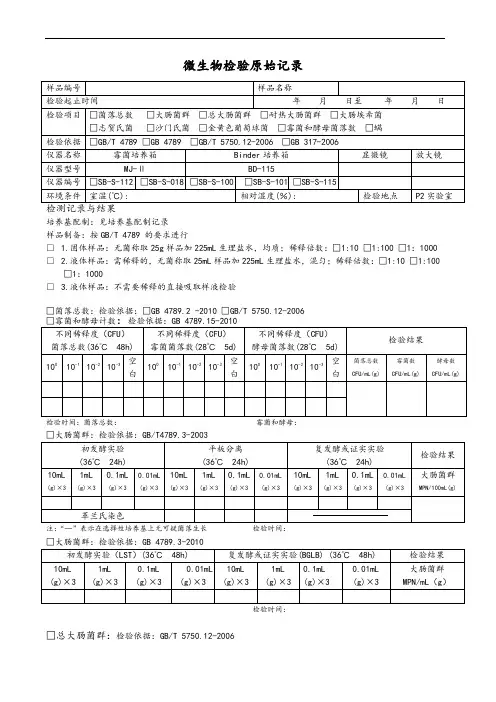
微生物检验原始记录
检测记录与结果
培养基配制:见培养基配制记录
样品制备:按GB/T 4789的要求进行
□1.固体样品:无菌称取25g样品加225mL生理盐水,均质:稀释倍数:口1:10 01:100 口1: 1000 □2.液体样品:需稀释的,无菌称取25mL样品加225mL生理盐水,混匀:稀释倍数:口1:10 01:100□ 1: 1000
□3.液体样品:不需要稀释的直接吸取样液检验
口大肠菌群:检验依据:GB/T4789. 3-2003
口大肠菌群:检验依据:GB 4789. 3-2010
口总大肠菌群:检验依据:GB/T 5750. 12-2006
口大肠埃希氏菌:检验依据:GB/T 5750. 12-2006
口致病菌口沙门氏菌□志贺氏菌□金黄色葡萄球菌
检验依据:DGB 4789. 4-2010 DGB 4789. 5-2012 OGB 4789. 10-2010
GB 317. 4-. 10-2006
检测人:复核人:
微生物限度检验记录(复合膜)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:
微生物限度检验记录(铝箔、PVC硬片)
检验人:复核人:
微生物限度检验记录(辅料)
微生物限度检验记录(半成品、成品)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:。
微生物检验原始记录
培养基配制:见培养基配制记录
样品制备:按GB/T 4789 的要求进行
□ 1.固体样品:无菌称取25g样品加225mL生理盐水,均质;稀释倍数:□1:10 □1:100 □1:1000 □ 2.液体样品:需稀释的,无菌称取25mL样品加225mL生理盐水,混匀;稀释倍数:□1:10 □1:100 □1:1000
□ 3.液体样品:不需要稀释的直接吸取样液检验
□菌落总数:检验依据:□GB 4789.2 -2010 □GB/T 5750.12-2006
检验时间:菌落总数:霉菌和酵母:
□大肠菌群:检验依据:GB/T4789.3-2003
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
检验时间:
□总大肠菌群:检验依据:GB/T 5750.12-2006
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
检验时间
□致病菌□沙门氏菌□志贺氏菌□金黄色葡萄球菌
□螨:检验依据 GB 317.4-.10-2006
检测人:复核人:
微生物限度检验记录(复合膜)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:
微生物限度检验记录(铝箔、PVC硬片)
检验人:复核人:
微生物限度检验记录(半成品、成品)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:。
微生物检测原始记录表
表码:22000—7.11-05
编号:
样品名称采样地点采样时间
样品批号采样人检验日期
检验项目:细菌总数、MPN、沙氏门菌、志贺氏菌、葡萄球菌、链球菌、霉菌计数、酵母菌计数、蜡样芽胞杆菌
样品处理:固体样品称取25g+225ml无菌水作成1︰10,稀释样,根据检样标准及要求依次作递减稀释,选择2—3个稀释度作应用液。
5、致病菌检验结果记录:
取上稀释1︰10的样液分别10ml作增菌处理(GN8h.37℃.SF37℃-24h..1%葡糖肉汤37℃-24h。
7.5%NaCl 肉汤37℃-24h。
GN.SF增菌后作沙门氏菌、志贺氏菌的分离,接种于SS平皿37℃24h,观察菌落形态:
1%葡糖肉汤,7.5%NaCl肉汤增菌后作链球菌,金黄色球菌的分离,分别接种于血琼脂平皿37℃24h培养。
观察菌落形态:
致病菌检验结论:
检验:审核:日期:
时间银行资知通鉴
电话:139****7125QQ号:1055966837。
微生物检验原始记录
培养基配制:见培养基配制记录
样品制备:按GB/T 4789 得要求进行
□1、固体样品:无菌称取25g样品加225mL生理盐水,均质;稀释倍数:□1:10 □1:100 □1:10
00
□2。
液体样品:需稀释得,无菌称取25mL样品加225mL生理盐水,混匀;稀释倍数:□1:10□1:100 □1:1000
□3、液体样品:不需要稀释得直接吸取样液检验
□菌落总数:检验依据:□GB 4789.2-2010 □GB/T 5750.12-2006
检验时间:菌落总数: 霉菌与酵母:
注:“-"表示在选择性培养基上无可疑菌落生长检验时间:
检验时间:
注:“-”表示在选择性培养基上无可疑菌落生长检验时间:
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
检验时间□致病菌□沙门氏菌□志贺氏菌□金黄色葡萄球菌
□螨: 检验依据GB 317、4-、10-2006
ﻬ微生物限度检验记录(复合膜)
检验人: 复核人:
微生物限度检验记录(辅料)
检验人: 复核人:
微生物限度检验记录(铝箔、PVC硬片)
检验人: 复核人:
ﻬ微生物限度检验记录(半成品、成品)
检验人: 复核人:
ﻬ微生物限度检验记录(辅料)
检验人: 复核人:。