浙教版科学八年级上册八上第一章公式集锦.doc
- 格式:doc
- 大小:91.00 KB
- 文档页数:2


浙教版科学八年级上册各单元知识点复习浙教版科学八年级上册各单元知识点复习浙教版科学八年级上册是我们学习科学的重要一环,本册教材包括了多个单元,每个单元都有其独特的内容和重要性。
为了帮助大家更好地掌握各单元的知识点,本文将对其进行复习和总结。
一、单元一:运动和力1、运动学:速度、加速度、位移等基本概念及相互关系。
2、动力学:牛顿三定律,特别是第二定律关于力和加速度的关系。
3、力的分类和性质:引力、弹力、摩擦力等,以及它们的作用和效果。
4、动力学问题:物体平衡状态及解决平衡问题的方法。
二、单元二:压力和浮力1、压力:压力的定义、性质和计算方法。
2、浮力:浮力的定义、性质和计算方法,特别是阿基米德原理的应用。
3、液体和气体的性质:密度、压强、黏度等,以及它们与压力和浮力的关系。
三、单元三:细胞与组织1、细胞的结构和功能:基本构造、各种类型的细胞以及细胞膜、细胞质、细胞核的作用。
2、组织:组织的分类和特点,包括上皮组织、结缔组织、肌肉组织和神经组织。
3、生物体的构成:器官、系统等概念,以及生物体各部分的相互作用。
四、单元四:植物的结构与功能1、植物的构造:根、茎、叶、花、果实的构造及其功能。
2、植物的营养:光合作用、吸收、运输和分配营养物质的过程。
3、植物的生长:生长素等激素的作用,以及植物生长的过程和环境影响。
五、单元五:人体的结构和功能1、人体构造:骨骼、肌肉、器官、系统等概念及其相互关系。
2、生理功能:消化、循环、呼吸、排泄等基本生理过程及其影响。
3、人体免疫:免疫系统的组成和功能,以及各种免疫反应的机制。
4、生殖与发育:人的生殖系统、妊娠与分娩的过程以及生长发育的一般规律。
六、单元六:环境与健康1、环境因素:空气、水源、土壤等环境因素的质量及其对人类和生态系统的影响。
2、健康观念:健康的概念、标准以及影响健康的因素。
3、疾病预防:各种常见疾病的预防方法,特别是传染病的预防和控制。
4、安全常识:各种危险情况的应对方法,包括急救措施等。

初二科学公式大全(浙教版):物理:压强公式P=F/S公式P液=pgh重力G=mg阿基米德原理:F浮=G排=pgv 物体受到液体的浮力大小为它排开的液体的重力。
示重法:F浮=G-F液用弹簧测力计分别测出物体在空气中的示数G,物体浸在液体中时的示数F液。
密度公式p=m/vv=m/pm=pv、力(常见的力、力的合成与分解)1)常见的力1.重力G=mg (方向竖直向下,g=9.8m/s2≈10m/s2,作用点在重心,适用于地球表面附近)2.胡克定律F=kx {方向沿恢复形变方向,k:劲度系数(N/m),x:形变量(m)}3.滑动摩擦力F=μFN {与物体相对运动方向相反,μ:摩擦因数,FN:正压力(N)}4.静摩擦力0≤f静≤fm (与物体相对运动趋势方向相反,fm为最大静摩擦力)注:(1)劲度系数k由弹簧自身决定;(2)摩擦因数μ与压力大小及接触面积大小无关,由接触面材料特性与表面状况等决定;(3)fm略大于μFN,一般视为fm≈μFN;(4)其它相关内容:静摩擦力(大小、方向)〔见第一册P8〕;(2)力的合成与分解1.同一直线上力的合成同向:F=F1+F2,反向:F=F1-F2 (F1>F2)温度:宏观上,物体的冷热程度;微观上,物体内部分子无规则运动的剧烈程度的标志,热力学温度与摄氏温度关系:T=t+273 {T:热力学温度(K),t:摄氏温度(℃)}体积V:气体分子所能占据的空间,单位换算:1m3=103L=106mL压强p:单位面积上,大量气体分子频繁撞击器壁而产生持续、均匀的压力,标准大气压:1atm=1.013×105Pa=76cmHg(1Pa=1N/m2)化学:化合反应1、镁在空气中燃烧:2Mg + O2 点燃2MgO2、铁在氧气中燃烧:3Fe + 2O2 点燃Fe3O43、铝在空气中燃烧:4Al + 3O2 点燃2Al2O34、氢气在空气中燃烧:2H2 + O2 点燃2H2O5、红磷在空气中燃烧:4P + 5O2 点燃2P2O56、硫粉在空气中燃烧:S + O2 点燃SO27、碳在氧气中充分燃烧:C + O2 点燃CO28、碳在氧气中不充分燃烧:2C + O2 点燃2CO9、二氧化碳通过灼热碳层:C + CO2 高温2CO10、一氧化碳在氧气中燃烧:2CO + O2 点燃2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 + H2O === H2CO312、生石灰溶于水:CaO + H2O === Ca(OH)213、无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4•5H2O14、钠在氯气中燃烧:2Na + Cl2点燃2NaCl分解反应15、实验室用双氧水制氧气:2H2O2 MnO2 2H2O+ O2↑16、加热高锰酸钾:2KMnO4 加热K2MnO4 + MnO2 + O2↑17、水在直流电的作用下分解:2H2O 通电2H2↑+ O2 ↑18、碳酸不稳定而分解:H2CO3 === H2O + CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3 高温CaO + CO2↑置换反应20、铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu21、锌和稀硫酸反应(实验室制氢气):Zn + H2SO4 == ZnSO4 + H2↑22、镁和稀盐酸反应:Mg+ 2HCl === MgCl2 + H2↑23、氢气还原氧化铜:H2 + CuO 加热Cu + H2O24、木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑25、甲烷在空气中燃烧:CH4 + 2O2 点燃CO2 + 2H2O26、水蒸气通过灼热碳层:H2O + C 高温H2 + CO27、焦炭还原氧化铁:3C+ 2Fe2O3 高温4Fe + 3CO2↑其他28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH + CuSO4 == Cu(OH)2↓+ Na2SO429、甲烷在空气中燃烧:CH4 + 2O2 点燃CO2 + 2H2O30、酒精在空气中燃烧:C2H5OH + 3O2 点燃2CO2 + 3H2O31、一氧化碳还原氧化铜:CO+ CuO 加热Cu + CO232、一氧化碳还原氧化铁:3CO+ Fe2O3 高温2Fe + 3CO233、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH + CO2 ==== Na2CO3 + H2O35、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3 + 2HCl === CaCl2 + H2O + CO2↑36、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3 + 2HCl === 2NaCl + H2O + CO2一、氧气的性质:(1)单质与氧气的反应:(化合反应)1. 镁在空气中燃烧:2Mg + O2 点燃2MgO2. 铁在氧气中燃烧:3Fe + 2O2 点燃Fe3O43. 铜在空气中受热:2Cu + O2 加热2CuO4. 铝在空气中燃烧:4Al + 3O2 点燃2Al2O35. 氢气中空气中燃烧:2H2 + O2 点燃2H2O6. 红磷在空气中燃烧(研究空气组成的实验):4P + 5O2 点燃2P2O57. 硫粉在空气中燃烧:S + O2 点燃SO28. 碳在氧气中充分燃烧:C + O2 点燃CO29. 碳在氧气中不充分燃烧:2C + O2 点燃2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O2 点燃2CO211. 甲烷在空气中燃烧:CH4 + 2O2 点燃CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 3O2 点燃2CO2 + 3H2O(3)氧气的来源:14.加热高锰酸钾:2KMnO4 加热K2MnO4 + MnO2 + O2↑(实验室制氧气原理1)15.过氧化氢在二氧化锰作催化剂条件下分解反应:H2O2 MnO22H2O+ O2 ↑(实验室制氧气原理2)二、自然界中的水:16.水在直流电的作用下分解(研究水的组成实验):2H2O 通电2H2↑+ O2 ↑17.生石灰溶于水:CaO + H2O == Ca(OH)218.二氧化碳可溶于水:H2O + CO2==H2CO3三、质量守恒定律:19.镁在空气中燃烧:2Mg + O2 点燃2MgO20.铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu21.氢气还原氧化铜:H2 + CuO 加热Cu + H2O22. 镁还原氧化铜:Mg + CuO 加热Cu + MgO四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧:C + O2 点燃CO224.木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑25.焦炭还原氧化铁:3C+ 2Fe2O3 高温4Fe + 3CO2↑(2)煤炉中发生的三个反应:(几个化合反应)26.煤炉的底层:C + O2 点燃CO227.煤炉的中层:CO2 + C 高温2CO28.煤炉的上部蓝色火焰的产生:2CO + O2 点燃2CO2(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):CaCO3 + 2HCl == CaCl2 + H2O + CO2↑30.碳酸不稳定而分解:H2CO3 == H2O + CO2↑31.二氧化碳可溶于水:H2O + CO2== H2CO332.高温煅烧石灰石(工业制二氧化碳):CaCO3 高温CaO + CO2↑33.石灰水与二氧化碳反应(鉴别二氧化碳):Ca(OH)2 + CO2 === CaCO3 ↓+ H2O(4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+ CuO 加热Cu + CO235.一氧化碳的可燃性:2CO + O2 点燃2CO2其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑五、燃料及其利用:37.甲烷在空气中燃烧:CH4 + 2O2 点燃CO2 + 2H2O38.酒精在空气中燃烧:C2H5OH + 3O2 点燃2CO2 + 3H2O39.氢气中空气中燃烧:2H2 + O2 点燃2H2O六、金属(1)金属与氧气反应:40.镁在空气中燃烧:2Mg + O2 点燃2MgO41.铁在氧气中燃烧:3Fe + 2O2 点燃Fe3O442. 铜在空气中受热:2Cu + O2 加热2CuO43. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3(2)金属单质+ 酸-------- 盐+ 氢气(置换反应)44. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑45. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑46. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑47. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3 H2↑48. 锌和稀盐酸Zn + 2HCl == ZnCl2 + H2↑49. 铁和稀盐酸Fe + 2HCl == FeCl2 + H2↑50. 镁和稀盐酸Mg+ 2HCl == MgCl2 + H2↑51.铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3 H2↑(3)金属单质+ 盐(溶液)------- 新金属+ 新盐52. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu53. 锌和硫酸铜溶液反应:Zn + CuSO4 ==ZnSO4 + Cu(3)金属铁的治炼原理:55.3CO+ 2Fe2O3 高温4Fe + 3CO2↑七、酸、碱、盐1、酸的化学性质(1)酸+ 金属-------- 盐+ 氢气(见上)(2)酸+ 金属氧化物-------- 盐+ 水56. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl ==2FeCl3 + 3H2O57. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O58. 氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl2 + H2O59. 氧化铜和稀硫酸反应:CuO + H2SO4 == CuSO4 + H2O(3)酸+ 碱-------- 盐+ 水(中和反应)60.盐酸和烧碱起反应:HCl + NaOH == NaCl +H2O61. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 == CaCl2 + 2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 == AlCl3 + 3H2O63. 硫酸和烧碱反应:H2SO4 + 2NaOH == Na2SO4 + 2H2O(4)酸+ 盐-------- 另一种酸+ 另一种盐64.大理石与稀盐酸反应:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑65.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑66.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑67. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4 ↓+ 2HCl 2、碱的化学性质(1)碱+ 非金属氧化物-------- 盐+ 水68.苛性钠暴露在空气中变质:2NaOH + CO2 == Na2CO3 + H2O 69.苛性钠吸收二氧化硫气体:2NaOH + SO2 == Na2SO3 + H2O 71.消石灰放在空气中变质:Ca(OH)2 + CO2 == CaCO3 ↓+ H2O 72. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 == CaSO3 ↓+ H2O(2)碱+ 酸-------- 盐+ 水(中和反应,方程式见上)(3)碱+ 盐-------- 另一种碱+ 另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH 3、盐的化学性质(1)盐(溶液)+ 金属单质------- 另一种金属+ 另一种盐74. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu(2)盐+ 酸-------- 另一种酸+ 另一种盐75.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑(3)盐+ 碱-------- 另一种碱+ 另一种盐76. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH (4)盐+ 盐----- 两种新盐77.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 == AgCl↓+ NaNO3 78.硫酸钠和氯化钡:Na2SO4 + BaCl2 == BaSO4↓+ 2NaCl其它:79.H2so4+Ca(oH)2===Caso4+2H2o80.Caco3+Co2+H2o===Ca(Hco3)281. Ca(Hco3)2====Caco3↓+Co2+H2o82. Fe2o3+6Hcl==2Fecl3+3H2o83. H2So4+Fe2o3===Fe2(So4)3+3H2o84. 2Naoh+so3===Na2so4+H2o85.H2so4+ca(oh)2====Caso4↓+2H2o。



本章回顾专题1 浮力的综合应用【专题解读】浮力问题是密度、压强、力的平衡、阿基米德原理及物体的浮沉条件等多方面知识的综合应用。
涉及的概念多、规律多,知识的综合性强,所以在解有关浮力问题时,要注意归纳解题方法,明确解题的思路和步骤。
计算浮力的方法一般归纳为以下四种:(1)压力差法:根据浮力产生的原因,浸没在水中的物体在上、下表面上产生的压力差(即浮力)。
F浮=F向上-F向下,一般用于已知物体在液体中的深度,且形状规则的物体。
(2)阿基米德原理法:应用阿基米德原理的公式(F浮=G排液=ρ液gV排液)。
值得注意的是公式中的V排液是物体排开液体的体积(或物体浸没的体积),而不是液体体积也不是物体体积,计算时要已知ρ液和V排液。
(3)浮沉平衡法:只要物体在液体中受力平衡,根据运动和力的关系,若只受重力和浮力作用,那么浮力等于重力(F浮=G物)。
一般用于物体在液体表面漂浮、在液体中悬浮时。
(4)称重法:一个物体在空气中挂在弹簧测力计下,弹簧测力计示数为F1(物体重力G),再将该物体浸没在液体中,弹簧测力计的示数为F2,则物体在液体中浸没时受到的浮力为F F1-F2(或F浮=G-F2)。
浮=说明运用上述方法求浮力时,要明确它们的适用范围,弄清已知条件,不可乱套公式。
【例1】在探究浸在液体中的物体所受的浮力跟它排开液体所受重力的关系时,某同学进行了如图所示的实验:(1)你认为合理的实验顺序应是__甲丁乙丙__。
(2)为了使实验结论更具有普遍性和代表性,该同学还可__B__(选填“A”或“B”)。
A.多次测量取平均值B.换用其他液体多次实验(3)通过此实验,可得结论:浸在液体中的物体所受的浮力大小跟它排出的液体所受的重力__相等__。
(4)图乙中浸没在水中的合金块匀速向下运动的过程中,合金块受到的浮力__不变(选填“变大”“不变”或“变小”)。
专题2 溶质的质量分数计算1.配制一定溶质质量分数的溶液【例2】泡菜具有独特的风味,适合制作泡菜的食盐水浓度是4%。

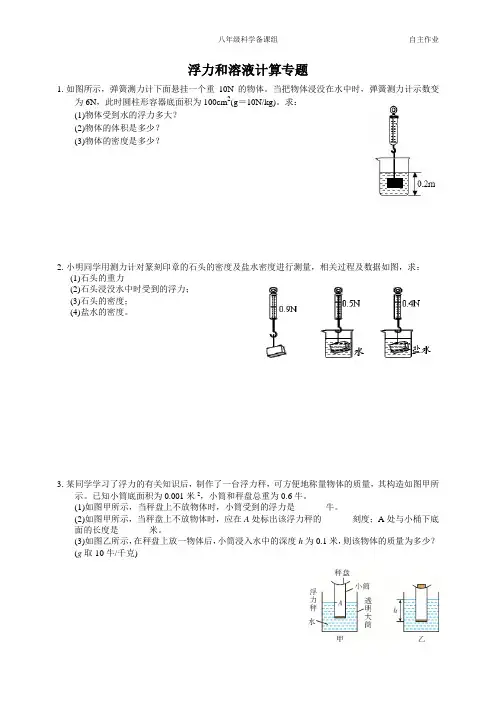
浮力和溶液计算专题1.如图所示,弹簧测力计下面悬挂一个重10N的物体。
当把物体浸没在水中时,弹簧测力计示数变为6N,此时圆柱形容器底面积为100cm2(g=10N/kg)。
求:(1)物体受到水的浮力多大?(2)物体的体积是多少?(3)物体的密度是多少?2.小明同学用测力计对篆刻印章的石头的密度及盐水密度进行测量,相关过程及数据如图,求:(1)石头的重力(2)石头浸没水中时受到的浮力;(3)石头的密度;(4)盐水的密度。
3.某同学学习了浮力的有关知识后,制作了一台浮力秤,可方便地称量物体的质量,其构造如图甲所示。
已知小筒底面积为0.001米2,小筒和秤盘总重为0.6牛。
(1)如图甲所示,当秤盘上不放物体时,小筒受到的浮力是_______牛。
(2)如图甲所示,当秤盘上不放物体时,应在A处标出该浮力秤的_______刻度;A处与小桶下底面的长度是_______米。
(3)如图乙所示,在秤盘上放一物体后,小筒浸入水中的深度h为0.1米,则该物体的质量为多少?(g取10牛/千克)4.重为600000 N的轮船,从长江入口驶入海洋,已知ρ江水=1.0×103 kg/m3,ρ海水=1.2×103kg/m3,g 取10N/kg,请问:(1)船受到的浮力是否改变?大小是多少?(2)该船从长江到海洋,是上浮了还是下沉了?(3)该船在长江中浸入水里的体积是多少?5.如图所示,容器底部用一根细绳拉住一木球,使木球全部浸入水中,已知木球的密度是水的密度的33,g=10N/kg,求:5,木球体积为0.15米(1)水对球的浮力有多大?(2)绳对球的拉力有多大?(3)若细绳剪断后,小球静止时,露出水面的体积是多大?6.现要配制溶质质量分数为25%的氢氧化钠溶液300 克,问:(1)需要氢氧化钠和水各多少克?(2)若将此溶液稀释成10%的氢氧化钠溶液,需加水多少毫升?7.某同学在实验室进行有关浓硫酸的实验,观察到瓶上的标签如下表所示.他从瓶中倒出200毫升用于配制稀硫酸.求:(1)这200毫升浓硫酸的质量是多少克,其中含溶质硫酸多少克。

第一章 水和水溶液一、地球上的水陆地淡水:地球上最大的淡水主体是 冰川水 ,目前,人类利用的淡水资源主要是江河湖泊水和浅层地下水 ,仅占地球上淡水总量的0.3%。
1、 海洋水(96.53%):咸水,地球上最庞大的水体 陆地咸水(0.94%)水圈 陆地淡水:冰川水、地下淡水、湖泊淡水、土壤水、河水等 淡水(2.53%) 为人类提供了几乎全部的生活和生产用水 大气水2、大部分的水以液态形式存在,寒冷的基地和高山上:固态,空气:气态,在空气冲,水是气态 水循环途径:海洋—陆地、海洋—海洋、陆地—陆地,水循环类型包括 海陆间水循环,陆上内循环和海上内循环 ,形成水循环的内因是 水的三态变化 ;导致水循环的外因是 地球引力 和太阳辐射。
3、水循环环节:蒸发(蒸腾)、水汽输送、降水、下渗、地表径流、地下径流4、供人们使用的水资源:某一区域,一段时间内降水总量和同期蒸发损失的水量之差,就是提供地 表和地下径流的水量。
5、水循环越活跃,水资源就越丰富:赤道附近及沿海地区,水资源丰富;内陆和沙漠地区,水资源 贫乏6、我国是全球人均水资源最贫乏的国家之一。
空间分布不均匀:大量淡水资源集中在南方,北方只有南方的四分之一。
时间分布不均匀:夏季丰富、冬季欠缺。
江河径流量年际变化大,北方更为明显 7、最早的生命出现在海洋,水是生命的摇篮。
水是生物生存所必需的最基本物质之一 8、水是植物的重要组成部分9、水是动物生存的基本条件。
一般动物体水含量:70%-80%,水母含量最高:98%,健康成年人每天平均需水量:2.5升二、水的组成 口诀:正氧负氢,氢二氧一10、水的电解实验:氧气:接正极,检验方法:使带火星的木条复燃氢气:接负极,检验方法:点燃后能燃烧并产生淡蓝色火焰 体积比:氧气:氢气=1:2水中加少许硫酸钠或氢氧化钠(烧碱):增加水的导电性 11、水分子的构成:①分子由原子构成;一个水分子是由两个氢原子和 一个氧原子构成的②水电解是一个化学变化;③水是由氢(元素)和氧(元素)组成的; ④在化学变化过程中分子可以分成比 原来分子更小的原子,原子再重新组 合成新的分子;.水的重要性质水 通直流电氢气 氧气+颜色:无色沸点:100℃气味:无味凝固点:0℃状态:常温常压下液态水的异常现象:4℃时密度最大⑤在化学变化过程原子不能再分,原子是化学变化中的最小粒子。

题型1.密度计:密度计如图所示
题型二:轮船:轮船永远是漂浮的
题型三:潜水艇:潜水艇体积不变,一般处于悬浮。
题型四:比较浮力
漂浮:物体密度小于液体密度重力等于浮力物体体积大于排水体积悬浮:物体密度等于液体密度重力等于浮力物体体积等于排水体积下沉:物体密度大于液体密度重力大于浮力物体体积等于排水体积
题型五:实验测浮力:弹簧测力器示数一定不是浮力。
浮力永远等于排开液体的重力
题型六:浮力的应用1。
称重
2.计算密度
题型七:水的组成:负氢正氧,负多正少,2:1
题型八:悬浊液,乳浊液,溶液:都是混合物
题型九:溶解因素:注意溶解能力大小和溶解速率
题型十:溶解中的放热与吸热:放热温度升高,吸热温度降低
题型十一:饱和与不饱和溶液的转化:杯底有溶质的一定是饱和溶液
题型十二:溶解度:1.一定温度2。
100克溶剂3。
饱和溶液
题型十三:质量分数
题型十四:实验。
一、基本科学量及符号、单位
科学量 重 力 质 量 体 积 密 度 压 力 受力面积 压 强 浮 力
科学量符号 G m V ρ F S p
F
浮
主单位 牛顿 千克 米3 千克/米3 牛顿 米2 帕斯卡 牛顿
主单位符号 N kg m3 kg/ m3 N m2 Pa N
常用单位 克(g) 分米3(dm3) 厘米3(cm3) 克/厘米3 (g/cm3) 分米2(dm2) 厘米2(cm2) 千帕(kPa) 兆帕(MPa)
换算关系 1 kg=103g 1m3=103dm3 =106cm3 1g/cm3= 103 kg/ m3 1m2=102dm2 =104cm2 1MPa=103kPa =106 Pa
1.体积单位还有升(L)和毫升(mL) 1分米3=1升 1厘米3=1毫升
2.重力常数g的单位为N/kg ,未作特别说明一般取9.8N/kg
3.密度单位kg/ m3、g/cm3也可写成kg · m-3、g · cm-3,压强单位Pa也写成N/ m2或N · m-2
二、公式及变形
1.重力(重量)公式
① 求重力G=m·g ② 求质量m= ③ 求重力常数g=
2.密度公式
① 求密度ρ= ② 求质量m=ρ·V
③ 求体积V=
3.固体压强公式
① 求压强p= ② 求压力F=p·S
③ 求受力面积S=
4.液体压强公式
p=ρ·g·h
(ρ代表液体密度,h代表液体深度,即某点到液面的垂直距离)
5.阿基米德原理
公式
① 求浮力 F浮=G排液 =ρ液·g·V排液 ② 求液体密度 ρ液= ③ 求排液体积 V排液= ④ 求重力常数
g
=
6.溶解度公式
① 克100S=溶剂mm溶质 ② S克100S=溶液溶质mm ③ S克100100克=溶液mm溶剂
7.溶质的质量分数
公式
① 求溶质的质量分数 A % = ×100% ② 求溶质的质量 m溶质=m溶液×A % ③ 求溶液的质量
m
溶液
=
8.稀释问题关系式
① m浓×A %(浓)=m稀×A %(稀)
② ρ浓·V浓·A %(浓)=ρ稀·V稀·A %(稀)
1.重力公式可以和密度公式结合得到:物体的重力(重量) G=m·g=ρ ·V·g
2.计算浮力有时采用F浮=G-F拉;此外,漂浮时F浮=G(但ρ物<ρ液),悬浮时F浮=G(且ρ物=ρ液)
3.求溶剂的质量,可以用间接方法,即m溶剂=m溶液-m溶质 ,或者m溶剂=m溶液×(1-A %)
4.稀释问题有时会出现m浓·A %(浓) =ρ稀·V稀·A %(稀) 或 m稀×A %(稀) =
ρ
浓·V浓
·
A %(浓)的情形
5.稀释问题中,加入水的质量等于后来稀溶液质量减去先前浓溶液的质量:m加水=
m稀溶液-m
浓溶液
m
G
g
G
V
m
ρ
m
S
F
p
F
排液
浮
VgF
gρF液浮排液液浮VρF
溶液
溶质
m
m
%A
m
溶质
1、Genius only means hard-working all one's life. (Mendeleyer, Russian Chemist) 天才只意味着终身不懈的努力。20.8.248.24.202012:5712:57:08Aug-2012:57
2、Our destiny offers not only the cup of despair, but the chalice of opportunity. (Richard Nixon, American President )命运给予我们的不是失望之酒,而是机会之杯。二〇
二〇年八月二十四日2020年8月24日星期一
3、Patience is bitter, but its fruit is sweet. (Jean Jacques Rousseau , French thinker)忍耐是痛苦的,但它的果实是甜蜜的。
12:578.24.202012:578.24.202012:5712:57:088.24.202012:578.24.2020
4、All that you do, do with your might; things done by halves are never done right. ----R.H. Stoddard, American poet做一切事都应尽力而为,半途而废永远不行
8.24.20208.24.202012:5712:5712:57:0812:57:08
5、You have to believe in yourself. That's the secret of success. ----Charles Chaplin人必须相信自己,这是成功的秘诀。-Monday, August 24, 2020August 20Monday, August 24,
20208/24/2020
6、Almost any situation---good or bad---is affected by the attitude we bring to. ----Lucius Annaus Seneca差不多任何一种处境---无论是好是坏---都受到我们对待处境态
度的影响。12时57分12时57分24-Aug-208.24.2020
7、Although the world is full of suffering, it is full also of the overcoming of it.----Hellen Keller, American writer虽然世界多苦难,但是苦难总是能战胜的。
20.8.2420.8.2420.8.24。2020年8月24日星期一二〇二〇年八月二十四日
8、For man is man and master of his fate.----Tennyson人就是人,是自己命运的主人12:5712:57:088.24.2020Monday, August 24, 2020
9、When success comes in the door, it seems, love often goes out the window.-----Joyce Brothers成功来到门前时,爱情往往就走出了窗外。
12:578.24.202012:578.24.202012:5712:57:088.24.202012:578.24.2020
10、Life is measured by thought and action, not by time. ——Lubbock 衡量生命的尺度是思想和行为,而不是时间。8.24.20208.24.202012:5712:5712:57:0812:57:08
11、To make a lasting marriage we have to overcome self-centeredness.要使婚姻长久,就需克服自我中心意识。Monday, August 24, 2020August 20Monday, August 24,
20208/24/2020
12、Treat other people as you hope they will treat you.你希望别人如何对待你,你就如何对待别人。12时57分12时57分24-Aug-208.24.2020
亲爱的读者:
春去春又回,新桃换旧符。在那桃花盛开的地方,在这醉人芬芳的季
节,愿你生活像春天一样阳光,心情像桃花一样美丽,感谢你的阅读。