酸和碱之间发生的反应
- 格式:ppt
- 大小:527.50 KB
- 文档页数:21




中和反应的实质1. 概述中和反应是化学反应中的一个重要过程,可以理解为酸和碱之间的化学反应。
在中和反应中,酸和碱发生反应,生成盐和水。
中和反应的实质是酸和碱之间的酸碱中和,通过酸和碱之间的中和反应,可使溶液的 pH 值趋近于中性。
2. 中和反应的公式中和反应是一种酸碱反应,其反应公式一般可以表示为:酸 + 碱→ 盐 + 水其中,酸和碱反应生成相应的盐和水。
酸和碱可以是有机酸和无机酸、强酸和弱酸,碱可以是盐基、氢氧化物等。
例如,强酸盐酸与强碱氢氧化钠的中和反应可以表示如下:HCl + NaOH → NaCl + H2O在这个反应中,盐酸和氢氧化钠中和生成氯化钠(盐)和水。
3. 中和反应的原理中和反应的实质是酸碱中和,即酸和碱分子之间的化学反应,产生了中性物质——盐和水。
3.1. 酸碱的定义根据布朗酸碱理论,酸是指能够提供 H+ 电离的物质,而碱是指能够接受 H+ 离子的物质。
3.2. 中和反应的特点•酸碱反应是以质子转移为基础的化学反应。
•中和反应的实质是酸碱中和,将酸和碱反应生成中性的盐和水。
•在中和反应中,酸和碱的摩尔比例是 1:1。
中和反应在生活中有很多应用,例如在制备盐类、清洁剂和药剂等方面起着重要作用。
4. 中和反应的应用4.1. 酸性土壤的调节中和反应在农业中有着重要的应用。
许多土壤由于长期的酸性环境,导致了养分流失,影响植物生长。
通过向酸性土壤中添加石灰作为碱性化合物,可以实现土壤的中和,提高土壤的 pH 值,改善土壤的酸碱性,从而促进植物的生长。
4.2. 制备盐类中和反应在盐类的制备过程中起着至关重要的作用。
许多盐类的制备过程涉及到酸碱的反应。
例如,氯化铜的制备可以通过盐酸与氢氧化铜的中和反应来实现:2HCl + Cu(OH)2 → CuCl2 + 2H2O通过这个中和反应可以得到氯化铜和水。
4.3. 酸碱中和滴定中和反应在化学分析中经常用于酸碱中和滴定。
滴定是一种定量化学分析方法,通过定量加入酸碱溶液,从而确定溶液中的物质浓度。

酸和碱之间会发生什么反应[知识要点]1、中和反应:酸和碱作用生成盐和水的反应叫做中和反应。
例如,盐酸、稀硫酸等酸与氢氧化钠溶液、氢氧化钙溶液的反应,其反应的实质是酸溶液中的H+与碱溶液中的OH-结合生成水的过程。
中和反应在工农业生产及日常生活中有极其广泛的应用。
如:①改良土壤。
用熟石灰来中和土壤的酸性。
②处理废水。
用熟石灰中和硫酸厂的污水(含有硫酸等杂质)等。
③用于医疗和日常生活中。
如用胃舒平(含氢氧化铝)等药物来医治胃酸过多的病人;再如,当我们不小心被黄蜂蛰了(黄蜂的刺中毒液是碱性的)就可以用食醋涂在皮肤上以减轻痛痒。
2、酸、碱、盐三类物质的比较①酸与碱之间发生中和反应除生成水外,还有一类物质生成,那就是盐。
盐是在水溶液中能解离出金属离子和酸根离子的一类化合物,如NaCl、CaCl2、NaCO3、NaHCO3、Cu2(OH)2CO3等。
2②酸、碱、盐三类物质的水溶液比较酸、碱、盐三类物质都是化合物,可溶性的酸、碱、盐在溶于水时都能解离出自由移动的离子,水溶液均能导电。
酸、碱、盐的水溶液是电中性的,故溶液中阳离子所带正电荷总数与阴离子所带负电荷总数相等;但是每个阳离子与每个阴离子所带电荷数不一定相等,所以溶液中阴、阳离子数目不一定相等。
3、溶液酸碱度的表示法——pH①溶液的酸碱性和酸碱度我们知道,盐酸、硫酸等酸类物质的溶液显酸性,氢氧化钠、氢氧化钙等碱类物质的溶液显碱性,而像食盐、蔗糖等物质的水溶液,既不显酸性,也不显碱性,我们将这样的溶液称为中性溶液。
溶液的酸碱性指的是溶液呈酸性、碱性还是中性,通常用酸碱指示剂来测定。
但很多情况下,我们仅仅知道溶液的酸碱性是不够的,比如,正常雨水略显酸性,为何不叫酸雨呢?什么样的雨水才是酸雨呢?这就需要知道溶液酸碱性的强弱程度——酸碱度,即酸碱度是定量地表示溶液酸碱性强弱程度的一种方法。
稀溶液的酸碱度可用pH表示,常使用pH试纸来测定。
②pH和溶液酸碱性的关系以及溶液pH的测定方法a. 稀溶液的pH范围通常在0~14之间,可以是整数,也可以是小数。


1.5 酸碱反应[对应学生用书A本P8—P9]重点提示1. 酸碱反应的实质是酸中的氢离子与碱中的氢氧根离子结合生成水。
2. 酸和碱反应生成盐和水,但生成盐和水的反应不一定都是酸碱反应,如金属氧化物和酸反应也生成盐和水。
3. 部分酸碱反应没有明显的现象,为了便于观察和判断,可运用加指示剂等方法将没有明显现象的反应转化为有明显现象的反应。
A组1酸碱反应是指酸与碱作用生成盐和水的反应,它在工农业生产和日常生活中有广泛的用途。
下列应用中,利用酸碱反应原理的是(C)A. 工业上用碳酸钠和氢氧化钙混合制烧碱B. 用生石灰作食品干燥剂C. 蚊虫叮咬分泌的蚁酸可涂抹氨水消除D. 用稀盐酸洗净盛放石灰水的试剂瓶2在做盐酸和氢氧化钠溶液反应的实验时,通常不需要...用到(D)A. 酚酞试液B. 试管C. 滴管D. 量筒3茶花是人们喜欢的一种花,适宜在偏酸性的土壤中生长。
有一盆茶花长势不好,经测定,盆中土壤的pH为7.6,其他条件均适宜茶花的生长。
用较稀的硫酸亚铁溶液浇灌后,茶花长势变好了。
这说明硫酸亚铁溶液的pH(B)A. 大于7B. 小于7C. 等于7D. 无法确定4物质在发生化学变化时常伴随着一些现象,下列需要借助酸碱指示剂才能观察到化学反应发生的是(A)5下列变化中,不能..表明盐酸与氢氧化钠发生了反应的是(B)A. 向氢氧化钠溶液中加入盐酸后,混合溶液的温度升高B. 向氢氧化钠溶液中加入盐酸后,混合溶液的质量增大C. 向滴有酚酞的氢氧化钠溶液中加入盐酸后,红色退去D. 向氢氧化钠溶液中加入盐酸后,混合溶液的pH<76如图描述了NaOH溶液与盐酸反应的微观实质,图中A、B、C处应填入的化学符号依次是__OH-__、__H+__、__H2O__。
(第6题)7某班同学在做完指示剂分别与常见酸和碱作用变色的性质实验后(如图所示),将两支试管内的废液统一集中在废液桶里,观察到废液呈无色,于是值日生小明认为废液桶里稀硫酸与氢氧化钠溶液恰好完全反应。

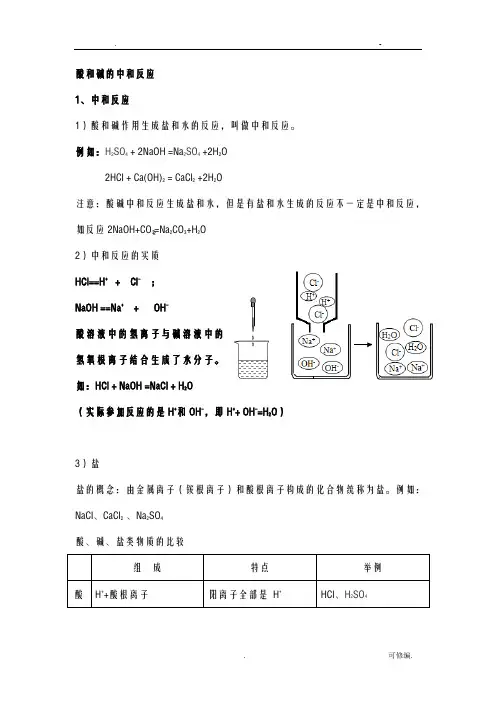
酸和碱的中和反应 1、中和反应1)酸和碱作用生成盐和水的反应,叫做中和反应。
例如:H 2SO 4 + 2NaOH =Na 2SO 4 +2H 2O2HCl + Ca(OH)2 = CaCl 2 +2H 2O注意:酸碱中和反应生成盐和水,但是有盐和水生成的反应不一定是中和反应,如反应2NaOH+CO 222=Na 2CO 3+H 2O 2)中和反应的实质 HCl==H + + Cl - ; NaOH ==Na + + OH -酸溶液中的氢离子与碱溶液中的氢氧根离子结合生成了水分子。
如:HCl + NaOH =NaCl + H 2O(实际参加反应的是H +和OH -,即H ++ OH -=H 2O ) 3)盐盐的概念:由金属离子(铵根离子)和酸根离子构成的化合物统称为盐。
例如:NaCl 、CaCl 2 、Na 2SO 4酸、碱、盐类物质的比较组 成特点举例酸 H ++酸根离子阳离子全部是 H +HCl 、H 2SO 4碱金属离子(或NH4+)+OH-阴离子全部是OH-NaOH、NH3.H2OCa(OH)2盐金属离子(或NH4+)+酸根离子除金属离子和酸根离子外可能还含有其他离子NaH SO4、CaCl2、Na2CO3【习题巩固】如图所示,小田同学在进行酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液滴加稀盐酸一会儿后,发现忘记了滴加指示剂。
为了确定盐酸与氢氧化钠是否恰好完全反应,小田从烧杯中取了少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色。
于是她得出“两种物质已恰好完全中和”的结论。
(1)你认为她得出的结论是否正确________,理由是_____________________。
(2)请你设计一个实验,探究上述烧杯中的溶液是否恰好完全中和.填写下表:实验方法可能观察到的现象结论2、中和反应在实际中的应用调节土壤的酸碱性、处理工厂的废水、用于医药【习题巩固】如图是某种胃药的部分标识。


化学酸碱中和反应化学酸碱中和反应是化学中一种常见的反应类型。
在此类反应中,酸和碱反应生成盐和水。
酸和碱的中和反应具有重要的应用价值,并在日常生活和工业生产中广泛应用。
本文将介绍酸碱中和反应的定义、原理和应用。
一、酸碱中和反应的定义酸碱中和反应是指酸和碱之间的反应,通过该反应可以得到盐和水。
酸和碱在适当的条件下发生中和反应,生成盐和水的过程称为酸碱中和反应。
在酸碱中和反应中,酸质子(H+)和碱的氢氧根离子(OH-)结合生成水,并释放出热量。
酸碱中和反应的化学方程式一般形式如下:酸 + 碱→ 盐 + 水例如,将盐酸(HCl)与氢氧化钠(NaOH)反应得到氯化钠(NaCl)和水(H2O)的方程式为:HCl + NaOH → NaCl + H2O二、酸碱中和反应的原理酸碱中和反应的原理基于酸和碱的性质。
酸是能够释放出质子(H+)的化合物,碱是能够释放出氢氧根离子(OH-)的化合物。
在中和反应中,质子和氢氧根离子结合生成水,同时释放出热量。
这个过程符合酸碱中和的定义。
酸碱中和反应的速率与反应物浓度、温度和反应物之间的反应性有关。
通常情况下,酸碱中和反应是一个较快的反应过程。
当酸和碱的浓度增加时,反应速率也增加。
此外,温度的升高也可以加速酸碱中和反应的进行。
三、酸碱中和反应的应用1. 中和剂的应用中和剂是一种可以与酸和碱反应的物质,用于中和酸碱溶液的过程。
常见的中和剂包括氢氧化钠、氢氧化钾等碱性物质。
在工业生产中,中和剂被广泛应用于酸洗、废水处理等过程。
2. 酸碱中和指示剂酸碱中和指示剂是一种可以根据反应溶液的酸碱性质而变色的物质。
常见的酸碱指示剂包括酚酞、溴酚蓝等。
通过观察酸碱指示剂的颜色变化,可以判断反应溶液的酸碱性质以及中和反应的完成程度。
3. 酸碱中和反应在生活中的应用酸碱中和反应在日常生活中有着广泛的应用。
例如,当我们感到胃酸过多时,常常会服用碱性的胃药来中和胃酸。
此外,在家庭清洁和洗衣等方面,也经常使用具有中和性质的清洁剂。
酸碱中和反应酸碱的相互中和关系酸碱中和反应是化学中重要的概念之一,也是我们日常生活中常见的现象。
它指的是酸和碱的化学反应过程,通过相互反应产生盐和水,同时释放出热能。
酸碱的相互中和关系涉及到各种化学原理和理论,本文将深入探讨酸碱中和反应的机制以及其在实际应用中的意义。
一、酸碱中和反应的机制酸碱中和反应是指酸和碱之间发生的反应过程,其中酸会失去H+离子,而碱会失去OH-离子。
当酸和碱溶液混合时,酸的H+离子与碱的OH-离子相互结合,形成水分子。
这个过程可以用化学方程式来表示,如下所示:酸 + 碱→盐 + 水在化学方程式中,酸和碱的化学符号代表具体的化学物质,盐代表由阳离子和阴离子组成的晶体,水代表反应的产物之一。
酸碱中和反应的机制是基于离子间相互吸引的原理。
具体来说,当酸和碱溶液混合时,酸中的H+离子与碱中的OH-离子会发生强烈的电荷作用,使它们相互吸引并结合在一起,形成水分子。
这个过程释放出大量的能量,通常以热量的形式表现出来。
二、酸碱中和反应的意义酸碱中和反应在化学领域具有广泛的应用,对我们的生活和工业生产有着重要的意义。
以下是酸碱中和反应的几个重要应用:1. 酸碱中和反应在酸碱中和滴定中的应用酸碱中和反应在化学分析中起着至关重要的作用,特别是在酸碱中和滴定方面。
酸碱滴定是一种常用的定量分析方法,可以确定溶液中酸或碱的浓度。
在滴定中,通常用一种称为指示剂的物质来指示酸碱溶液中的中和点。
当酸和碱完全中和时,指示剂会发生颜色变化,标志着滴定的终点。
2. 酸碱中和反应在自然界中的应用酸碱中和反应在自然界中也具有重要的应用。
例如,当酸雨与土壤中的碱性物质发生反应时,可以中和酸雨的酸性,减轻其对环境的破坏。
此外,酸雨与淡水湖泊中的硫酸盐和碱性物质发生反应,会导致湖泊的酸化,危害湖泊生态系统的平衡。
3. 酸碱中和反应在生物体内的应用酸碱中和反应在生物体内起着至关重要的作用。
例如,人体的胃中含有一种叫做胃酸的酸性消化液,它通过与食物中的碱性物质发生中和反应,帮助消化食物。
什么是酸碱中和反应
酸碱中和反应是一种化学反应,指酸和碱在一定条件下作用生成盐和水的反应。
在这个反应过程中,酸和碱的特性都被消除,达到中和的状态。
生成的盐可以是阳离子和阴离子组成的,也可以是复合物。
这个反应在自然界、工业生产和生物体内都有广泛的应用。
酸碱中和反应的原理是酸碱之间的氢离子(H+)和氢氧根离子(OH-)互相结合形成水(H2O),同时产生盐。
具体的反应方程式可以表示为:酸+碱→盐+ 水。
在这个过程中,酸的氢离子与碱的氢氧根离子发生配对,形成水分子,从而实现中和。
酸碱中和反应在化学实验、生产和生活中具有重要意义。
在实验室中,酸碱中和反应常用于测定酸碱浓度、验证化学方程式等。
在工业生产中,酸碱中和反应可用于废水处理、金属腐蚀防护等领域。
在生物体内,酸碱中和反应参与了许多生理过程,如胃酸的调节、血液酸碱平衡的维持等。
然而,酸碱中和反应也可能导致环境污染等问题。
例如,大量使用酸碱物质进行中和处理时,可能会产生有害的废弃物。
因此,在实际应用中,需要权衡酸碱中和反应的利弊,合理使用酸碱物质,以减轻对环境的影响。
总之,酸碱中和反应是一种基础的化学反应,它在科学研究、工业生产和生物体内发挥着重要作用。
了解酸碱中和反应的原理和应用,有助于我们更好地利用这一反应解决实际问题,同时关注环境可持续
发展。
酸和碱反应的化学方程式
酸+碱=盐+水,如:HCl+NaOH=NaCl+H2O。
酸碱反应实际上是酸、碱之
间的质子传递反应,其反应方向总是较强酸和较强碱反应向着生成较弱酸
和较弱碱的方向进行。
酸碱反应的实质是两个共轭酸碱对竞争质子的反应。
酸碱反应方程式
1.盐酸和烧碱起反应:HCl+NaOH=NaCl+H2O
2.盐酸和氢氧化钾反应:HCl+KOH=KCl+H2O
3.盐酸和氢氧化铜反应:2HCl+Cu(OH)2=CuCl2+2H2O
4.盐酸和氢氧化钙反应:2HCl+Ca(OH)2=CaCl2+2H2O
5.盐酸和氢氧化铁反应:3HCl+Fe(OH)3=FeCl3+3H2O
6.氢氧化铝药物治疗胃酸过多:3HCl+Al(OH)3=AlCl3+3H2O
7.硫酸和烧碱反应:H2SO4+2NaOH=Na2SO4+2H2O
8.硫酸和氢氧化钾反应:H2SO4+2KOH=K2SO4+2H2O
9.硫酸和氢氧化铜反应:H2SO4+Cu(OH)2=CuSO4+2H2O。
第一章物质及其变化1.5酸和碱之间发生的反应目录 (1) (2) (4) (5) (7)1.中和反应酸与碱作用生成盐和水的反应,叫做中和反应。
例如:HCl+NaOH===NaCl+H2O1.中和反应的实质盐酸、硫酸等溶液中都可以解离出氢离子和酸根离子,如图甲所示。
酸具有相似的化学性质的原因是酸溶液中都含有H+。
氢氧化钠、氢氧化钙溶液中都能解离出自由移动的金属阳离子和OH-,如图乙所示。
由于碱溶液中都含有OH-,所以碱溶液也具有相似的化学性质。
中和反应的实质就是酸溶液中的H+与碱溶液中的OH-结合生成水的过程。
如HCl+NaOH==NaCl+H2O中实际参加反应的是H+和+OH-,即H++OH-==H2O(如图丙所示)。
很多中和反应生成的盐的阳离子和阴离子仍在溶液中自由移动,如NaOH与HCl(如图丙所示)、KOH与H2SO4、NH3·H2O与HCl等的中和反应。
但有些中和反应生成的盐以沉淀的形式从溶液中析出,如H2SO4与Ba(OH)2的反应:H2SO4+Ba(OH)2===BaSO4↓+2H2O2.中和反应在实际中的应用调节土壤的酸农作物一般适宜在中性或接近中性的土壤中生长,如果土壤的酸性或碱性太强都不利碱性于农作物的生长。
①若土壤呈酸性,可将适量的熟石灰加入土壤中以中和土壤的酸性;②如果土壤呈碱性,可通过加碳酸水来中和土壤的碱性从而得到有利于农作物生长的土壤环境。
处理工厂的废水①用熟石灰中和硫酸厂的污水(含硫酸等杂质),发生反应的化学方程式为:Ca(OH)2+H2SO4===CaSO4+2H2O;②若工厂的废水呈碱性,则可用废硫酸等中和,发生反应的化学方程式为:2NaOH+H2SO4===Na2SO4+2H2O用于医药①含有Al(OH)3或Mg(OH)2的药物可以治疗胃酸过多,反应的化学方程式为:Al(OH)3+3HCl=AlCl3+3H2O;Mg(OH)2+2HCl=MgCl2+2H2O②被有些蚊虫叮咬后,皮肤肿痛,这是因为蚊虫能分泌出蚁酸,从而使皮肤肿痛。