无机物的分类及性质
- 格式:ppt
- 大小:482.00 KB
- 文档页数:22

高中化学无机物的分类全文共四篇示例,供读者参考第一篇示例:高中化学中,无机物是指除了碳氢氧氮这几种元素外的其他元素及其化合物。
在无机物中,我们会发现有很多种不同的化合物,它们具有不同的性质和用途。
为了更好地理解和研究这些无机物,我们可以将它们按不同的性质进行分类。
一、金属物质金属是化学中非常重要的一类无机物,它们具有许多共同的性质,比如导电、导热、延展性等。
金属物质可以进一步分为原子金属和金属化合物两类。
1. 原子金属:原子金属是由单质金属元素组成的物质,通常是由金属原子组成的晶格结构。
常见的原子金属有铁、铜、铝、锌等,它们在化工、建筑、电子等领域都有广泛的应用。
2. 金属化合物:金属元素与非金属元素或其他金属元素形成的化合物称为金属化合物。
金属化合物有着多种不同的结构和性质,比如金属氧化物、金属盐等。
例如氧化铁、氯化钠等都属于金属化合物。
二、非金属物质除了金属物质外,还有许多无机物是由非金属元素构成的。
非金属物质通常具有良好的电绝缘性和化学稳定性,广泛应用在化工、电子、医药等领域。
1. 硅、硼、氟等元素的化合物:非金属元素之间或与金属元素形成的化合物属于这一类别。
例如二氧化硅、氟化氢等都是常见的非金属物质。
2. 非金属氧化物:氧和非金属元素结合形成的化合物称为非金属氧化物。
这类氧化物通常具有酸性,可以在酸碱中起到重要作用。
例如二氧化硫、三氧化硫等。
三、离子类物质离子类物质是指化合物中所含的阳离子和阴离子分别来自金属元素和非金属元素。
这类物质通常具有离子键结构,具有良好的溶解度和导电性。
1. 金属盐:金属原子失去电子形成阳离子,非金属原子获得电子形成阴离子结合而成的化合物称为金属盐。
金属盐在实验室制备、药物生产等方面有广泛应用。
2. 酸、碱:酸和碱是离子类物质中的重要代表,它们可以通过离子间的交换反应产生盐和水。
酸碱反应在化学实验和工业生产中都有着重要作用。
四、氢化合物氢化合物是一类含有氢元素的无机物,通常与金属元素或非金属元素形成共价键结构。


化学物质的性质分类化学物质是组成世界万物的基本元素,它们具有不同的性质,可以根据这些性质将化学物质进行分类。
在本文中,我们将探讨化学物质的性质分类及其特点。
一、按物质组成分类1. 无机物无机物是指由无机元素组成的化学物质。
无机元素主要包括金属元素和非金属元素。
无机物的特点是在常温下大多为固体或液体,其化学性质相对稳定,不易变化。
2. 有机物有机物是指由碳元素与氢元素以及其他元素通过共价键组成的化学物质。
有机物的特点是在常温下一般为气体、液体或固体,其化学性质多样,容易发生化学反应。
二、按物质的组织结构分类1. 元素元素是由相同类型的原子组成的纯净物质。
元素的特点是化学性质相对稳定,难以分解成其他物质。
2. 化合物化合物是由不同类型的原子通过化学键结合而成的物质。
化合物的特点是具有新的物理和化学性质,可以通过化学反应分解成其他物质。
三、按物质的物理性质分类1. 固体固体是一种具有定形和定体积的物质,其分子或离子之间通过相互作用力结合在一起。
固体的特点是具有一定的硬度和强度,不易流动。
2. 液体液体是一种具有定体积但没有定形的物质,其分子或离子之间通过相互作用力保持在一定的距离上。
液体的特点是具有一定的流动性和可变形性。
3. 气体气体是一种无定形无定体积的物质,其分子或离子之间通过高速运动相互碰撞。
气体的特点是具有高度的可压缩性和可扩散性。
四、按物质的化学性质分类1. 酸酸是一类能够释放出氢离子(H+)的物质。
酸的特点是酸性物质与碱性物质发生中和反应释放出盐和水。
2. 碱碱是一类能够释放出氢氧根离子(OH-)的物质。
碱的特点是具有苦味、腥味和腻味,与酸发生中和反应释放出盐和水。
3. 盐盐是一类由阳离子和阴离子通过离子键结合而成的物质。
盐的特点是在水中可以电离产生阳离子和阴离子。
4. 氧化物氧化物是一类由氧元素与其他元素结合而成的化合物。
氧化物的特点是与氧气反应可以产生氧化和还原反应。
五、按物质的重要用途分类1. 基础化学物质基础化学物质是指广泛用于制造其他化学品的原始原料。
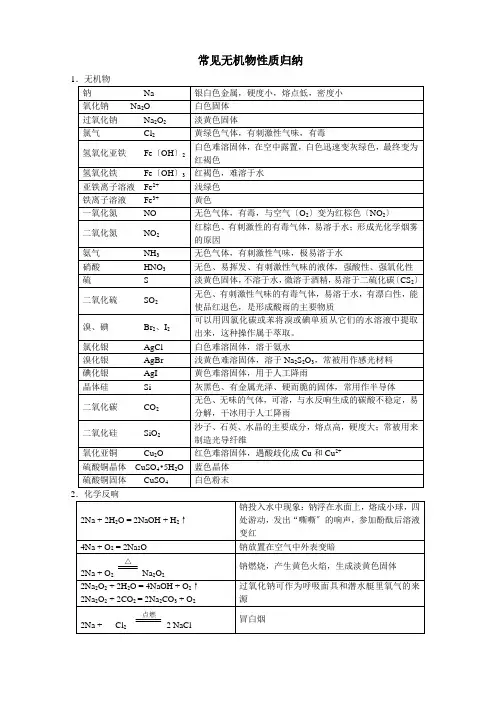
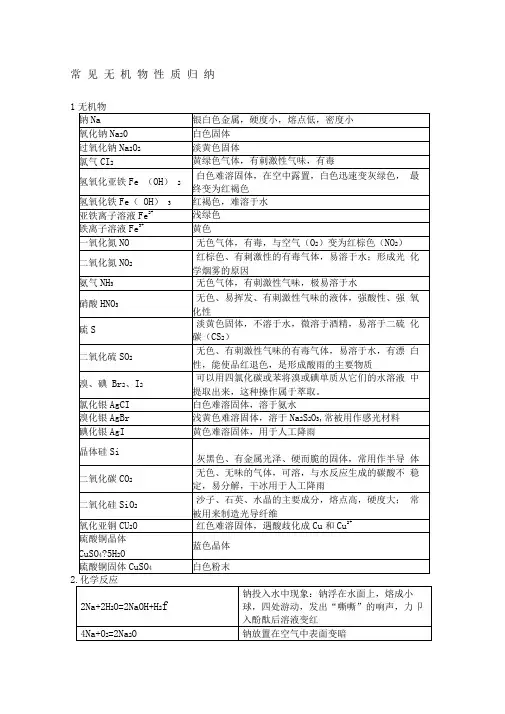
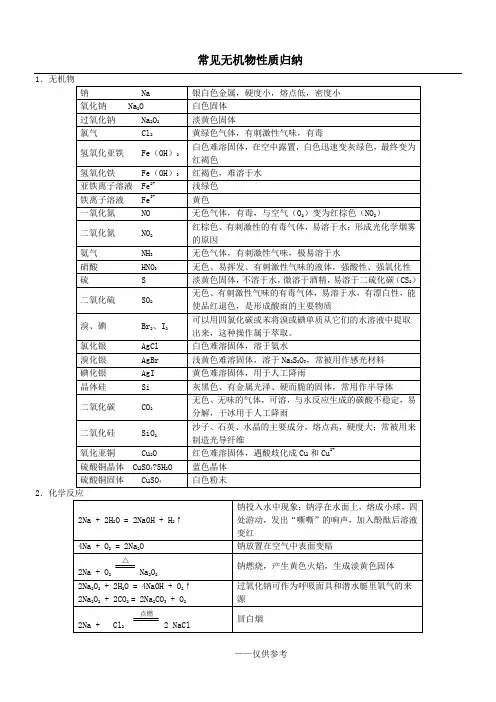
常见无机物性质归纳12Fe + 3Cl 2点燃2FeCl 3 产生棕黄色的烟 Cu + Cl 2点燃CuCl 2 产生棕色的烟 H 2 + Cl 2点燃2HCl产生苍白色火焰Cl 2 + H 2O = HCl + HClOHClO 不稳定,有强氧化性,可做漂白剂,Cl 2可用作漂白剂〔Cl 2不能使枯燥的红纸条退色〕 Cl 2 + 2NaOH = NaCl + NaClO + H 2O制漂白精Cl 2 + 2CaOH = CaCl 2 + Ca 〔ClO 〕2+ H 2O 工业制漂白粉,漂白粉的成分CaCl 2 和 Ca 〔ClO 〕2,有效成分为Ca 〔ClO 〕2 4Fe(OH)2 + O 2 + 2H 2O = 4Fe(OH)3 白色沉淀迅速变成灰绿色,最后变成红褐色 Fe 3+ + 3SCN -= Fe(SCN)3 红色溶液,可用KSCN 、NH 4SCN 溶液检验Fe 3+ Fe + 2H + = Fe 2+ + H 2↑ Fe 具有复原性 2Fe 3+ + Fe = 3Fe 2+Fe 3+具有氧化性Fe 2+ + Zn = Fe + Zn 2+2Fe 2+ + Cl 2 = 2Fe 3+ + 2Cl -Fe2+既有氧化性又有复原性 Na 2CO 3 + 2HCl = 2NaCl + H 2O + CO 2↑ NaHCO 3 + HCl = NaCl + H 2O + CO 2↑ NaHCO 3 + NaOH = Na 2CO 3 + H 2O 2NaHCO 3 △Na 2CO 3 + H 2O + CO 2↑N 2 + O 22NON 2 + 3H 2催化剂 高温高压2NH 3使空气中游离态的氮转化为含氮化合物叫做氮的固定〔固氮〕2NO + O 2 = 2NO 2 3NO 2 + H 2O = 2HNO 3 + NO NH 3 +H 2O = NH 3·H 2ONH 3·H 2O NH 4+ + OH -NH 3·H 2O 呈弱碱性,氨水能使酚酞溶液变红 NH 3 + HCl = NH 4Cl 产生白烟4NH 3 + 5O 2 催化剂△4NO + 6H 2O NH 4HCO 3△ NH 3↑ + H 2O + CO 2↑ NH 4Cl△NH 3↑ + HCl ↑NH 4+ + OH -△NH 3↑+ H 2O 〔用于检验铵根离子〕2NH 4Cl+Ca(OH)2 △CaCl 2 +2NH 3↑+ 2H 2O实验室制氨气,用湿润的红色石蕊试纸检验氨气是否收集满4HNO 34NO 2↑ + O 2↑ + 2H 2O为了防止硝酸见光分解,一般将它保存在棕色试剂瓶里,不能用胶塞 Cu + 4HNO 3(浓) = Cu(NO 3)2 + 2NO 2↑ + 2H 2O 常温下,浓硝酸可使铁、铝钝化3Cu + 8HNO 3(稀)= 3Cu(NO 3)2 + 2NO ↑+ 4H 2O C + 4HNO 3(浓)△CO 2↑+ 2NO 2↑+ 2H 2O 浓、稀硝酸有强氧化性Fe + S △ FeS S + O 2 点燃SO 2 SO 2 + O 2催化剂 加热2SO 3 2H 2S + SO 2 = 3S + 2H 2OCu + 2H 2SO 4(浓) △CuSO 4 + SO 2↑+ 2H 2O 在常温下,浓硫酸使铁、铝钝化 C + 2H 2SO 4(浓) △CO 2↑+ 2SO 2↑+ 2H 2O浓硫酸表现强氧化性 2Mg + CO 2点燃2MgO + C受热或见光放电有机物苯与液溴在铁粉〔FeBr 3〕作催化剂时反响生成溴苯和HBr乙醇 构造:CH 3CH 2OH 〔—OH 称为羟基〕 乙醇俗称酒精,是优良的有机溶剂乙酸构造:CH 3 〔—COOH 称为羧基〕 乙酸俗称醋酸,有酸性,能使紫色的石蕊溶液变红油脂 油脂可用来制取高级脂肪酸和甘油糖类由C 、H 、O 三种元素组成糖类分为单糖〔不水解,如葡萄糖、果糖〕、二糖〔如蔗糖、麦芽糖〕、多糖〔如淀粉、纤维素〕,淀粉水解最终生成葡萄糖 蛋白质属于有机高分子化合物,水解生成氨基酸浓的盐溶液会使蛋白质从溶液中析出,不影响蛋白质的生理活性;紫外线照射、加热或参加有机化合物、酸、碱、重金属盐〔如铜盐、铅盐、汞盐等〕会使蛋白质聚沉,蛋白质失去生理活性。

无机物和有机物的分类无机化学是研究无机物质的组成、性质、结构和反应的科学。
它是化学中最古老的分支学科。
无机物质包括所有化学元素和它们的化合物~不过大部分的碳化合物除外。
,除二氧化碳、一氧化碳、二硫化碳、碳酸盐等简单的碳化合物仍属无机物质外~其余均属于有机物质。
,无机物主要包括:单质和无机化合物。
单质又包括金属单质,如:铁、铜、锌等,和非金属单质,如:氢气、氧气、氮气、碳、硅等,无机化合物主要包括:氧化物,如:一氧化碳、二氧化碳、一氧化硫、氧化铁、三氧化铁,、无机酸,如:硫酸、盐酸、硝酸,、碱,如:氢氧化钠、氢氧化钙,、无机盐,如:氯化钠、碳酸钙、硫酸钠,等。
有机化合物的现代定义为:碳氢化合物及其衍生物。
主要包括烃类及其衍生物。
烃类包括:主要包括烷烃,如:甲烷、乙烷、己烷,、烯烃,如:乙烯,、炔烃,如:乙炔,、芳香烃,如:苯、甲苯、蒽、萘, 烃的衍生物包括:醇,如:甲醇、乙醇,、醚,如:乙醚,、醛,如:甲醛,、酮,如:丙酮,、羧酸,如:乙酸,、酯,如:乙酸乙酯,、胺,如:甲胺、苯胺,、酰胺,如:尿素,、杂环类,如:呋喃、糠醛,、核酸和核糖核酸。
玛纳斯:金信化工:硫酸、硫磺、二硫化碳,澳洋科技:液氯、硫酸、氢氧化钠、二硫化碳, 澳洁:硫氢化钠舜泉化纤:液氯、硫酸、氢氧化钠、二硫化碳, 呼图壁县:鸿新石化:凝析油、BTX,苯、甲苯、二甲苯,, 鑫联煤:高温煤焦油、萘、燃料油昌吉市:金茂化工:溶剂油、甲苯,海龙化工:甲醇,锐源通化工:甲醇、甲醛,丰达磷:硫酸,中粮屯河:酒精,焰山乙炔:电石、丙酮、乙炔,屯河聚酯: 1、4—丁二醇~四氢呋喃,低闪点易燃液体,~对苯二甲酸~阜康市:中泰矿业:电石、氧化钙,阜康冶炼厂:液氯、硫酸,吉木萨尔县:派犨型材:电石、氧化钙,庆华:粗苯。

高中化学无机物高中化学教学中,无机物是一个重要的知识点,它包括无机酸、碱、盐和氧化物等多种物质。
无机物是指由金属元素、非金属元素或金属元素与非金属元素组成的化合物,其结构稳定,不易发生化学变化。
本文将重点探讨高中化学无机物的性质、分类及应用。
一、性质1. 无机酸:无机酸是一类含有H+离子的化合物,具有酸性,能与碱发生中和反应。
常见的无机酸有硫酸、盐酸、硝酸等。
无机酸的酸性大小与其离子解离的程度有关,离子解离度越高,酸性越强。
2. 碱:碱是一类含有OH-离子的化合物,具有碱性,能与酸发生中和反应。
常见的碱有氢氧化钠、氢氧化钾等。
碱的碱性大小与其提供的氢氧离子的数量有关,提供的氢氧离子越多,碱性越强。
3. 盐:盐是由金属离子与非金属离子或者两种非金属离子组成的化合物,具有各种不同的性质。
常见的盐有氯化钠、硫酸钠、硫酸铜等。
盐的性质取决于其组成离子的种类和数量。
4. 氧化物:氧化物是一类含有氧元素的化合物,与其他物质发生氧化还原反应。
常见的氧化物有氧化铁、氧化铝、氧化钙等。
氧化物的性质与其中金属元素的氧化态有关,氧化态越高,氧化性越强。
二、分类无机物可以根据其成分和性质进行分类,主要分为无机盐、弱酸、强酸、弱碱、强碱等几种类型。
其中,无机盐是最常见和广泛应用的一类无机物,广泛应用于生活和工业生产中。
1. 无机盐:无机盐是由金属离子和非金属离子或者两种非金属离子组成的化合物,其具有各种不同的性质。
常见的无机盐有氯化钠、硫酸钠、硫酸铜等。
无机盐在农业、医药、化工等领域有着重要的应用价值。
2. 弱酸:弱酸是指离子解离程度较低,酸性较弱的无机酸。
常见的弱酸有碳酸、硼酸等。
弱酸通常在实验室中用于制备其他化合物或作为试剂使用。
3. 强酸:强酸是指离子解离程度较高,酸性较强的无机酸。
常见的强酸有硫酸、盐酸、硝酸等。
强酸在工业生产中有着广泛的应用,如用于废水处理、金属清洗等。
4. 弱碱:弱碱是指提供氢氧离子较少,碱性较弱的化合物。

有机物和无机物1. 引言有机物和无机物是化学领域中最基本的分类之一。
两者在组成、性质和用途上存在很大的差异。
本文将介绍有机物和无机物的定义、特点和区别,并对它们在化学和生活中的重要性进行讨论。
2. 定义2.1 有机物有机物是由碳原子构成的化合物。
在过去,人们认为有机物只存在于生物体中,因此称为有机物。
然而,随着化学的发展,人们发现许多人工合成的化合物也被归类为有机物。
有机物通常包含碳、氢和氧等元素,并且可以含有其他元素,如氮、硫和磷。
2.2 无机物无机物是除了碳以外的化合物。
它们通常不包含碳-碳键或碳-氢键。
无机物可以包括无机酸、无机盐、金属和非金属化合物。
3. 特点和区别3.1 特点•有机物的特点:–通常具有较低的熔点和沸点。
–大多数有机物是可燃的。
–有机物可以通过化学反应进行合成和分解。
–有机物通常具有更复杂的结构,可以形成大量的同分异构体。
•无机物的特点:–无机物的熔点和沸点较高。
–大多数无机物是不可燃的。
–无机物通常通过物理改变进行制备,如混合、析出和晶化。
–无机物的结构相对简单,同一种化合物通常只有一种结构。
3.2 区别虽然有机物和无机物之间存在一些相似之处,但它们在以下方面有明显的区别:•化学结构: 有机物通常具有碳元素和碳键,而无机物不含碳键。
•来源: 有机物可以来自生物体,也可以通过人工合成,而无机物主要来自矿物和无机合成。
•溶解性: 许多有机物具有较高的溶解度,而无机物的溶解度通常较低。
•熔点和沸点: 有机物的熔点和沸点通常较低,无机物较高。
•反应性: 有机物通常参与有机化学反应,而无机物通常参与无机化学反应。
4. 重要性4.1 有机物的重要性•生命进程: 有机物是构成生物体的基本化合物。
生物体中的蛋白质、脂肪、碳水化合物等都是有机物。
•医药和药物研究: 许多药物是有机物,有机合成在药物研究和制药领域中扮演着重要角色。
•材料科学: 有机材料如塑料、橡胶和纤维等在日常生活中得到广泛应用。

新高一生物无机物知识点一、无机物的概念与分类无机物是指没有碳-碳化合物键(C-C)的化合物,包括无机酸、无机盐和无机气体等。
在自然界中,无机物广泛存在于地壳、海洋和大气中。
二、常见无机物的性质与应用1. 无机酸:无机酸是指以氢作为阳离子的酸,如硫酸、盐酸等。
它们具有电离性和腐蚀性,常用于实验室化学分析、工业生产和草坪施肥等领域。
2. 无机盐:无机盐是由阳离子和阴离子组成的化合物,如氯化钠、硫酸钠等。
无机盐在生活中广泛应用于食品调味、肥料施用、医药制剂和水处理等方面。
3. 无机气体:无机气体指没有碳-碳键的气体,如氧气、氮气等。
这些气体在自然界中十分重要,氧气参与呼吸过程,氮气是生物体和植物的重要营养元素。
三、水和无机物的关系水是一种无机化合物,是地球上最常见的无机物质。
它具有许多独特的性质和重要的生物学意义。
1. 水的溶解性:水是一种极好的溶剂,对无机物和有机物均有良好的溶解性。
这一特性使得水成为生物体内许多化学反应的基础。
2. 水的凝固与沸腾:水的凝固点为0℃,沸腾点为100℃,这一范围是地球上生物体生活的温度范围。
水的凝固与沸腾对维持地球生态系统的平衡至关重要。
3. 水的表面张力:水具有较大的表面张力,这使得一些生物在水面上能够行走或滑行,如昆虫的水面行走和水滴在叶片上的滑落。
四、常见无机物的循环与生态意义1. 碳循环:碳是生物体构成有机物的基本元素,其循环过程包括生物体的呼吸、光合作用和分解等。
碳循环对维持生物体的能量供应和生态平衡起着重要作用。
2. 氮循环:氮是组成蛋白质和核酸的重要元素,其循环包括氮的固定、氮的脱氮和氮的释放等过程。
氮循环对植物的生长发育和土壤的肥力具有重要影响。
3. 氧循环:氧是许多生物体进行呼吸的必需气体,通过水和气体的相互转换,氧可以在大气、海洋和生物体之间循环。
五、无机物对环境的影响1. 酸雨:大气中的氮氧化物和硫氧化物在空气中与水蒸气反应生成不溶于水的硫酸和硝酸,从而形成酸雨。
高三有机物无机物知识点有机物和无机物是化学里两个重要的概念,它们有着不同的特征和性质。
在高三化学学习中,掌握有机物和无机物的知识点对于学生来说至关重要。
本文将详细介绍有机物和无机物的定义、特征以及它们的区别和应用。
一、有机物的定义和特征有机物是由碳和氢元素组成的化合物,通常还包含其他元素,如氧、氮、硫、磷等。
它们可以是天然的,也可以是合成的。
有机物的特征包括以下几个方面:1. 含碳:有机物中都含有碳元素,碳原子有着独特的能力形成稳定的共价键,与其他原子或分子形成链状、环状或支链结构。
2. 多样性:有机物的种类非常多,可能包括烃类、醇、醛、酮、酸、酯、胺、醚等。
3. 反应活性:有机物的反应活性很高,可以进行许多有机化学反应,如取代、加成、消除、重排等。
4. 易燃易爆:由于有机物中含有碳氢键和碳碳键等易于断裂的键,因此有机物通常易燃易爆。
二、无机物的定义和特征无机物是由除碳以外的元素组成的化合物,可以是天然的也可以是合成的。
无机物的特征如下:1. 不含碳:无机物中不包含碳元素,或者只含有极少量的碳元素。
2. 简单性:无机物通常具有较简单的结构,由离子、原子或分子组成。
3. 反应活性:无机物的反应活性相对有机物较低,常见的反应包括氧化还原、酸碱中和等。
4. 稳定性:无机物的稳定性较高,能在较高的温度和压力下维持稳定的结构。
三、有机物和无机物的区别有机物和无机物在特征和性质上存在明显差异,主要表现在以下几个方面:1. 元素组成:有机物由碳和氢元素组成,通常还包含其他元素,而无机物中除碳以外可以包含任何其他元素。
2. 反应活性:有机物的反应活性很高,无机物的反应活性较低。
3. 结构复杂性:有机物具有较复杂的结构,无机物结构相对简单。
4. 稳定性和燃烧性:有机物易燃易爆,无机物通常稳定不易燃烧。
四、有机物和无机物的应用有机物和无机物在生活和工业中有广泛的应用。
以下列举几个常见的应用领域:1. 有机物应用:有机物广泛应用于制药、染料、涂料、塑料、化妆品、香料等行业,以及生物化学和医学等领域。
化学物质的分类与性质化学是一门研究物质变化的科学,而化学物质是构成物质世界的基本单位。
化学物质种类繁多,根据其组成和性质的不同,可以将化学物质进行分类。
本文将详细介绍化学物质的分类及其特性。
一、基本概念化学物质指的是由原子或分子组成的物质。
原子是构成化学物质的基本单位,而分子则是由原子通过化学键结合而成。
化学物质在自然界中广泛存在,包括了我们常见的水、氧气、铁、盐等等。
二、化学物质的分类根据其组成和属性的不同,化学物质可以分为无机物和有机物两大类。
1. 无机物无机物主要由无机元素组成,如金属元素、非金属元素等。
无机物的特点是结构简单,化学性质相对稳定。
常见的无机物包括水、盐、酸、碱等。
(1)金属物质:具有典型金属性质,如导电导热,延展性强等特点。
常见的金属有铁、铜、铝等。
(2)非金属物质:具有不同于金属的物质性质,如脆性、不导电等。
常见的非金属有氧气、硫、氯等。
2. 有机物有机物主要由碳元素和其他元素组成,其中碳元素是构成有机物的基础。
有机物的特点是结构复杂,化学性质较为活泼,可与其他物质发生各种反应。
常见的有机物包括石油中的烃类、酒精、葡萄糖等。
三、化学物质的性质不同的化学物质具有不同的性质,下面将以常见的化学物质为例进行介绍。
1. 水水是一种重要的无机物质,具有以下性质:(1)物理性质:水在常温下呈现液态,沸点为100摄氏度,密度为1g/cm³。
(2)化学性质:水是一种良好的溶剂,可以溶解许多物质。
同时,水也是一种中和剂,可以中和酸碱物质。
2. 铁铁是一种有机物质,具有以下性质:(1)物理性质:铁是一种具有金属光泽的固态物质,导电导热性能良好。
(2)化学性质:铁在潮湿的环境中容易生锈,与氧气反应生成铁锈。
此外,铁还可以与酸反应产生氢气。
3. 葡萄糖葡萄糖是一种常见的有机物质,具有以下性质:(1)物理性质:葡萄糖是一种白色结晶体,可溶于水,呈现甜味。
(2)化学性质:葡萄糖可与酸反应生成酸酐,同时也可被微生物发酵产生酒精。
化学物质分类一、简介化学物质是构成物质的基本单位,根据其化学性质和分子结构的不同,可以将化学物质分为不同的类别。
化学物质的分类有助于我们更好地理解其特性和用途,为化学领域的研究和应用提供了基础和指导。
二、按化学性质分类根据化学性质的不同,化学物质可以分为无机物和有机物。
### 1. 无机物无机物是指不含有碳-碳键的化合物,主要包括金属、非金属及其化合物。
- 金属:具有良好的导电性和热导性,常见金属有铁、铜、铝等。
- 非金属:不具有金属的特性,包括氢气、氧气、氯气等。
### 2. 有机物有机物是由碳元素和氢元素以及其他元素构成的化合物,具有较为复杂的分子结构。
- 烃类:含有碳氢键的化合物,包括烷烃、烯烃、炔烃等。
- 醇类:含有羟基的有机化合物,如甲醇、乙醇等。
-酮类:含有羰基的有机化合物,如丙酮、戊酮等。
三、按分子结构分类化学物质也可以根据其分子结构的不同进行分类。
### 1. 离子化合物离子化合物是由阳离子和阴离子通过电荷吸引力结合形成的化合物,如氯化钠、硫酸铜等。
### 2. 共价化合物共价化合物是由共用电子对相互结合形成的化合物,如水、二氧化碳等。
### 3. 金属间化合物金属间化合物是由两种或多种金属元素形成的化合物,如合金等。
四、按用途分类化学物质还可以根据其用途和性质进行分类。
### 1. 化工原料化工原料是用于生产化学品的原材料,包括有机化合物和无机化合物,如乙烯、氢氧化钠等。
### 2. 医药化工医药化工是用于制备药物的化学物质,包括药物原料、中间体等。
### 3. 农药化工农药化工是用于防治农作物病虫害的化学物质,包括杀虫剂、杀菌剂等。
五、结语化学物质的分类是化学学科的基础,通过对化学物质的分类,我们可以更好地理解化学世界的奥秘,推动化学科学的发展和应用。
希望本文的介绍能够帮助读者更深入地了解化学物质的分类及其重要性。
[无机物】无机物是无机化合物的简称,通常指不含碳元素的化合物。
少数含碳的化合物,如一氧化碳、二氧化碳、碳酸盐、氰化物等也属于无机物。
无机物大致可分为氧化物、酸、碱、盐等。
【有机物】定义有机物通常指含碳元素的化合物,或碳氢化合物及其衍生物总称为有机物。
说明1.有机物是有机化合物的简称。
目前人类已知的有机物达900多万种,数量远远超过无机物。
2.早先,人们已知的有机物都从动植物等有机体中取得,所以把这类化合物叫做有机物。
到19世纪20年代,科学家先后用无机物人工合成许多有机物,如尿素、醋酸、脂肪等等,从而打破有机物只能从有机体中取得的观念。
但是,由于历史和习惯的原因,人们仍然沿用有机物这个名称。
3.有机物一般难溶于水,易溶于有机溶剂,熔点较低。
绝大多数有机物受热容易分解、容易燃烧。
有机物的反应一般比较缓慢,并常伴有副反应发生。
4.有机物种类繁多,可分为烃和烃的衍生物两大类。
根据有机物分子中所含官能团的不同,又分为烷、烯、炔、芳香烃和醇、醛、羧酸、酯等等。
根据有机物分子的碳架结构,还可分成开链化合物、碳环化合物和杂环化合物三类。
5.有机物对人类的生命、生活、生产有极重要的意义。
地球上所有的生命体中都含有大量有机物。
有机物与无机物的主要区别无机物与有机物在性质及反应上的差别只是相对的、有条件的,不同的有机物有其特殊的性质。
例如,乙醇、乙酸、乙醛、丙酮能与水以任意比互溶;四氯化碳、二氟二溴甲烷等有机物不但不能燃烧,反而可以用来灭火;乙酸及其金属盐能在水溶液中电离;三氯乙酸是一种强酸;有些反应,如烷烃的热裂解和三硝基甲苯的爆炸都是瞬间完成的,等等。
【无机物】无机物是无机化合物的简称,通常指不含碳元素的化合物。
少数含碳的化合物,如一氧化碳、二氧化碳、碳酸盐、氰化物等也属于无机物。
无机物大致可分为氧化物、酸、碱、盐等。
【有机物】定义:有机物通常指含碳元素的化合物,或碳氢化合物及其衍生物总称为有机物。
1.有机物是有机化合物的简称。