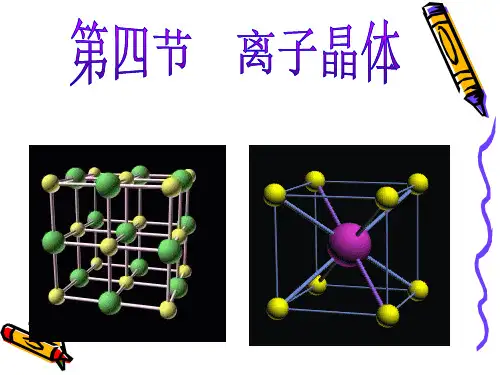
①钠离子和氯离子位于立方体的顶角上,并交错排列
与②N氯a离+等子距:计体离心算且和方棱最法中近:均点的摊;N钠法a+离有子::12面个心和顶点,或 与者N反a之+等,距氯离离子且与最钠近离的子C交l-换有位:6置个也可以
与Na+距离最近且 相等的Cl-所围成 的空间几何构型 是 正八面体____。
2、CaF2 晶体中正离子的配位数8,负离子的配
位数为 4 。
TiO2晶体中正离子的配位数为6,负离子的配
位数为多少?3
ZnS晶体中负离子的配位数是4,正离子的配位
数为多少? 4
3、如下图,在氯化钠晶体中,与
每个Na+等距离且最近的几个Cl-
所围 成的空间几何构型〔B 〕
A、十二面体
B、正八面体
C、正六面体
表示分子式。
5. 离子晶体物理性质的特点:
(1) 熔沸点 较高 , 难挥发难压缩。
离子电荷越多,阴、阳离子半径越小,熔沸点越高。 (2) 硬度 较大 。 (3) 水溶性 一般易溶于极性溶剂水,而难溶于非极性溶剂。 (4) 导电性
固态不导电,水溶液或者熔融状态下能导电。
。 离强子 键 越 强 , 破 坏 它 所 需 能 量 就 越 。熔点大就越 。 高
7、离子键的特征
• 没有方向性: • 阴阳离子是球形对称的,电荷的分布也是
球形对称的,它们在空间各个方向上的静电 作用相同,都可以和带不同电荷的离子发生 作用 • 没有饱和性: • 在静电作用能到达的范围内,只要空间条 件允许,一个离子可以多个离子发生作用
第三章 晶体结构与性质
第四节 离子晶体
学习目标:
• 1、理解离子晶体的结构模型及其性质的一 般特点。