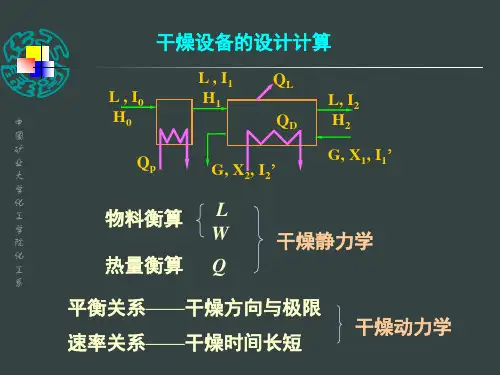
5热量衡算解析
- 格式:ppt
- 大小:2.39 MB
- 文档页数:65

化工原理物料衡算和热量衡算引言化工工程涉及许多物料的处理和转化过程,同时也需要考虑热量的平衡。
物料衡算和热量衡算是化工原理的重要内容,对于工程实践和过程优化具有重要的意义。
本文将介绍化工原理中的物料衡算和热量衡算的基本原理和计算方法。
物料衡算物料衡算是指对于化工工程中物料流动和转化过程的计算和分析。
在化工工程中,物料的流动和转化是实现各种反应和分离操作的基础,因此正确的物料衡算是保证工程设计和操作的关键。
在物料衡算中,我们通常需要考虑以下几个方面: 1. 物料的质量衡算:即对物料的质量输入和输出进行计算和分析。
对于物料的质量衡算,我们需要注意物料流动的平衡原则,即质量的输入必须等于输出。
2. 物料的能量衡算:即对物料的能量输入和输出进行计算和分析。
能量的输入和输出会影响物料的温度和相变过程,因此在能量衡算中需要考虑物料的热力学性质。
3. 物料的流动速度衡算:即对物料流动速度进行计算和分析。
物料的流动速度决定了反应和分离操作的效率,因此在物料衡算中需要合理地确定流量和速度的关系。
4. 物料的浓度衡算:即对物料中组分浓度的计算和分析。
物料的浓度会影响其反应和分离的速率和效果,因此在物料衡算中需要考虑不同组分浓度的变化规律。
物料衡算通常使用质量守恒和能量守恒等基本原理进行计算。
同时,还可以利用化学反应平衡的原理和质量流动的平衡原则进行衡算过程中的参数确定。
热量衡算热量衡算是化工工程中热力学过程的计算和分析。
在化工工程中,热量的平衡是保证反应和分离操作能够正常进行的基础。
热量衡算需要考虑以下几个方面: 1. 热量的输入和输出:即对于热量的输入和输出进行计算和分析。
在化工工程中,我们通常需要对热量的输入和输出进行平衡,以保证工程操作的稳定性。
2. 热量的传递和转化:即对于热量的传递和转化过程进行计算和分析。
热量的传递可以通过传导、对流和辐射等方式进行,因此在热量衡算中需要考虑传热方式的影响。
3. 热平衡的计算:即对于反应和分离过程中热量平衡的计算和分析。

热量衡算主要依据是能量平衡方程ΣQ in=ΣQ out +ΣQ其中ΣQ in输入设备流量ΣQ out +输出设备流量ΣQ为损失流量对于连续系统:Q+W=ΣH out +ΣH其中。
Q为设备热负荷W为输入系统的机械能ΣH out 离开设备的各物料焓之和ΣH进入设备的各物料焓之和在进入全厂能量横算时,是以单位设备为基本单位,考虑由机械能转换、化学反应释放和单纯的物理变化带来的能量变化,最终对全工艺段进行系统级的能量平衡计算,进而用于指导节能降耗设计工作。
热量衡算任务1、确定加热剂和冷却剂的用量2、计算有设备传递的热量,为设备设计提供依据3、提高热量应用水平4、最终确定总需求能量和能量费用各工段其热量衡算如下萃取精馏段:第一萃取精馏塔物流焓变一览表流股名反应前物流反应后物流温度(℃)60/6044/110压力(Kg/sqcm)7.767/6.118 5.099/6.099质量流量(Kg/hr)41600/2710017320/295280焓值(KW)-2575.31068.09热负荷一览表Q热负荷(Kw)—8296.9热量平衡一览表Q IN OUT Error -8296.9 -2575.3 1068.09 -1.241汽提塔物流焓变一览表流股名反应前物流反应后物流温度(℃)118.1/110.1/135.0108.4/134.4压力(Kg/sqcm)7.000/6.099/5.166 5.166/5.167质量流量(Kg/hr)37970.026/295280.000/7.04087E+623999.999/7.35012E+6焓值(KW)14050311412557热负荷一览表Q热负荷(Kw)—9789.0065热量平衡一览表Q IN OUT Error -9789.0065 1405031 1412557 -0.00533闪蒸塔物流焓变一览表流股名反应前物流反应后物流压力(Kg/sqcm) 5.167 5.166/5.166质量流量(Kg/hr)7.35012E+6202622.872/7.04087E+6焓值(KW)1407162.091435001.24热负荷一览表Q热负荷(Kw)46985.4228热量平衡一览表Q IN OUT Error 46985.4228 1407162.09 1435001.24 -0.0194第二萃取精馏塔物流焓变一览表流股名反应前物流反应后物流压力(Kg/sqcm) 5.000/5.160 3.071/3.059质量流量(Kg/hr)36000.000/23999.99937970.026/22030.029焓值(KW)3895.678174103.97348热负荷一览表Q热负荷(Kw)-4281.0457热量平衡一览表Q IN OUT Error -4281.0457 3895.67817 4103.97348 -0.0507545第一精馏塔物流焓变一览表流股名反应前物流反应后物流温度(℃)92.241.6/55.8压力(Kg/ sqcm) 3.059 5.099/5.099质量流量(Kg/hr)22030.029990.029/21040.000焓值(KW)12503.739251.09429热负荷一览表Q热负荷(Kw)-516.35568热量平衡一览表Q IN OUT Error -516.35568 12503.73 9251.09429 0.26013323第二精馏塔物流焓变一览表流股名反应前物流反应后物流(顶/釜)温度(℃)70.143.1/55.4压力(atm) 5.92 4.74/5.42质量流量(Kg/hr)19758.483419087.1667/671.3167焓值(KW)11111.0668 8876.86583热负荷一览表(KW)Q热负荷-9642.5248热量平衡一览表(KW)Q IN OUT Error -9642.524811111.06688876.86583-0.201079。

3 物料衡算和热量衡算计算基准年产 4500 吨的二氯甲烷氯化吸取,年工作日 330 天,每天工作 24 小时,每 小时产二氯甲烷:物料衡算和热量衡算反响器的物料衡算和热量衡算本反响为强放热反响,如不把握反响热并移走,温度会急剧上升,产生猛烈的燃烧反响, 是氯化物发生裂解反响。
由此可以通过参与过量的甲烷得到循环气,以之作为稀释剂移走反 应热。
〔一〕 计算依据〔1〕 二氯甲烷产量为: kg/h ,即: kmol/h ; 〔2〕 原料组成含: Cl 2 96%,CH 495%;(3) 进反响器的原料配比〔摩尔比〕: Cl 2:CH 4:循环气=1: (4) 出反响器的比例: CH 2Cl 2:CHCl 3=1:〔质量比〕(CHCl 3+CCl 4)/CH 2Cl 2=〔摩尔比〕;(5) 操作压力: 〔表压〕;(6) 反响器进口气体温度 25o C ,出口温度 420o C 。
〔二〕 物料衡算反Cl 2应CH 3Cl CH 2Cl 2 CHCl 3CH 4CCl 4 HCl假设循环气不参与反响,只起到带走热量的作用。
则设进口甲烷为 X kmol/h ,=h出反响器的一氯甲烷Y kmol/h,氯化氢Z kmol/h。
由进反响器的原料配比〔摩尔比〕Cl2:CH4:循环气=1:原料组成含: Cl2 96%,CH495%。
由CH2Cl2:CHCl3=1:〔质量比〕可得CHCl3每小时产量为:×=h由(CHCl3+CCl4)/CH2Cl2=〔摩尔比〕可得CCl4的量为×-=h用元素守衡法则:Cl 元素守衡=Y+×2+×3+×4+Z ①H 元素守衡4X=3Y+×2++Z ②C 元素守衡X=Y+++ ③解方程①①③得X=hY=hZ=h (1)所以反响器进口原料中各组分的流量:Cl2: ×=h=h 〔纯〕=h=h 〔含杂质〕CH4: h=h 〔纯〕=h=h 〔含杂质〕循环气流量:3×= kmol/h= Nm3/h其中:CH3Cl:kmol/hN2:×4%+×3%= kmol/hCO2:×2%= kmol/h可知:= 得进口Cl2为kmol/h3 CH 4:---= kmol/h进口气体总量: ++= kmol/h(2) 反响器出口中各组分流量:CH 3Cl : kmol/h CH 2Cl 2: kmol/h CHCl 3 : kmol/h CCl 4: kmol/h HCl : kmol/h 循环气: kmol/h出口气体总量:++++= kmol/h(3) 出口气体中各组分的含量:CH 3Cl : ×100%=%CH 2Cl 2:×100%=%CHCl : ×100%=% CCl 4: ×100%=% HCl : ×100%=% N 2:×100%=%CO 2: ×100%=% CH 4: ×100%=%表 3—1 反响器物料平衡组分kmol/h反响器进口组成%〔mol 〕 kg/h反响器出口kmol/h组成%〔mol 〕 kg/hCH 4 Cl 2 CH 3Cl CH 2Cl 22 2CHCl 3 CCl 4 HClN 2 CO 2 总计100 100〔三〕 热量衡算以 25℃为基准温度由《氯碱工业理化常数手册》查得如下数据:420℃时,由《氯碱工业理化常数手册》查得如下数据:物质n(kmol)CH 3ClCH 2Cl 2CHCl 3CCl 4HClN COΔt = 420-25=395℃输入焓:∑输入H = 0表 3—2 反响物料标准摩尔生成焓Δf/〔kJ/mol 〕 物质输入 输出CH 4Cl 2CO 2CH 3Cl CH 2Cl 2 CHCl 3 CCl 4HCln(kmol) Δf0 -100Δ f =∑ 生成物 n Δ H θ-∑ f m 反响物n Δ H θ=-×106 kJ f m 表 3—3 生成物的标准摩尔定压热容/(J ﹒K -1﹒mol -1)输出焓:∑ 输出 H = ∑nΔt = ×106 kJ℃时,由《氯碱工业理化常数手册》查得如下数据:物质n(kmol) CH4CH3Cl N2CO2考虑4%热损失,则×106×〔1-4%〕=则Q = Q放出带出循环气能带走的热量恰好为反响气放出的热量,是反响温度保持在420℃左右可以维持反响顺当进展。


第二章 能量衡算2.1 能量衡算概述物料衡算完成后,对于没有传热要求的设备,可以由物料处理量,物料的性质及工艺要求进行设备的工艺设计,以确定设备的型式,台数,容积以及重要尺寸。
对于有传热要求的设备则必须通过能量衡算,才能确定设备的主要工艺尺寸。
无论进行物理过程的设备或是化学过程的设备,多数伴有能量传递过程,所以必须进行能量衡算。
2.2 能量衡算目的对于新设计的生产车间,能量衡算的主要目的是为了确定设备的热负荷。
根据设备热负荷的大小,所处理物料的性质及工艺要求在选择传热面的型式,计算传热面积,确定设备的主要尺寸。
传热所需要的加热剂或冷却剂的用量也是以热负荷的大小为依据而进行计算的。
对于有些伴有热效应的过程,其物料衡算也要通过与能量衡算的联合求解才能得出最后的结果。
2.3 能量衡算依据能量衡算的主要依据是能量守恒定律。
能量守恒定律是以车间物料衡算的结果为基础而进行的。
2.4 能量衡算过程 2.4.1 反应釜的热量衡算反应工段的热量衡算主要体现在反应釜和夹套。
对于有传热要求的的设备,其热量衡算为:654321Q Q Q Q Q Q ++=++;式中 1Q —物料带入到设备的热量kJ ; 2Q —加热剂传给设备的热量kJ ; 3Q —物理变化及化学反应的热效应kJ ; 4Q —物料离开设备所带走的热量kJ ; 5Q —消耗于提高设备本身温度的热量kJ ; 6Q —设备向环境散失的热量kJ 。
物料热量衡算以天为单位。
1Q 与4Q 的计算1Q 与4Q 均可按照下式计算:()tkJ mc Q Q p ∑=41式中m —输入或输出设备的物料量,kgp c —物料的平均比热容,()C kg kJ ︒⋅/t —物料的温度,℃。
该式的计算标准是标准状态,即Pa C 3101013.10⨯︒及为计算标准。
固体和液体的比热容可以采用下式计算:Mn c c p∑⋅=α184.4; []1式中:αc —元素的原子比热容,()C kg kJ ︒⋅/ ;n —分子中同一原子的原子数;M —化合物的分子量,kmol kg /。



5 热量衡算5.1 合成塔热量衡算相关计算式全塔热平衡方程式为:∑Q 1 +∑Qr = ∑ Q 2 + ∑Q 3 +Q 4 (式5.1) 式中: Q 1——入塔气各气体组分热量,kJ/hQr ——合成反应和副反应的反应热,kJ/h Q 2 —— 出塔气各气体组分热量,kJ/h Q 3 ——合成塔热损失,kJ/h Q 4——蒸汽吸收的热量,kJ/h∑Q 1=∑(G 1×Cp 1×T 1) (式5.2) 式中: G 1——入塔气各组分流量,kmol/h ;Cp 1 ——入塔各组分的比热容,kJ/(m 3.k ); T 1——入塔气体温度,k ;∑Q 2=∑(G 2×Cp 2×T 2) (式5.3) 式中: G 2——出塔气各组分流量kmol/h ;Cp 2 ——出塔各组分的热容,kJ/(m 3.k ); T 2—— 出塔气体温度,k ;∑Qr= Qr 1 +Qr 2 +Qr 3+ Qr 4+ Qr 5 +Qr 6 + Qr 7 (式5.4) 式中: Qr 1、Qr 2 、Qr 3、 Qr 4、 Qr 5 、Qr 6、Qr 7——分别为甲醇、甲烷、二甲醚、异丁醇、水、辛烷的生成热,kJ/h ; 式中: Gr ——各组分生成量,kmol/h ;△H ——生成反应的热量变化,kJ/mol5.1.1 合成塔入塔热量计算查《化学化工物性数据手册》[17]得在498.15K 、5.2MPa 下各组分气体的定压热容如下表所示:表5.1 组分气体定压热容气体 CH 3OH H 2 CO CO 2 N 2 Ar CH 4 热容kJ/(kmol ·k )65.8329.1230.5747.6930.2321.5447.61由pi i i Q C G =⨯ 得入塔气中各组分的热量:表5.2 各组分带进合成塔的热量气体 CH 3OH H 2 CO CO 2 N 2 Ar CH 4 热容kJ/(kmol ·k ) 65.8329.1230.5747.6930.2321.5447.61含量kmol/h 14.02 18477.75 2844.89 740.42 635.31 163.50 373.71入塔热量kJ/(h ·k )922.94538072.0886968.2935310.63 19205.42 3521.79 17792.33则每小时入塔热量:∑Q 1=922.94+538072.08+86968.29+35310.63+19205.42+3521.79+17792.33 =701793.48kJ/(h ·k )所以总热量∑Q 1=701793.48×498.15=349598422.06kJ/h5.1.2 合成塔的反应热由i ri H Q G =∆⨯得:各组分生成的热量如下表5.3 甲醇合成塔内反应热气体 CH 3OH ( CH 3 )2O C 4H 9OH CH 4 CO C 8H 18生成热kJ/mol 97.73 49.62 200.39 115.69 -42.92 957.98生成量kmol/h 1108.957 3.811 1.466 2.837 109.52 1.171 反应热kJ/h108378367.61189101.82293771.74328212.53-4700598.41121794.58则合成塔每小时生成的反应热:∑Q r =108378367.61+189101.82+293771.74+328212.53+1121794.58-4700598.4=104433356.74kJ/h5.1.3 合成塔出塔热量计算查《化学化工物性数据手册》得在528.15K 、5.2MPa 下各组分气体的定压热容如下表5.4所示:表5.4 组分气体定压热容气体CH 3OHH 2COCO 2N 2ArCH 4热容kJ/(kmol ·k )67.82 29.13 30.69 48.23 30.32 21.45 49.23由pi i i Q C G =⨯ 得出塔气中各组分的热量:表5.5 各组分带出合成塔的热量气体 热容kJ/(kmol ·k )含量kmol/h 出塔热量kJ/(h ·k )CH 3OH 67.82 1231.17 83497.95 H 2 29.13 16083.28 468505.95 CO 30.69 1815.14 55706.65 CO 2 48.23 617.69 29791.19 N 2 30.32 636.67 19303.83 Ar 21.45 162.33 3481.98 CH 4 49.23 337.36 16608.23 H 2O35.36130.714621.91则,每小时出塔热量:∑Q 2=83497.95+468505.95+55706.65+29791.19+19303.83+3481.98+16608.23+4621.91=681517.69kJ/(h ·k )总出塔热量∑Q 2=681517.69×528.15=359943565.65kJ/h 5.2 合成塔热量损失假设合成塔的热量损失为5%,则损失的这部分能量的值为:Q 3=(∑Q 1+∑Q r )×5%=(349598422.06+104433356.74)×5%=22701588.94kJ/h5.3 蒸汽吸收的热量全塔热平衡方程式为:∑Q 1 +∑Qr = ∑ Q 2 + ∑Q 3 +Q 4 得: 蒸汽吸收的热量为:41r 23Q Q Q Q Q =+--∑∑∑=349598422.06+104433356.74-359943565.65-22701588.94=71386624.21kJ/h水蒸气入口温度为200℃,出口温度为224℃,查《化工工艺设计手册》得:水蒸气的平均热容为3.224KJ/(kg ·K),则由p Q F t C =⨯⨯∆ 得: 水蒸气的用量:4pQ F t C =⨯∆=71386624.21/(3.224×297.15)=74515.41kg/h=74.515吨/h表5.6 合成塔的热量平衡表气体气体显热反应热热损失 蒸汽吸收合计 入塔气kj/h 349598422.06104433356.74--454031778.8出塔气kj/h 359943565.6-22701588.94 71386624.21 454031778.855.4 合成气换热器的热量衡算 5.4.1 合成气入换热器的热量入换热器的合成气温度为60℃,查《化学化工物性数据手册》得各组分的比热容,由pi i i Q C G =⨯,计算得各组分带进换热器的热量如下表所示:表5.7 合成气带进的热量气体 CH 3OH H 2 CO CO 2 N 2 Ar CH 4 热容kJ/(kmol ·k ) 46.60 28.92 30.92 58.66 31.01 22.78 41.11 含量kmol/h 14.02 18477.75 2844.89740.42635.31 163.50 373.71 带进热量kJ/(h ·k )653.33534376.5387963.99 43433.0419700.963724.5315363.22则每小时的热量:Q 入换热器=653.33+534376.53+87963.99+43433.04+19700.96+3724.53+15363.22 =705215.61kJ/(h ·k )合成气带进换热器的总热量:Q 总入换热器=705215.61×333.15=234942576.51kJ/h5.4.2 合成气出换热器的热量由工艺流程可知,合成气出换热器的热量与入合成塔的热量相等,则合成气出换热器的热量为:Q 出换热器=349598422.06kJ/h5.5 换热器的热量衡算5.5.1 入换热器的出合成塔气热量由工艺流程可知,在忽略管路热损失的条件下,入换热器的出合成塔气热量与合成塔出塔气的热量相等,,即入换热器的出合成塔气热量为:Q 5=359943565.65kJ/h5.5.2 出换热器的出合成塔气热量由换热器的热量衡算得:出合成塔气进入换热器后能量降低,降低的这部分能量用于入换热器的合成气的加热,即合成气热量的增值等于出合成塔气热量的减少值。


化工设计物料衡算和热量衡算化工设计物料衡算和热量衡算是化工工程设计中非常重要的内容。
物料衡算是指在化工工程中对物料的流动进行计算和衡量的过程,而热量衡算则是指对化工工程中的热量流动进行计算和衡量的过程。
下面将详细介绍这两个内容。
首先,物料衡算是化工工程设计中的一个必不可少的环节。
物料衡算要基于反应的化学反应原理或工艺流程,计算出物料的各项数据,如流量、摩尔质量、摩尔仓数等。
具体的衡算步骤包括:确定物料的基本特性,如摩尔质量、密度等;确定物料的流动量和流速;根据反应方程式和反应器的驱动力,计算出反应速率;进一步计算出反应器的物料应用时间(HRT),以衡量物料在反应器中的停留时间。
物料衡算的目的是为了选择合适的设备和工艺流程,以确保化工工程的安全运行。
通过物料衡算,可以计算出物料在不同设备中的流速和停留时间,从而判断是否需要增加搅拌装置或延长反应器的体积等改进措施。
此外,物料衡算还能帮助设计人员确定各种物料转移设备的大小和形式,以满足工艺流程的需求。
其次,热量衡算是物料衡算的重要组成部分,也是化工工程中的关键环节。
热量衡算要根据物料的热力学特性及其运动过程,计算出热量的流动和传递。
具体的衡算步骤包括:测定物料的初始和终止温度;计算物料的比热容和比焓;计算物料在设备中的热量传递和损失;计算过程中发生的温度变化和热量变化;计算设备的热损失和热水平;最终评估设备的热效率。
热量衡算的目的是为了保证化工工程的热平衡和能量效率。
通过热量衡算,可以计算出各个设备和工艺过程的热量损失和热交换,从而判断是否需要增加散热装置或回收热量等改进措施。
此外,热量衡算还能帮助设计人员确定各种热交换设备的大小和形式,以满足工艺流程的需求。
总结来说,物料衡算和热量衡算是化工工程设计中非常重要的内容。
物料衡算可以帮助设计人员选择合适的设备和工艺流程,确保化工工程的安全运行;热量衡算则可以保证化工工程的热平衡和能量效率。
通过物料衡算和热量衡算,设计人员可以更好地优化工艺流程,提高化工工程的效率和经济性。
化工设计之物料衡算及热量衡算化工设计中的物料衡算和热量衡算是非常重要的步骤,可以帮助工程师确定所需的原料数量和能源消耗。
本文将讨论物料衡算和热量衡算的原理、方法和应用。
一、物料衡算物料衡算是指根据化工过程的原理和条件,计算出所需原料的数量。
1.原料衡算的原理在化工过程中,根据反应式、反应的平衡常数、物料的摩尔平衡和原料的纯度等信息,可以得出原料的物质平衡方程。
2.原料衡算的方法(1)平衡更新法:根据反应式及其他物质平衡方程,利用线性方程组求解方法,逐步逼近平衡条件,得出原料数量的近似解。
(2)摩尔关系法:利用反应的摩尔比例来计算原料的摩尔数量。
根据反应的平衡常数和其他物质平衡方程,可以得到原料的摩尔数量。
3.原料衡算的应用物料衡算在化工过程中有广泛的应用。
例如,在合成反应中,根据反应需求,确定所需原料的摩尔数量;在萃取过程中,根据溶剂和溶质的摩尔比例,计算溶液中的溶质浓度。
二、热量衡算热量衡算是指根据化工过程的热力学原理和条件,计算出所需的能量消耗。
1.热量衡算的原理根据热力学定律,可以计算化学反应的焓变,并以此来确定反应所需的热量。
热量衡算也需要考虑其他因素,如物料的温度、压力变化等。
2.热量衡算的方法(1)焓变法:根据反应的焓变和反应的摩尔比例,计算出反应所需的热量。
焓变可以通过实验测量或热力学数据库来获取。
(2)能量平衡法:考虑物料流动和热交换等因素,通过能量平衡方程求解,计算出能量的输入和输出。
3.热量衡算的应用热量衡算在化工过程中的应用非常广泛。
例如,在高温燃烧反应中,需要计算反应所需的燃料气体的热量;在蒸汽发生器中,需要计算蒸汽的产生量和燃料的热量供应。
物料衡算和热量衡算是化工设计中不可或缺的两个步骤,可以帮助工程师确定原料的用量和能量消耗,从而优化过程设计、提高生产效率和节约能源。
在进行衡算时,需要准确地获取物料的性质数据,合理地选择计算方法,并考虑到实际操作条件的变化,以保证设计结果的可靠性和实用性。
§ 4.4 热量衡算C,H DDB, H WW热量衡算说明:①泡点进料,泡点回流;②以20℃常温下液态混合物状态为基准。
H F + Q B = Q C + H D + H WH F :进料焓H D :塔顶产品焓H W:塔底产品焓Q C:全凝器冷凝负荷Q B :再沸器热负荷1. 进料焓的计算H FT F=380.1019K=106.9519℃所以进料液体的定性温度(T F + 20℃)/2=63.47595℃查石油化工基础数据手册并由插值法得定性温度下的比热:C FPCT=42.59 cal/mol•℃C FOCT=42.55 cal/mol•℃则进料液体的平均比热:C Fm= C FOCT×Z F + C FPCT×(1-Z F)=42.55cal/mol•℃×40%(mol)+42.59cal/mol•℃×(1-40%)(mol)=42.574 cal/mol•℃则进料液体焓:H F= F ×C Fm×(T F ―20℃)=0.9875kmol/h×42.574 cal/mol•℃×(106.9519℃―20℃)=3655.62kcal/h=15295.48kJ/h2. 塔顶产品焓的计算H DT D=99.5252℃定性温度=(T D + 20℃)/2=59.7626℃查石油化工基础数据手册并由插值法得定性温度下的比热:C DPCT=42.32 cal/mol•℃C DOCT=42.28 cal/mol•℃则塔顶产品的平均比热:C Dm= C DOCT×XD + C DPCT×(1-X D)=42.28 cal/mol•℃×80%(mol)+ 42.32 cal/mol•℃×(1-80%)(mol) =42.288 cal/mol•℃则H D= D ×C Dm×(T D―20℃)=0.329167kmol/h×42.288 cal/mol•℃×(99.5252℃―20℃)=1106.976kcal/h=4631.70kJ/h3. 塔底产品焓的计算H WT W=384.3198K=111.1698℃定性温度=(T W + 20℃)/2=65.5849℃查石油化工基础数据手册并由插值法得定性温度下的比热:C WPCT=42.74 cal/mol•℃C WOCT=42.70 cal/mol•℃则进料液体的平均比热:C Wm= C WOCT×X W + C WPCT×(1-X W)=42.70 cal/mol•℃×20%(mol)+ 42.74 cal/mol•℃×(1-20%)(mol) =42.732 cal/mol•℃则塔底产品焓:H W= W ×C Wm×(T W ―20℃)=0.658333kmol/h×42.732 cal/mol•℃×(111.1698℃―20℃)=2564.78kcal/h=10731.30kJ/h4. 全凝器冷凝负荷的计算Q CQ 1 = V ×r m = (R+1)D ×r mr m =r OCT × X D +r PCT × (1-X D )Q 2 = V × C pm × (T 顶 – 20)①算Q 1 :由Ct B A p +-=log 得 2)(10ln 1*log C t B p dt dp dt p d +== 22)15.273(10ln *Ct t RB p RT dt dp r v ++== mol J C t t RB r T T OCT /10*1568.4)486.2195252.9915.2735252.99(*10ln *990.1590*3143.8)15.273(10ln 42200=++=+=+ m o l J C t t RB r pT T PCT /10*2123.4)519.2185252.9915.2735252.99(*10ln *490.1602*3143.8)15.273(10ln 4220=++=++= 混合汽化潜热:molJ x r x r r PCT D OCT m /10*1679.42.0*10*2123.48.0*10*1568.4)1(4440=+=-+= hkJ r D R r V Q mm /10*5228.2610*1679.4*)13324.18(*329167.0*)1(*441=+=+==②算Q 2 :t 顶=99.5252℃由内插法得C p OCT(99.5252℃)=45.0672 Cal/(mol·℃)C p OCT(20℃) =39.34Cal/(mol·℃)同理由内插法得C p PCT(99.5252℃)=45.1168 Cal/(mol·℃)C p PCT(20℃) =39.38Cal/(mol·℃) 平均比热:C m =XD (C p OCT(99.5252℃)+ C p OCT(20℃))/2+(1-X D )(C p PCT(99.5252℃)+C p PCT(20℃))/2 =80%×(45.0672+39.34)/2+(1-80%)(45.1168+39.38)/2 = 42.2126Cal/(mol·℃)Q2=V×C m (t 顶-20)=6.363588×42.2126×(99.5252-20)=21362.3455kcal/h=8.9382×104kJ/hQ C =Q 1+Q 2=26.5228×104+8.9382×104=35.461×104kJ/h ③ 冷却水用量:取进口水温为30℃,出口水温为40℃,则△t 水=10℃ 水的定性温度为:(30+40)/2=35℃查《化工原理》附录水的比热容为:C p 水(35℃)=4.174kJ/(kg ·K)W=Q C /C p 水 △t 水=10174.410461.354⨯⨯=8495.69 kg/h5. 再沸器热负荷的计算 Q BH L’ + Q B = H V’ + H WQ B= H V’ + H W - H L’H L’= L’ × C m L’ × (T底– 20)H V’= V’ ×r m V’ + V’ × C m V’×(T V’-20)H W = W × C m W × (T W - 20)⑴计算倒数第二块板的焓H L’由Aspen plus 计算结果:t L’=110.9493℃x L’=0.21561268 L’=7.04494355kmol/h定性温度t m =( t L’+20℃)/2=65.4747℃由插值法:C p PCT,65.4747℃=42.7287 Cal/(mol·℃)C p OCT,65.4747℃=42.6887 Cal/(mol·℃)C m = C p PCT (1- x L’)+ C p OCT x L’=42.7287*(1-0.2156)+42.6887*0.2156= 42.7201Cal/(mol·℃)=178.7451J/(mol·℃)H L’=L’C m(t L’-20)=7.0449*178.7451*(110.9493-20)=11.4527*104kJ/h⑵计算离开再沸器的相焓H V’P底=170.00148mmHgx W =0.2 y V’=0.21722207 V’=6.38661055kmol/ht V’=t W =111.1698℃t m =( t V’+20)/2=65.5849℃由插值法:C p PCT, 65.5849℃ =42.7365 Cal/(mol·℃) C p OCT, 65.5849℃ =42.6965 Cal/(mol·℃) C m = C p PCT (1- x W )+ C p OCT x W=42.7365*(1-0.2)+42.6965*0.2=42.7822 Cal/(mol·℃)=179.005J/(mol·℃) Q 1=V’C m (t v’-20)=6.3866*179.005*(111.1698-20) =10.4261*104kJ/h2)15.273(10ln Ct t RB r V ++= mol J r OCT /10*1147.4)486.219111.169815.273111.1698(*10ln *99.1590*3143.842=++=mol J r PCT /10*1644.4)592.218111.169815.273111.1698(*10ln *49.1601*3143.842=++=r m =r OCT y V’+r PCT (1-y V’)=4.1147*104*0.2172+4.1664*104*(1-0.2172) =4.1552*104 J/molQ 2=V’r m =6.3866*4.1552*104=26.5376*104 kJ/h H V’ = Q 1 + Q 2 =36.9637* 104 kJ/h ⑶塔底产品的焓H WH W = 10731.30kJ/h(前已述及) ⑷Q BQ B =H V’+H W -H L’=36.9637*104+1.0731*104-11.4527*104 =26.5841* 104 kJ/h在0.3Mpa时,r水蒸汽=2168kJ/kg蒸汽用量W汽=Q B /r水蒸汽=122.62 kg/h热量衡算方程为:H F + Q B = Q C + H D + H W等式左边=H F + Q B =15295.48+26.5841* 104=28.1136kJ/h等式右边=Q C+H D + H W=35.461×104+4631.70+10731.30=36.9973kJ/h。
能量衡算查化工手册及Missenard法估算的25℃时各物质Cp值Missenard法Cp=∑niCiM式中:M—化合物摩尔质量Kg/Kmolni—分子中i种基团个数Ci—i种基团的摩尔热熔J/(mol·℃)对于有传热要求的设备,其热量平衡方程式为:Q1+Q2+Q3=Q4+Q5+Q6式中Q1—物料带入到设备的热量kJ;Q2—加热剂或冷却剂传给设备和所处理物料的热量kJ;Q3—过程热效应kJ;Q4—物料离开设备所带走的热量kJ;Q5—加热或冷却设备所消耗的热量kJ;Q6—设备向环境散失的热量kJ。
热量衡算是一般建议以273K 为基准温度,以液态为基准物态。
各物质的Cp值一览项目物质Cp(kJ/(kg·℃))25℃35℃75℃A 1.657 1.687 1.742B ClCH2COOC3H7-i 1.651 1.775 1.867C 1.675 1.675 1.675D 1.758 1.727 1.878E H2O 4.178 4.178 4.178F 40% NaOH 3.437G HCl 2.763(25%)0.8(纯)0.8(纯)H CO20.837 0.856 0.856I 苯醇 1.971 2.155 2.32 J 1.730 1.762 1.892 K NaCl 0.87 0.87 0.87 L 1.725 1.799 1.92 M 2.545 2.583 2.762 N 1.220(一)、缩合过程1、Q1与Q4的计算Q1(或Q4)=∑mCp(t1−t0)m——物质的质量KgCp——个物质的比热容kJ/(kg•℃)t0、t1——进料与出料温度℃(1)Q1的计算,设进料时温度25℃异丙醇纳:Q11=716.54*25*1.675/8=3750.64KJ苯:Q12=888.32*25*1.758/8=4880.21KJ苄酮:Q13=241.77*25*1.657/8=1251.92KJ氯乙酸异丙酯:Q14=318.60*25*1.651/8=1643.48KJ则每小时输入设备的物料带入的热量Q1Q1= Q11+ Q12+ Q13+Q14=11526.25KJ(2)Q4的计算,设出料时温度35℃中间产物带出的热量:Q41=465.59*35*1.725/8=3513.75KJ 异丙醇:Q42=64.97*35*2.219/8=630.74KJNaCl:Q43=63.34*35*0.87/8=241.09KJ氯乙酸异丙酯:Q4=170.80*35*1.651/8=1251.64KJ异丙醇纳:Q45=627.75*35*1.675/8=4600.23KJ苯:Q46=888.32*35*1.758/8=6832.29KJ则每小时输出设备的物料带出的热量Q4Q4=Q41+Q42+Q43+Q44+Q45+Q46=17069.81KJ2、Q3的计算+(CH3)2CHOH+NaCl(1)苄酮q cθ=109.07n+∑kΔ,燃烧时,n=72所以,∑kΔ=-14.6-14.6+27.2=-2则q c1θ=109.07*72-2=7851.04KJ/mol(2)氯乙酸异丙酯n=24则,∑kΔ=-32.2+69.036=36.84q c2θ=109.07*24+36.84=2654.52 KJ/mol(3)中间产物∑kΔ=-14.6-14.6+69.036+27.2=67.036q c3θ=109.07*96+67.036=10537.76 KJ/mol(4)异丙醇n=18∑kΔ=27.2q c4θ=109.07*18+27.2=1990.46KJ/mol以下是根据上述反应物所对应的元素标准燃烧热值的求解(1)苄酮∑nqce1θ=15*395.14+14*143.18+0=7931.77KJ/mol则标准生成热q f1θ=∑nqce1-qc1θ=7931.77-7851.04=80.73KJ/mol (2)氯乙酸异丙酯∑nqce2θ=5*395.4+9*143.18+0+165.80=3435.75KJ/mol则标准生成热Q f2θ=∑nqce2-qc2θ=3435.75-2654.52=781.23KJ/mol (3)中间产物∑nqce3θ=20*395.14+22*143.18+0=11052.96KJ/mol则标准生成热Q f3θ=∑nqce3-qc3θ=11052.96-2654.52=515.2KJ/mol (4)异丙醇∑nqce4θ=3*395.14+8*143.18+0=2330.89KJ/mol则标准生成热Q f4θ=∑nqce4-qc4θ=2330.89-1990.46=340.43KJ/mo (5)N aCl标准生成热Q f5θ=98.23*4.187=411.29KJ/mo综上所诉物质热力学数据,对q rθ与q r t得值及化学反应热θr的求解q rθ=∑vqfθ=-80.73-781.23+515.2+340.43+411.29=404.96Kj/mol则q r t= q rθ-(t-25)(∑vqf)KJ/mol=404.96-(35-23)(-1.657-1.651-1.675-1.758+1.725+2.219+0.87)+424.23KJ/mol则θr=q r t*G A/M A=424.23*208.78/8/210=52.72KJ/molQ3=θr=52.72 KJ/mol3、Q5与Q6和的计算按工艺流程要求,可以有Q5+Q6=(5%~10%)(Q5+Q6+Q4)取Q5+Q6=10%(Q5+Q6+Q4)则Q5+Q6=Q4/9=17069.81/9=1896.65KJ4、Q2的计算Q2=Q4+Q5+Q6-Q1-Q3=1896.65+17069.81-11526.25-52.72=7387.49KJ缩合过程能量衡算一览表(二)、水解脱羧(反应温度70℃)1、Q1与Q4的计算(1)Q1的计算,缩合反应完成后的产物以35℃进料,其他产物以25℃进料40%NaoH:Q10=200.8*25*3.437/8=2156.72KJ水:Q11=1031.44*25*4.178/8=13466.74KJ25%HCl:Q12=260.34*25*2.763/8=2247.87KJ苯(25℃):Q13=531.81*25*1.758/8=2921.63KJ中间产物带出的热量:Q14=465.59*35*1.725/8=3513.75KJ异丙醇:Q15=64.97*35*2.219/8=630.74KJNaCl:Q16=63.34*35*0.87/8=241.09KJ氯乙酸异丙酯:Q17=170.80*35*1.651/8=1251.64KJ异丙醇钠:Q18=627.75*35*1.675/8=4600.23KJ苯:Q19=888.32*35*1.758/8=6832.29KJ则每小时输入设备的物料带入的热量Q1Q1=Q0+ Q11+ Q12+ …+Q18+Q19=37862.77KJ(2)Q4的计算,设出料时温度70℃苄醛:Q41=230.41*70*1.892/8=3487.83KJCO2:Q42=36.84*70*0.83718/8=269.86KJ异丙醇:Q43=126.69*70*2.21918/8=2460.04KJ苯:Q44=(531.81+888.32)*70*1.758/8=21845.15KJ氯乙酸异丙酯:Q45=170.80*70*1.651/8=2467.42KJNaCl溶液:Q46=(1383.319+180.81)*70*0.87/8=12148.10KJ则每小时输出设备的物料带出的热量Q4Q4=Q41+Q42+Q43+Q44+Q45+Q46=42678.40KJ2、Q3的计算+H2o+CO2+苄醛的生成热∑kΔ=-14.6-14.6+54.4=25.2Q c1θ=109.07n+∑kΔ(n=46)=109.07*46+25.2=5042.42KJ/mol则q f1θ=8613.28-5042.42=3570.86KJ/mol查化工手册得水的生成热q f2θ=285.9KJ/molCO2的生成热q f3θ=340.43KJ/mol由缩合过程计算得:中间产物生成热:Q f4θ=515.2KJ/mol异丙醇生成热Q f5θ=340.43KJ/mol综上所诉物质热力学数据,对q rθ与q r t得值及化学反应热θr的求解q rθ=∑vqfθ=-515.2-285.9+3570.9+3570.86+393.5+430.43 =3503.69Kj/mol则θr=q r t*G A/M A=3503.69*38.66/8/44=384.8KJ/molQ3=θr=384.8 KJ/mol3、Q5与Q6和的计算按工艺流程要求,可以有Q5+Q6=(5%~10%)(Q5+Q6+Q4)取Q5+Q6=10%(Q5+Q6+Q4)则Q5+Q6=Q4/9=42678.40/9=4742.04KJ4、Q2的计算Q2=Q4+Q5+Q6-Q1-Q3=9172.87KJ水解脱羧过程能量衡算一览表(三)、初蒸过程(起始温度25℃,控制温度90℃)1、Q1与Q4的计算(1)Q1的计算苯:Q11=(2476.78-214.51-186.85)*1.758*25/8=11401.84KJ苄醛:Q12=214.51*1.730*25/8=1159.69KJ残液:Q13=186.85*1.832*25/8=1069.71KJ则每小时输入设备的物料带入的热量Q1Q1= Q11+ Q12+ Q13 =13631.24KJ(2)Q4的计算(苯90℃是为气态,Cp为1.286 KJ/kg·℃)苯(蒸汽):Q41=(2476.78-214.51-186.85)*1.286*90/8=30026.12KJ 苄醛:Q42=214.51*1.892*90/8=4565.84KJ残液:Q43=186.85*1.859*90/8=3907.73KJ则每小时输出设备的物料带出的热量Q4Q4=Q41+Q42+Q43 =38499.70KJ2、Q3的计算苯的汽化热:Qr=-(2476.78-214.51-186.85)*380.9988/8=-98841.57KJ则Q3=Qr=-98841.57KJ3、Q5与Q6和的计算按工艺流程要求,可以有Q5+Q6=(5%~10%)(Q5+Q6+Q4)取Q5+Q6=10%(Q5+Q6+Q4)则Q5+Q6=Q4/9=38499.70/9=4277.74KJ4、Q2的计算Q2=Q4+Q5+Q6-Q1-Q3=93337.77KJ初蒸过程能量衡算一览表(四)、减压蒸馏过程(起始温度90℃,控制温度140℃)据经验,大气压每降低一半,沸点降低10℃,另由文献得苄醛在0.133KPa时沸点为137-138℃,上接初蒸,入料温度为90℃,出料温度为140,压力为0.133Kpa。
传热过程的热量衡算热量衡算是重要的化工基本计算,不仅化工设计必须进行热量衡算,而且日常生产操作也经常要计算各个工序、设备的热量消耗和载热体的用量,目的是准确掌握能耗现状,考核各车间、班组的耗能水平,挖掘生产中的节能潜力,制定有效的节能措施。
1.热负荷Q的计算方法生产工艺上要求换热器具有的换热能力,称为换热器的热负荷。
一台能满足工艺要求的换热器,应使其传热速率等于或略大于热负荷。
所以知道了换热器的热负荷,便可确定其他的传热速率。
要注意,热负荷与传热速率,其数值相同或相近,但含义并不一样。
热负荷是指生产上要求换热器应具有的换热能力,传热速率则是换热器本身具有换热能力。
针对传热过程中有无相变,热负荷的计算方法有以下三种。
(1)温差法当流体在换热过程中无相变而只有温度的变化时,则热负荷计算用温差法,公式是Q=M*C*(T2-T1)式中M――流体的质量,kgQ――在换热中的热量,kJC――比热容,kJ/kg.KT2、T1――流体换热前后的温度,K(2)潜热法当流体在换热过程中公有相变化时,热负荷计算用潜热法。
这种情况所传递的热量是潜热,沸腾汽化吸收的热量为汽化潜热,冷凝放出的热量为液化潜热(即冷凝潜热)。
汽化潜热的符号为R,其物理意义是质量1kg的某物质,在一定压力下,由液体完全转变为同温度的蒸气所吸收的热量,单位为kJ/kg;反之,则为该物质的冷凝潜热。
同一种物质的冷凝潜热和汽化潜热数值是相等。
潜热法计算公式是Q=M*R式中Q――同温相变时所需的热量,kJM――流体的质量,kgR――物质的汽化潜热或冷凝潜,kJ/kg(3)焓差法焓,也称热焓,物质在某一状态下焓值,就是使物质由基准状态变为现状态时所需的热量。
在热量计算中,物质在某温度下热焓的数值,一般就是指1 kg流体由273K加热至某一指定温度(包括相变)时所需的热量。
热焓的符号为H,单位为kJ/kg。
在热负荷的计算过程中,不论有无相变都可采用焓差法。
物料衡算和热量衡算物料衡算根据质量守恒定律,以生产过程或生产单元设备为研究对象,对其进出口处进行定量计算,称为物料衡算。
通过物料衡算可以计算原料与产品间的定量转变关系,以及计算各种原料的消耗量,各种中间产品、副产品的产量、损耗量及组成。
物料衡算的基础物料衡算的基础是物质的质量守恒定律,即进入一个系统的全部物料量必等于离开系统的全部物料量,再加上过程中的损失量和在系统中的积累量。
∑G1=∑G2+∑G3+∑G4∑G2:——输人物料量总和;∑G3:——输出物料量总和;∑G4:——物料损失量总和;∑G5:——物料积累量总和。
当系统内物料积累量为零时,上式可以写成:∑G1=∑G2+∑G3物料衡算是所有工艺计算的基础,通过物料衡算可确定设备容积、台数、主要尺寸,同时可进行热量衡算、管路尺寸计算等。
物料衡算的基准(1)对于间歇式操作的过程,常采用一批原料为基准进行计算。
(2)对于连续式操作的过程,可以采用单位时间产品数量或原料量为基准进行计算。
物料衡算的结果应列成原材料消耗定额及消耗量表。
消耗定额是指每吨产品或以一定量的产品(如每千克针剂、每万片药片等)所消耗的原材料量;而消耗量是指以每年或每日等时间所消耗的原材料量。
制剂车间的消耗定额及消耗量计算时应把原料、辅料及主要包装材料一起算入。
热量衡算制药生产过程中包含有化学过程和物理过程,往往伴随着能量变化,因此必须进行能量衡算。
又因生产中一般无轴功存在或轴功相对来讲影响较小,因此能量衡算实质上是热量衡算。
生产过程中产生的热量或冷量会使物料温度上升或下降,为了保证生产过程在一定温度下进行,则外界须对生产系统有热量的加入或排除。
通过热量衡算,对需加热或冷却设备进行热量计算,可以确定加热或冷却介质的用量,以及设备所需传递的热量。
热量衡算的基础热量衡算按能量守恒定律“在无轴功条件下,进入系统的热量与离开热量应该平衡”,在实际中对传热设备的衡算可由下式表示Q 1+Q 2+Q 3=Q 4+Q 5+Q 6 (1—1)式中: Q 1—所处理的物料带入设备总的热量,KJ;Q 2—加热剂或冷却剂与设备和物料传递的热量(符号规定加热剂加入热量为“+”,冷却剂吸收热量为“-”),KJ;Q 3—过程的热效率,(符号规定过程放热为“+”;过程吸热为“-”)Q 4—反应终了时物料的焓(输出反应器的物料的焓)Q 5—设备部件所消耗的热量,KJ;Q 6—设备向四周散失的热量,又称热损失,KJ;热量衡算的基准可与物料衡算相同,即对间歇生产可以以每日或每批处理物料基准。