物料衡算与热量衡算(1)
- 格式:ppt
- 大小:674.00 KB
- 文档页数:39

物料衡算和热量衡算1. 引言物料衡算和热量衡算是在工程设计和过程优化中常用的方法和工具。
物料衡算是指通过对物料的进出量、质量和组成等参数的分析,计算出物料的平衡以及物料流动过程中的相关参数。
热量衡算是指通过对热量的进出量、热平衡等参数的分析,计算出热量在系统中的平衡和流动情况。
本文将介绍物料衡算和热量衡算的基本概念、方法和应用。
2. 物料衡算2.1 物料平衡物料平衡是对物料流动系统中物料的进出量进行分析和计算的过程。
物料平衡的基本原理是质量守恒定律,即在封闭系统中,物料的质量不会发生净变化。
物料平衡可用于分析物料的流动路径、损耗情况以及优化物料的使用和回收。
2.2 物料衡算的方法常用的物料衡算的方法包括输入-输出法和组分衡算法。
- 输入-输出法:通过记录系统中物料的进出量,计算出物料的平衡情况。
该方法适用于物料流动较简单且没有复杂反应的系统。
具体步骤包括确定进料和产出物料的量和质量,计算进出物料的差值,并检查误差,使其趋近于零。
- 组分衡算法:通过对物料组分的平衡进行计算,得到物料的进出量。
该方法适用于需要考虑物料成分变化的系统。
具体步骤包括确定进料和产出物料的组分及其相对含量,计算进出物料组分的差值,并检查误差。
2.3 物料衡算的应用物料衡算在化工、冶金、环境工程等领域有广泛的应用,例如: - 在化工生产中,物料衡算可以用于优化原料的使用和能源的消耗,减少产品的损耗和废物的排放。
- 在冶金过程中,物料衡算可以用于优化矿石的选矿和冶炼过程,提高生产效率和产品质量。
- 在环境工程中,物料衡算可以用于分析和优化废物处理和排放过程,减少对环境的污染。
3. 热量衡算3.1 热量平衡热量平衡是对热量在系统中的分布和流动进行分析和计算的过程。
热量平衡的基本原理是热力学第一定律,即能量守恒定律。
热量衡算可以用于分析热量的传递、损失和利用情况,以及优化热能的使用和节约。
3.2 热量衡算的方法常用的热量衡算的方法包括输入-输出法和能量平衡法。

化工原理物料衡算和热量衡算引言化工工程涉及许多物料的处理和转化过程,同时也需要考虑热量的平衡。
物料衡算和热量衡算是化工原理的重要内容,对于工程实践和过程优化具有重要的意义。
本文将介绍化工原理中的物料衡算和热量衡算的基本原理和计算方法。
物料衡算物料衡算是指对于化工工程中物料流动和转化过程的计算和分析。
在化工工程中,物料的流动和转化是实现各种反应和分离操作的基础,因此正确的物料衡算是保证工程设计和操作的关键。
在物料衡算中,我们通常需要考虑以下几个方面: 1. 物料的质量衡算:即对物料的质量输入和输出进行计算和分析。
对于物料的质量衡算,我们需要注意物料流动的平衡原则,即质量的输入必须等于输出。
2. 物料的能量衡算:即对物料的能量输入和输出进行计算和分析。
能量的输入和输出会影响物料的温度和相变过程,因此在能量衡算中需要考虑物料的热力学性质。
3. 物料的流动速度衡算:即对物料流动速度进行计算和分析。
物料的流动速度决定了反应和分离操作的效率,因此在物料衡算中需要合理地确定流量和速度的关系。
4. 物料的浓度衡算:即对物料中组分浓度的计算和分析。
物料的浓度会影响其反应和分离的速率和效果,因此在物料衡算中需要考虑不同组分浓度的变化规律。
物料衡算通常使用质量守恒和能量守恒等基本原理进行计算。
同时,还可以利用化学反应平衡的原理和质量流动的平衡原则进行衡算过程中的参数确定。
热量衡算热量衡算是化工工程中热力学过程的计算和分析。
在化工工程中,热量的平衡是保证反应和分离操作能够正常进行的基础。
热量衡算需要考虑以下几个方面: 1. 热量的输入和输出:即对于热量的输入和输出进行计算和分析。
在化工工程中,我们通常需要对热量的输入和输出进行平衡,以保证工程操作的稳定性。
2. 热量的传递和转化:即对于热量的传递和转化过程进行计算和分析。
热量的传递可以通过传导、对流和辐射等方式进行,因此在热量衡算中需要考虑传热方式的影响。
3. 热平衡的计算:即对于反应和分离过程中热量平衡的计算和分析。

干燥过程的物料衡算与热量衡算1. 引言在工业生产中,许多物料需要经过干燥过程才能达到所需的水分含量。
干燥过程是将物料中的水分蒸发或驱除的过程,其中物料的衡算和热量的衡算是非常重要的。
本文将介绍干燥过程中的物料衡算和热量衡算的基本原理和方法。
2. 物料衡算物料衡算是指在干燥过程中对物料的质量进行衡量和追踪的过程。
通常情况下,物料的衡算可以分为进料衡算和出料衡算两个部分。
2.1 进料衡算在干燥过程中,物料的进料衡算是指对进入干燥设备的物料进行质量的测量和记录。
通常情况下,进料衡算可以通过称重装置、质量流量计等设备进行。
物料的进料衡算可以用以下公式表示:进料量 = 初始物料质量 - 终止物料质量2.2 出料衡算在干燥过程中,物料的出料衡算是指对从干燥设备中出来的物料进行质量的测量和记录。
同样地,出料衡算也可以通过称重装置、质量流量计等设备进行。
物料的出料衡算可以用以下公式表示:出料量 = 初始物料质量 - 终止物料质量3. 热量衡算热量衡算是指在干燥过程中对热量的衡量和追踪的过程。
热量衡算是确定干燥设备所需的热量输入和物料中的水分蒸发所需的热量的关键。
3.1 热量平衡公式热量平衡公式是用于计算干燥过程中所需的热量输入和物料中的水分蒸发所需的热量的关系。
热量平衡公式如下:热量输入 = 热量输出 + 热量损失其中,热量输入是指干燥设备所需的热量输入,热量输出是指物料中的水分蒸发所需的热量,热量损失是指在干燥过程中因为传导、对流和辐射等现象导致的热量损失。
3.2 热量输入的计算热量输入可以通过以下公式计算:热量输入 = 干燥空气的热量 + 干燥空气的水分蒸发热量 + 加热设备的热量其中,干燥空气的热量可以通过湿空气焓值表或湿空气定压比热容表进行查找,干燥空气的水分蒸发热量可以通过水的蒸发热量进行计算,加热设备的热量可以通过加热元件的功率和加热时间进行计算。
3.3 热量输出的计算热量输出可以通过以下公式计算:热量输出 = 出料量 * 物料的比热 * (物料的初始水分含量 - 物料的终止水分含量)其中,出料量是指干燥过程中物料的出料量,物料的比热可以通过物料的物性表进行查找,物料的初始水分含量和物料的终止水分含量可以通过物料的质量衡算进行计算。

3 物料衡算依据原理:输入的物料量=输出的物料量+损失的物料量3.1 衡算基准年生产能力:2000吨/年年开工时间:7200小时产品含量:99%3.2 物料衡算反应过程涉及一个氧化反应过程,每批生产的产品相同,虽然有原料对叔丁基甲苯和溶剂甲苯的循环,第一批以后循环的物料再次进入反应,但每批加料相同。
在此基础上,只要计算第一个批次的投料量,以后加料一样。
反应釜内加热时间2h、正常的反应时间18h、冷却时间1h。
加上进料和出料各半个小时,这个生产周期一共2+18+1+1=22h。
所以在正常的生产后,每22小时可以生产出一批产品。
每年按300天生产来计算,共开工7200小时,可以生产327个批次。
要求每年生产2000吨对叔丁基苯甲酸,则每批生产2000÷327=6.116吨。
产品纯度99 %( wt %)实际过程中为了达到高转化率和高反应速率,需要加入过量对叔丁基甲苯做溶剂,反应剩余的原料经分离后循环使用。
3.2.1 各段物料(1) 原料对叔丁基甲苯的投料量设投料中纯的对叔丁基甲苯为X kg,则由C11H16C11H14O2 M 148.24 178.23m x 6054.8得x=6054.8×148.24÷178.23=5036.0 kg折合成工业原料的对叔丁基甲苯质量为5036.0÷0.99=5086.9kg实际在第一批生产过程加入的对叔丁基甲苯为6950.3kg(2)氧气的通入量生产过程中连续通入氧气,维持釜内压力为表压0.01MPa,进行氧化反应。
实际生产过程中,现场采集数据结果表明,通入的氧气量为1556.8 kg,设反应消耗的氧气量为x kg3/2O2C11H14O2 M 31.99 178.23m x 6054.8 得x= 3/2×6054.8×31.99÷178.23=1630.1kg此时采用的空气分离氧气纯度可达99%,因此折合成通入的氧气为1630.1÷0.99=1646.6 kg即在反应过程中,需再连续通入1646.6kg氧气。


化工中物料衡算和热量衡算公式一、物料衡算公式1.物料总量计算公式物料总量计算公式可以根据物质的密度(ρ)和体积(V)来计算。
公式如下:物料总量=密度×体积2.物料质量计算公式物料质量计算公式可以根据物质的密度(ρ)、体积(V)和物质的质量(m)之间的关系得出。
公式如下:质量=密度×体积3.物料浓度计算公式物料浓度计算公式可以根据溶质的质量(m)和溶液的体积(V)来计算。
公式如下:浓度=质量/体积4.溶液的重量和体积之间的关系溶液的重量可以根据溶液的密度(ρ)和溶液的体积(V)相乘得到。
公式如下:重量=密度×体积1.热量传递计算公式热量传递计算公式可以用于计算传热功率(Q)和传热面积(A)之间的关系。
公式如下:Q=h×A×ΔT其中,h为传热系数,ΔT为温差。
2.物料的热量计算公式物料的热量计算公式可以根据物料的质量(m)、比热容(Cp)和温度变化(ΔT)来计算。
公式如下:热量=质量×比热容×温度变化3.水的蒸发热计算公式水的蒸发热计算公式可以根据水的质量(m)和蒸发热(ΔHvap)来计算。
热量=质量×蒸发热三、补充说明1. 密度(ρ)是物质单位体积的质量,常用的单位有千克/立方米(kg/m^3)或克/立方厘米(g/cm^3)。
2. 比热容(Cp)是物质单位质量的热容量,表示单位质量物质温度升高1℃所需的热量,常用的单位是千焦/千克·℃(kJ/kg·°C)或焦/克·℃(J/g·°C)。
3.传热系数(h)是衡量热传导性能的参数,表示单位面积上的热量流入或流出的速率,常用的单位是瓦特/平方米·℃(W/m^2·°C)。
4.温度变化(ΔT)是物质的温度差,常用的单位是摄氏度(℃)或开尔文(K)。
5. 蒸发热(ΔHvap)是物质从液态转变为气态所需的热量,常用的单位是焦耳/克(J/g)或千焦/千克(kJ/kg)。

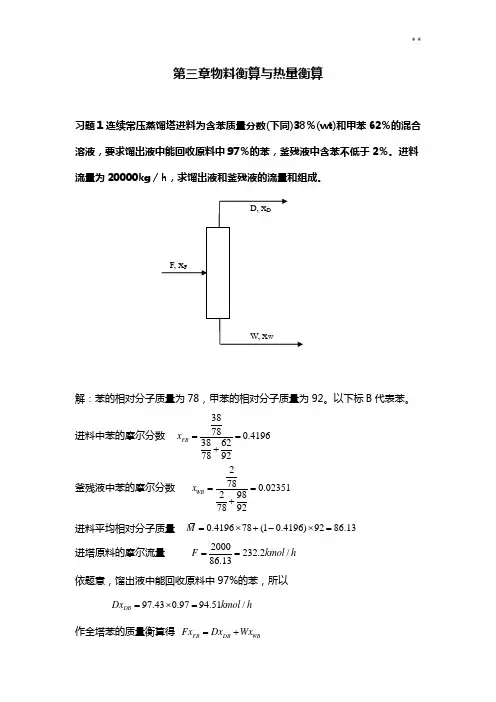
第三章物料衡算与热量衡算习题1连续常压蒸馏塔进料为含苯质量分数(下同)38%(wt)和甲苯62%的混合溶液,要求馏出液中能回收原料中97%的苯,釜残液中含苯不低于2%。
进料流量为20000kg /h ,求馏出液和釜残液的流量和组成。
解:苯的相对分子质量为78,甲苯的相对分子质量为92。
以下标B 代表苯。
进料中苯的摩尔分数 38780.419638627892FB x ==+釜残液中苯的摩尔分数 2780.023*********WB x ==+进料平均相对分子质量 0.419678(10.4196)9286.13M =⨯+-⨯= 进塔原料的摩尔流量 2000232.2/86.13F kmol h == 依题意,馏出液中能回收原料中97%的苯,所以97.430.9794.51/DB Dx kmol h =⨯=作全塔苯的质量衡算得 FB DB WB Fx Dx Wx =+作全塔总质量衡算得 F W D =+ 将已知数据代人上述质量衡算方程得 232.20.419694.510.02351⨯=+ 232.2W D =+解得 124.2/,108/W kmol h D kmol h == 所以,94.5194.510.8752DB x ===习题2 采用蒸发方法将浓度为10%NaOH (质量浓度)及10%NaCl 的水溶液进行浓缩。
蒸发时只有部分水分汽化成为水蒸气而逸出,部分NaCl 结晶成晶粒而留在母液中。
操作停止后,分析母液的成分为:50%NaOH ,2%NaCl 及48%H 2O 。
若每批处理1000kg 原料液,试求每批操作中:1)获得的母液量,2)蒸发出的水分量,3)结晶出的NaCl 量。
解:所选择的基准为:每批处理量,1000kg 原料液总物料衡算F1 = F2 + F3 + F4组分物料衡算NaOH 平衡 1000×0.1=0.5F4 NaCl 平衡 1000×0.1=0.02F4+F3H 2O 平衡 1000(1-0.1-0.1)=F2+0.48F4 解得: F2=704kg ,F3=96kg ,F4=200kg 习题3 丙烷充分燃烧时要使空气过量25%,燃烧反应方程式为: 38222534C H O CO H O +→+试计算得到100摩尔燃烧产物(又称烟道气)需要加入的空气的摩尔量。

# 30000t/a12。
淡色啤酒糖化车间物料衡算与热量衡算)二次煮出糖化法是啤酒生产常用的糖化工艺,下面就以此工艺为基准进行糖化车间的热量衡算。
由于没有物料数量等基础数据,因此,从物料计算开始。
已知物料定额的基础数据如表,绝对谷物的比热容为 1.55Kj/kg*K, 12°麦汁在20C时的相对密度为1.084 , 100C时热麦汁的体积是 20C时的1.04倍;煮沸温度下(常压100C) 水的气化潜热为1 = 2257.2 Kj/kg,加热过程热损失取 15%, 0.3MPa的饱和水蒸气1 = 2725.2 Kj/kg,相应冷凝水的焓为 561.47 Kj/kg,蒸汽热效率为 0.95,I物料衡算啤酒厂糖化车间的物料衡算主要项目为原料(麦芽、大米)和酒花用量,热麦汁和冷麦汁量,废渣量(糖化糟和酒花糟)等。
1•糖化车间工艺流程示意图2•工艺技术指标及基础数据我国啤酒生产现况决定了相应的指标,有关生产原料的配比、工艺指标及生产过程的损失等数据如上表所示。
根据基础数据,首先进行100kg原料生产12°淡色啤酒的物料计算,然后进行100L12 ° 淡色啤酒的物料衡算,最后进行30000t/a啤酒厂糖化车间的物料平衡计算。
3. 100kg原料(75%麦芽,25%大米)生产12°淡色啤酒的物料计算(1)热麦汁量麦芽收率为:0.75 ( 100-6)- 100= 70.5%大米受率为:0.92 ( 100- 13)- 100= 80.04%混合原料受得率为:(0.75 X 70.5% +0.25X 80.04%) 98.5%= 71.79%由此可得100kg混合原料可制得的12°热麦汁量为:(71.79 - 12)X 100= 598.3kg12°麦汁在20C时的相对密度为1.084,而100C热麦汁的体积是20C时的1.04倍, 故热麦汁(100 C)的体积为:(598.3 - 1.084 )X 1.04 = 574 ( L)(2)冷麦汁量为574 X( 1-0.075 )= 531 (L)(3)发酵液量为:531 X( 1-0.016)= 522.5 (L)(4)过滤酒量为:522.5 X( 1 —0.015)= 514.7 ( L)(5)成品啤酒量为:514.7X( 1 —0.02)= 504.4 ( L)4. 生产100 L 12 °淡色啤酒的物料衡算从上可知,100kg混合原料可生产12°成品淡色啤酒504.4 L,故可得:(1)生产100 L 12。


物料衡算和热量衡算物料衡算根据质量守恒定律,以生产过程或生产单元设备为研究对象,对其进出口处进行定量计算,称为物料衡算。
通过物料衡算可以计算原料与产品间的定量转变关系,以及计算各种原料的消耗量,各种中间产品、副产品的产量、损耗量及组成。
物料衡算的基础物料衡算的基础是物质的质量守恒定律,即进入一个系统的全部物料量必等于离开系统的全部物料量,再加上过程中的损失量和在系统中的积累量。
∑G1=∑G2+∑G3+∑G4∑G2:——输人物料量总和;∑G3:——输出物料量总和;∑G4:——物料损失量总和;∑G5:——物料积累量总和。
当系统内物料积累量为零时,上式可以写成:∑G1=∑G2+∑G3物料衡算是所有工艺计算的基础,通过物料衡算可确定设备容积、台数、主要尺寸,同时可进行热量衡算、管路尺寸计算等。
物料衡算的基准(1)对于间歇式操作的过程,常采用一批原料为基准进行计算。
(2)对于连续式操作的过程,可以采用单位时间产品数量或原料量为基准进行计算。
物料衡算的结果应列成原材料消耗定额及消耗量表。
消耗定额是指每吨产品或以一定量的产品(如每千克针剂、每万片药片等)所消耗的原材料量;而消耗量是指以每年或每日等时间所消耗的原材料量。
制剂车间的消耗定额及消耗量计算时应把原料、辅料及主要包装材料一起算入。
热量衡算制药生产过程中包含有化学过程和物理过程,往往伴随着能量变化,因此必须进行能量衡算。
又因生产中一般无轴功存在或轴功相对来讲影响较小,因此能量衡算实质上是热量衡算。
生产过程中产生的热量或冷量会使物料温度上升或下降,为了保证生产过程在一定温度下进行,则外界须对生产系统有热量的加入或排除。
通过热量衡算,对需加热或冷却设备进行热量计算,可以确定加热或冷却介质的用量,以及设备所需传递的热量。
热量衡算的基础热量衡算的基础是能量守恒定律,在无轴功的条件下,进入系统的热量与离开热量相互平衡。
实际生产中传热设备的热量衡算可由下式表示。
Q1+Q2+Q3=Q4+Q5+Q6Q1——物料进入设备带入热量,kJ;Q2——由加热剂或冷却剂传给设备和物料的热量,kJ;Q3——过程热效应,kJ;Q4——物料离开设备带出的热量,kJ;Q5——消耗在加热设备各个部件上的热量,kJ;Q6——设备向四周散失的热量,kJ。
3物料衡算和热量衡算计算基准年产 4500 吨的二氯甲烷氯化汲取,年工作日 330 天,每日工作 24 小时,每小时产二氯甲烷:=h物料衡算和热量衡算反响器的物料衡算和热量衡算本反响为强放热反响,如不控制反响热并移走,温度会急剧高升,产生激烈的焚烧反响,是氯化物发生裂解反响。
由此能够经过加入过度的甲烷获得循环气,以之作为稀释剂移走反应热。
(一)计算依照(1)二氯甲烷产量为:kg/h ,即:kmol/h ;(2)原料构成含: Cl296%,CH495%;(3)进反响器的原料配比(摩尔比):Cl2:CH4:循环气 =1::(4)出反响器的比率: CH2Cl2:CHCl3=1:(质量比)(CHCl3+CCl4)/CH2Cl2=(摩尔比);(5)操作压力:(表压);(6)反响器入口气体温度25o C,出口温度 420o C。
(二)物料衡算反CH3ClCl2CH2Cl2应CHCl3CH4CCl4HCl假定循环气不参加反响,只起到带走热量的作用。
则设入口甲烷为X kmol/h,出反响器的一氯甲烷Y kmol/h,氯化氢Z kmol/h。
由进反响器的原料配比(摩尔比)Cl2:CH4:循环气 =1::原料构成含: Cl296%, CH495%。
可知:=得入口Cl2为kmol/h由 CH2Cl2: CHCl3=1:(质量比)可得 CHCl3每小时产量为:× =h由 (CHCl3+CCl4)/CH2 Cl2=(摩尔比)可得 CCl4的量为×- =h用元素守衡法则: Cl 元素守衡=Y+×2+×3+× 4+Z①H 元素守衡4X=3Y+×2++Z②C 元素守衡X=Y+++③解方程①①③得X=hY=hZ=h(1)所以反响器入口原猜中各组分的流量:Cl2: ×=h=h (纯)=h=h (含杂质)CH4:h=h(纯)=h=h(含杂质)循环气流量: 3×= kmol/h= Nm3/h此中: CH3Cl: kmol/hN2:× 4%+× 3%= kmol/hCO2:× 2%= kmol/hCH4:--- = kmol/h入口气体总量:++= kmol/h( 2)反响器出口中各组分流量:CH3Cl: kmol/hCH2Cl2: kmol/hCHCl3: kmol/hCCl4:kmol/hHCl:kmol/h循环气:kmol/h出口气体总量:++++= kmol/h( 3)出口气体中各组分的含量:CH3Cl:×100%=%CH2Cl2:× 100%=%CHCl3:×100%=%CCl4:×100%=%HCl:× 100%=%N2:×100%=%CO2:×100%=%CH4:× 100%=%表 3— 1 反响器物料均衡组分反响器入口反响器出口kmol/h构成 %(mol )kg/h kmol/h构成%(mol)kg/h CH4Cl2CH3ClCH2Cl2CHCl3CCl4HClN2CO2总计100100(三)热量衡算以 25℃为基准温度由《氯碱工业理化常数手册》查得以下数据:表 3—2 反响物料标准摩尔生成焓f/ ( kJ/mol)物质输入输出CH Cl CO CH Cl CH Cl CHCl CClHCl42232234 n(kmol)f0-100f∑生成物 nθfθ6f m -∑反响物n m=-× 10 kJ =H H420℃时,由《氯碱工业理化常数手册》查得以下数据:表 3—3 生成物的标准摩尔定压热容/(J﹒ K-1﹒mol-1)物质CH3 2 234HCl N2CO2Cl CH Cl CHCl CCl n(kmol)t = 420- 25=395℃输出焓:∑H = ∑n t = ×106输出kJ输入焓:∑输入 H = 0则放出的热量: Q 放出 =f+∑输出 H+∑输入 H=-× 106 kJ℃时,由《氯碱工业理化常数手册》查得以下数据:表 3—4 循环气各物质的标准摩尔定压热容/(J﹒ K-1﹒mol -1)物质CH43N2CO2CH Cln(kmol)循环气带出热量: Q 带出 =∑n t=× 106 kJ考虑 4%热损失,则× 106×( 1-4%)=则 Q放出= Q带出循环气能带走的热量恰巧为反响气放出的热量,是反响温度保持在420℃左右能够保持反响顺利进行。
物料衡算和热量衡算在化工生产过程中,原料、水、电、蒸汽消耗量、主副产品产量等,都是十分重要的工艺指标。
为了得到这些数值,衡量生产过程的先进性,需要进行生产过程中局部的或全过程的物料衡算和热量衡算。
第一节物料衡算一、物料衡算及其分类物料衡算是根据质量守恒定律,对化工过程中的各股物料进行分析和定量计算,以确定它们的数量、组成和相互比例关系,并确定它们在物理变化或化学变化过程中相互转移或转化的定量关系的过程。
通过物料衡算计算转化率、选择性,筛选催化剂、确定最佳工艺条件,对装置的生产情况做出分析,判断装置是否处于最佳运转状态,为强化生产过程提供依据和途径。
因此,物料衡算是化工科研、设计、生产及其它工艺计算、设备计算的基础。
物料衡算按其衡算范围,有单元操作(或单个设备)的物料衡算与全流程(即包括各个单元操作的全套装置)的物料衡算;按其操作方式,有连续操作的物料衡算与间歇操作的物料衡算;按有无反应过程,有无化学反应过程的物料衡算与有化学反应过程的物料衡算;此外,还有带循环的化工过程的物料衡算。
物料衡算的计算一般分为两种情况。
一种是在已有的装置上,对一个车间、一个工段、一个设备或几个设备,利用实际测定的数据(或理论计算数据),算出另外一些不能直接测定的物料量,由此,对这个装置的生产情况作出分析,找出问题,为改进生产提出措施。
另一种是对新车间、新工段、新设备作出设计,即利用本厂或别的工厂已有的生产实际数据(或理论计算数据),在已知生产任务下算出需要原料量,副产品生成量和三废的生成量,或在已知原料量的情况下算出产品,副产品和三废的量。
二、物料衡算的依据和衡算范围物料衡算的理论依据是质量守恒定律,即在一个孤立的系统中,不论物质发生任何变化,其质量始终不变。
质量守恒定律是对总质量而言的,它既不是一种组分的质量,也不是指体系的总摩尔数或某一组分的摩尔数。
在化学反应过程中,体系中组分的质量和摩尔数发生变化,而且在很多情况下总摩尔数也发生变化,只有总质量是不变的。
化工设计物料衡算和热量衡算化工设计物料衡算和热量衡算是化工工程设计中非常重要的内容。
物料衡算是指在化工工程中对物料的流动进行计算和衡量的过程,而热量衡算则是指对化工工程中的热量流动进行计算和衡量的过程。
下面将详细介绍这两个内容。
首先,物料衡算是化工工程设计中的一个必不可少的环节。
物料衡算要基于反应的化学反应原理或工艺流程,计算出物料的各项数据,如流量、摩尔质量、摩尔仓数等。
具体的衡算步骤包括:确定物料的基本特性,如摩尔质量、密度等;确定物料的流动量和流速;根据反应方程式和反应器的驱动力,计算出反应速率;进一步计算出反应器的物料应用时间(HRT),以衡量物料在反应器中的停留时间。
物料衡算的目的是为了选择合适的设备和工艺流程,以确保化工工程的安全运行。
通过物料衡算,可以计算出物料在不同设备中的流速和停留时间,从而判断是否需要增加搅拌装置或延长反应器的体积等改进措施。
此外,物料衡算还能帮助设计人员确定各种物料转移设备的大小和形式,以满足工艺流程的需求。
其次,热量衡算是物料衡算的重要组成部分,也是化工工程中的关键环节。
热量衡算要根据物料的热力学特性及其运动过程,计算出热量的流动和传递。
具体的衡算步骤包括:测定物料的初始和终止温度;计算物料的比热容和比焓;计算物料在设备中的热量传递和损失;计算过程中发生的温度变化和热量变化;计算设备的热损失和热水平;最终评估设备的热效率。
热量衡算的目的是为了保证化工工程的热平衡和能量效率。
通过热量衡算,可以计算出各个设备和工艺过程的热量损失和热交换,从而判断是否需要增加散热装置或回收热量等改进措施。
此外,热量衡算还能帮助设计人员确定各种热交换设备的大小和形式,以满足工艺流程的需求。
总结来说,物料衡算和热量衡算是化工工程设计中非常重要的内容。
物料衡算可以帮助设计人员选择合适的设备和工艺流程,确保化工工程的安全运行;热量衡算则可以保证化工工程的热平衡和能量效率。
通过物料衡算和热量衡算,设计人员可以更好地优化工艺流程,提高化工工程的效率和经济性。