1.2核外电子排布与元素周期表_图文.ppt
- 格式:ppt
- 大小:1.03 MB
- 文档页数:10

原子核外电子排布与元素周期律一、核外电子的排布规律⑴核外电子运动的特征:质量小,运动空间小,运动速度快,没有确定的轨道。
(2)电子云:电子在核外空间作高速运动,没有确定的轨迹,好象带负电荷的云雾笼罩在原子核的周围,人们形象地称之为电子云。
(3)电子层:根据电子的能量差别和通常运动区域离核的远近不同,核外电子处于不同的电子层。
(4)电子层排布倾向能量最低:核外电子总是尽先排布在能量最低的电子层里,然后由里往外,依次排布在能量逐步升高的电子层里。
(5)各电子层容纳的电子数:各电子层最多容纳的电子数是2n 2个,最外层电子数不超过8个(K 层不超过2个),次外层电子数不超过18个,倒数第三层不超过32个。
(6)电子层排布的表示方法:原子结构示意图1、排布规律⑴核外电子排布与能量关系电子离核距离: 近 → 远 电子能量: 低 → 高 ⑵核外电子的分层排布 ① 核外电子层能量不同 电子层离核距离: 近 → 远 电子能量: 低 → 高电子层数(n ): 1 (K) 2(L) 3 (M) 4 (N) 5 (O)② 电子排布规律Ⅰ 能量最低原理:先排满低能量电子层,再依次排布在能量较高的电子层中。
Ⅱ 各电子层最多容纳的电子数:2n 2 Ⅲ 最外层电子数≤8 Ⅳ 次外层电子数≤18 Ⅴ 倒数第三层电子数≤32注意:以上三条规律不是孤立的,而是相互制约,必须同时满足。
2、常见元素微粒结构特点稀有气体元素原子的电子层结构与同周期的非金属元素的阴离子的电子层结构相同,与下一周期的金属元素形成的阳离子的电子层结构相同。
如:(1)核外有2个电子微粒(与He 原子电子层结构相同的离子):H -、Li +、Be 2+ (2)核外有10个电子微粒(与Ne 原子电子层结构相同的微粒):阳离子:+Na 、+2Mg 、+3Al 、+4NH 、+O H 3;阴离子:N -3、O -2、F -、OH -、NH -2;分子:Ne 、HF 、H 2O 、NH 3、CH 4(3)核外有18个电子微粒(与Ar 原子电子层结构相同的微粒):离子:Cl -、S 2-、P 3-、K +、Ca 2+ 分子:Ar 、HCl 、H 2S 、SiH 4、H 2O 2、PH 3、C 2H 6 (4)前18号元素的原子构的特殊性○111 H ○2最外层有1个电子的元素:H 、Li 、Na ○3最外层有2个电子的元素:Be 、Mg 、He ○4最外层电子数等于次外层电子数的元素:Be 、Al 。

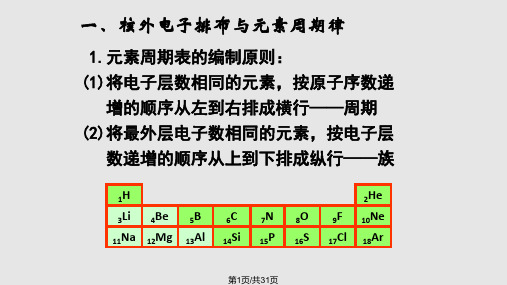
第二节 元素周期律第 1 课时 原子核外电子的排布 元素周期律一、原子核外电子的排布1.原子核外电子的分层排布 在多电子的原子里,电子的能量并不相同。
能量低的,通常在离核______的区域运动;能量高的,通常在 离核______的区域运动。
核外电子的分层运动,又叫核外电子的分层排布。
其关系如下:电子层1(K) 2(L) 3(M) 4(N) 5(O) 6(P) 7(Q)离核远近近→远能量高低低→高2.原子核外电子的排布规律3.原子(离子)结构示意图 (1)原子(离子)结构的表示方法,如下所示:(2)原子结构示意图中,核内质子数等于核外电子数,而离子结构示意图中,二者不相等。
如: Na+____________ Cl−____________。
阳离子:核外电子数小于核电荷数。
阴离子:核外电子数大于核电荷数。
二、元素周期律1.原子结构的周期性变化 (1)元素原子核外电子排布的周期性变化1规律:随着原子序数的递增,主族元素原子的最外层电子排布呈现从 1-8 的周期性变化(第一周期除外)。
(2)元素原子半径的周期性变化规律:随着原子序数的递增,主族元素的原子半径呈现从大到小的周期性变化。
2.元素性质的周期性变化 (1)元素主要化合价的周期性变化规律:随着原子序数的递增,元素的最高正化合价呈现+1→+7,最低负化合价呈现−4→−1 的周期性变化。
(2)元素金属性、非金属性的周期性变化①Na、Mg、Al 与水(或酸)反应的比较NaMgAl规律(同周期从左到右)与冷水几乎不反应,单 质 与 水 ( 或 与 冷 水 剧 烈 反 与沸水反应缓慢,放 与酸反应较快, 从水或酸中置换 H2 能力酸)反应应,产生氢气 出氢气;与酸反应剧 放出氢气逐渐减弱烈,放出氢气2最高价氧化物 对应的水化物 碱性强弱NaOH____碱Mg(OH)2______碱Al(OH)3 两性氢 最高价氧化物对应的水氧化物化物碱性逐渐减弱②Si、P、S、Cl 四种元素性质的比较规律(同周期从左SiPSCl到右)单质与氢气反应 高温的条件磷蒸气与氢气 加热能反应光照或点燃 时发生爆炸 而化合与 H2 化合能力逐 渐增强形成的气态氢化物的热稳定性SiH4 很不稳定PH3 不稳定H2S 受热分解 HCl 稳定气态氢化物的热 稳定性逐渐增强最高价氧化物对应 的 水 化 物 ( 含 H2SiO3____酸 氧酸)酸性强弱H3PO4_____酸HClO4 强 酸 最高价氧化物对H2SO4____酸 (比 H2SO4 酸 应的水化物酸性性强)逐渐增强结论:随着原子序数的递增,元素的金属性、非金属性呈现周期性的变化。









