乙基纤维素在缓控释制剂中的应用概况
- 格式:pdf
- 大小:136.80 KB
- 文档页数:3

第十二章缓释与控释制剂★一、定义:1、缓释制剂:系指用药后能在较长时间内持续释放药物以达到长效作用的一类制剂。
2、控释制剂:系指药物在预定时间内,以预定速度恒定释放,使血药浓度长时间恒定维持在有效浓度范围的制剂。
广义上包括靶向制剂、透皮制剂等。
★二、缓控释制剂的特点:1、减少给药次数,提高病人的顺应性,方便应用;2、使血药浓度平稳,避免峰谷现象,有利于降低药物的毒副作用;3、可减少用药剂量。
★三、缓释、控释原理的方法:(一)溶出原理:控制溶出的方法:1、制成溶解度小的盐或酯:青霉素的普鲁卡因盐、丙酸睾丸素2、与高分子化合物生成难溶性盐:N—甲基阿托品鞣酸盐、鱼精蛋白锌胰岛素3、控制粒子大小:超慢性胰岛素4、将药物包埋于溶蚀性骨架中:以脂肪、蜡类为缓释骨架,以脂肪、蜡类为骨架材料,药物以溶解或混悬形式分散5、将药物包藏于亲水性胶体中:(1)亲水凝胶骨架片:在体液中逐渐吸水膨胀,药物逐渐扩散到表面而溶解于体液中(2)骨架材料:MC、HPMC、PVP、Carbomer、PVA、羟丙基淀粉、海藻酸钠等(二)扩散原理:★控制扩散的方法:包衣、微囊化、制成不溶性骨架片、增加粘度以减少扩散速度、制成植入剂、制成药物树脂、制成乳剂1、通过包衣膜扩散(贮库型):药物组成的芯即贮库,周围由聚合物膜包围,膜的性质决定药物从系统中的释放速度。
此种系统的优点为可以达到零级释放。
扩散过程可用Fick's第一定律来描述。
2、通过骨架扩散(骨架型):骨架型是药物均匀分散在聚合物骨架中,药物在外层溶液中溶解,然后扩散出骨架,使固体药物不断溶出。
此种骨架片中药物释放是通过骨架中许多弯弯曲曲的孔道扩散进行的,该过程符合Higuchi方程。
(三)利用溶蚀作用(Erosion):溶蚀是溶出限速和扩散限速相结合的过程,其释放特性用数学方法描述可能是很复杂的,一般用可溶蚀的厚块(slabs)、圆筒和球形的模型来描述其释放机制。
(四)利用渗透作用(Osmosis):利用渗透压原理制备的控释制剂,能恒速释放药物。

难溶性药物(BCS11、IV类)缓控释制剂研究进展发布时间:2021-12-30T06:54:17.244Z 来源:《医师在线》2021年8月16期作者:朱宇飞沙耕宇张欣[导读]难溶性药物(BCS11、IV类)缓控释制剂研究进展朱宇飞沙耕宇张欣(生命科学与生物制药学院、生物制药专业;江苏扬州225100)摘要:难溶性药物因其在水中溶解度小, 药物难以被机体吸收, 体内消除速度较快, 血药浓度容易出现峰谷现象, 口服制剂生物利用度低, 且难以实现剂型的多样化。
目前所具有的技术如合成水溶性前体药物,微乳增溶,超微粉末技术等,均可提高生物利用度。
缓控释制剂具有服药顺应性长,血药浓度平稳毒副作用低,降低肠胃刺激等优点。
难溶性药物的缓控释制剂已经成为药剂学研究的热点方向。
本文就难溶性药物的增溶及其缓控释制剂的研究进展进行详细介绍。
Abstract:Because of its low solubility in water, insoluble drugs are difficult to be absorbed by the body, the elimination speed is fast and the blood concentration is easy to appear peak valley phenomenon.However the oral preparation bioavailability is low, and it is difficult to realize the diversification of dosage forms. Currently available technologies such as synthesis of water-soluble precursor drugs, microemulsion solubilization, ultrafine powder technology, etc.,which can improve the bioavailability. The sustained and controlled release preparation has the advantages of long compliance, stable blood concentration, low toxicity and reducing gastrointestinal irritation. The sustained-release and controlled-release preparations of insoluble drugs have become a hot research direction in pharmaceutics. In this paper, the research progress of solubilization and sustained controlled release preparations of insoluble drugs were introduced in detail.第二章难溶性缓释药物(BCSII类.IV类)的增溶方法2.1 合成水溶性前体药物的分类及其应用合成水溶性前体药物通过修饰成酯、成盐、或进行分子结构修饰形成以共价键结合亲水性大分子的前体药物, 可增加难溶性药物的水溶性。
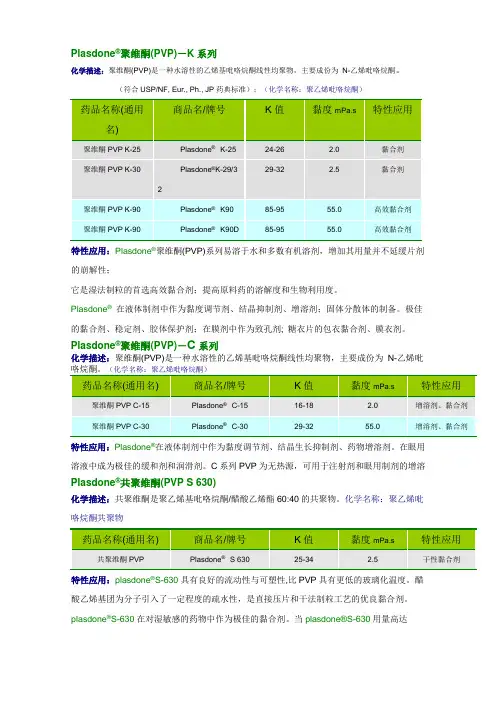
Plasdone®聚维酮(PVP)-K系列化学描述:聚维酮(PVP)是一种水溶性的乙烯基吡咯烷酮线性均聚物,主要成份为N-乙烯吡咯烷酮。
(符合USP/NF, Eur., Ph., JP药典标准);(化学名称:聚乙烯吡咯烷酮)特性应用:Plasdone®聚维酮(PVP)系列易溶于水和多数有机溶剂,增加其用量并不延缓片剂的崩解性;它是湿法制粒的首选高效黏合剂;提高原料药的溶解度和生物利用度。
Plasdone®在液体制剂中作为黏度调节剂、结晶抑制剂、增溶剂;固体分散体的制备。
极佳的黏合剂、稳定剂、胶体保护剂;在膜剂中作为致孔剂; 糖衣片的包衣黏合剂、膜衣剂。
Plasdone®聚维酮(PVP)-C系列化学描述:聚维酮(PVP)是一种水溶性的乙烯基吡咯烷酮线性均聚物,主要成份为N-乙烯吡特性应用:Plasdone®在液体制剂中作为黏度调节剂、结晶生长抑制剂、药物增溶剂。
在眼用溶液中成为极佳的缓和剂和润滑剂。
C系列PVP为无热源,可用于注射剂和眼用制剂的增溶Plasdone®共聚维酮(PVP S 630)化学描述:共聚维酮是聚乙烯基吡咯烷酮/醋酸乙烯酯60:40的共聚物。
化学名称:聚乙烯吡咯烷酮共聚物特性应用:plasdone®S-630具有良好的流动性与可塑性,比PVP具有更低的玻璃化温度。
醋酸乙烯基团为分子引入了一定程度的疏水性,是直接压片和干法制粒工艺的优良黏合剂。
plasdone®S-630在对湿敏感的药物中作为极佳的黏合剂。
当plasdone®S-630用量高达50%W/W时,增加薄膜衣的光泽。
plasdone®S-630可用来提高原料药的溶解度和生物利用度。
提高片剂包衣对疏水片芯的结合力。
具有极佳的成膜性和皮肤亲和性。
plasdone®S-630已被开发用作水溶剂和有机溶剂配方中的基本成膜剂的优良添加剂;并适用于遇湿敏感片芯的包衣。

中 国 药 科 大 学 学 报Journal of China Pharmaceutical University 1999,30(3):192~195用乙基纤维素制备酮洛芬缓释固体分散体的研究Ξ程紫骅 庄洪波1 武华丽2 朱家璧(中国药科大学中昆药剂研究所,南京210009;1江苏天晴制药总厂,连云港222002)摘 要 为评价以水不溶性聚合物EC为载体,用固体分散技术(溶剂法)制备难溶性药物酮洛芬缓释固体分散体,并进行DSC和体外释放度研究。
DSC结果表明:药物与EC比例为1∶2和1∶3时药物以非晶态存在于载体中。
体外释放度试验结果表明,药物体外释药行为均符合Higuchi方程;缓释效果与EC量和固体分散体的粒径有主要关系,药物释放速率随EC用量和粘度增加而减小;固体分散体粒径越小药物体外释放速率越快;在p H6.8介质中的体外释放速率高于在p H1.2介质。
关键词 酮洛芬;缓释;固体分散体;乙基纤维素 自从1961年Sekiguchi[1]等首次采用熔融法将难溶性药物与水溶性材料制成固体分散体,提高了难溶性药物的溶出以来,固体分散技术已广泛应用于难溶性药物,以提高生物利用度。
近年来,又有国外学者用水不溶性聚合物、肠溶性脂质材料为载体制备缓释固体分散体的报道[2~5],从而使固体分散体的研究进入了新的发展阶段,同时为缓释制剂的制备开辟了一条新途径。
为研究和评价水不溶性聚合物—乙基纤维素作为载体,用固体分散技术制备缓释制剂,本文选用水不溶性药物酮洛芬(K etoprofen,KPF)为模型药物,制备缓释固体分散体,并对其缓释性质进行研究。
1 材料和仪器1.1 材料与仪器酮洛芬(西南合成制药厂);乙基纤维素(EC,粘度为10、20、45、100mPa・s,美国Dow公司);十二烷基硫磺钠(SL S,化学纯,上海光华化学试剂厂,进口分装),无水乙醇,二氯甲烷等均为市售分析纯试剂。
DSC METT LER,METT LER AE240天平(瑞士),752C型紫外可见分光光度计(上海第三分析仪器厂);ZRS24智能溶出仪(天津大学无线电厂); PERKIN2E LMER LAMBDA2UV/VIS(美国)。

羟乙基纤维素辅料在药物制剂中的应用任麒,沈慧凤上海医药工业研究院浦力膜制剂辅料科技公司,上海1概述羟乙基纤维素(Hydroxyethl Cellulose, HEC)属非离子水溶性高分子聚合物,白色或类白色、无味,易流动的粒状粉末。
在化学上是纤维素与氢氧化钠处理后,再经与环氧乙烷反应为羟乙基醚化过程而制得一系列羟乙基纤维素醚。
分子式为[C12H21.5O8]n,结构式见图1:图1 羟乙基纤维素的典型结构图HEC的软化温度为135~140℃,一般情况下,它不溶于大多数有机溶剂,但由于分子内含有亲水性的羟乙基,故容易在冷水或热水中溶解,2%水溶液的pH为6.5~8.5,随着所用不同粘度规格而表现出广泛的粘度范围,在pH2~12范围之间粘度变化较小,且其溶液不受阳离子影响,可与大多数水溶性聚合物、表面活性剂、盐共存,是一种能容纳含高浓度电解质溶液的优良的胶体增稠剂。
高浓度时,表现为非牛顿型流体特性,假塑性程度主要取决于取代基的分布,分布愈均匀,即不存在未取代或取代不充分的链段或分子链,触变性愈小,假塑性愈高;低浓度时为牛顿型流体。
在药剂中主要用作增稠剂、胶体保护剂、粘合剂、分散剂、稳定剂、助悬剂、成膜剂以及缓释材料,可应用于局部用药的乳剂、软膏、滴眼剂,口服的液体、固体片剂、胶囊等多种剂型中[1]。
羟乙基纤维素目前已收载于美国药典/美国国家处方集和欧洲药典等。
常用的规格如表1:表1 各种级别的羟乙基纤维素(HEC)典型的溶液粘度值及分子量规格水溶液浓度(%)粘度值mPa.s(cps) 分子量HHX a 1 3500~5500 1,300,000HX a 1 1500~2500 1,000,000M a 2 4500~6500 720,000G a 2 250~400 300,000L a 5 75~150 90,000BH-400b 2 300~600BH-2000 b 2 1500~2500BH-5000 b 2 4500~8000BH-30000 b 2 28000~34000BH-60000 b 2 55000~65000BH-80000 b 2 75000~85000注:a为美国Aqualon公司的Natrosol®250 NF药用级羟乙基纤维素产品规格。

纤维素醚类衍⽣物在缓释制剂辅料中的应⽤纤维素醚类衍⽣物在缓释制剂辅料中的应⽤摘要药⽤辅料是药物制剂的基础材料和重要组成部分,缓释制剂中起缓释作⽤的辅料多为⾼分⼦化舍物。
综述了⾼分⼦材料纤维素醚类衍⽣物中羧甲基纤维素钠、甲基纤维素、⼄基纤维素、羟丙基甲基纤维素和羟丙基纤维素等作为药⽤辅料在缓释制剂中的应⽤,并展望了其应⽤前景。
关键词⾼分⼦材料缓释制剂药⽤辅料1前⾔缓释制剂可按需要在预定期间内向⼈体提供适宜的⾎药浓度,减少服⽤次数并可获得良好的治疗效果,其重要特点是使⼈体内此种⾎药浓度维持较长时间,可以避免普通制剂频繁给药所出现的“峰⾕”现象,能提⾼药物的安全性、有效性。
⼝服缓释制剂通常根据药物的溶出、扩散、渗透及离⼦交换和胃肠道的⽣理特性,主要是通过选适宜的辅料,采⽤制剂⼿段延缓药物在胃肠道内的释药速率和制剂的输送速度,达到缓释释放的⽬的[1]。
药⽤辅料作为药物制剂的基础材料和重要组成部分,在制剂成型的发展和⽣产中起着很重要的作⽤。
随着给药系统和给药部位的深⼊,促进了缓释制剂的制备技术和新品种的开发和发展。
近年来,缓释剂型发展较快的有缓释⼩丸、各种⾻架缓释制剂、包⾐缓释制剂、缓释胶囊、缓释药膜、树脂药缓释制剂和液体缓释制剂等。
在缓释制剂中,⾼分⼦材料⼏乎成为药物在传递、渗透过程中不可分割的部分,它们作为药⽤辅料在上述各种剂型中得到了⼴泛的应⽤。
在此体系中,⾼分⼦⼀般作为药物的载体,控制药物在⼈体内的释放速率,即要求在⼀定的时间范围内按设定的速率在体内缓慢释放,以达到有效治疗的⽬的[2]。
由于选⽤的⾼分⼦材料不同,药物的控制释放机制也不同,⽽且不同的剂型对药物缓释的影响也不同。
2 纤维素醚类衍⽣物在药物制剂辅料中的主要作⽤各类缓释材料都是以⾃⾝的特性,改变药物溶出和扩散速度的因素,通过控制药物释放和吸收⽽达到延效⽬的的。
缓释制剂中起缓释作⽤的辅料多为⾼分⼦化合物。
⾼分⼦药物缓释材料是近年来医药领域中的热门研究课题之⼀。



乙基纤维素包制的微丸或小丸缓控释制剂原理乙基纤维素(Hydroxypropyl Methylcellulose, HPMC)是一种聚合物化合物,具有多种功能,包括作为药物缓释制剂的载体材料。
乙基纤维素包制的微丸或小丸缓控释制剂是一种常见的制剂形式,可以在药物治疗中起到很好的缓解和控释效果。
本文将从乙基纤维素包制的微丸或小丸缓控释原理、制备工艺和应用等方面进行详细探讨。
一、乙基纤维素包制的微丸或小丸缓控释原理乙基纤维素是一种半合成的纤维素衍生物,其结构中含有甲基和羟丙基等取代基。
在制备微丸或小丸缓控释制剂时,乙基纤维素作为载体材料,其主要原理是通过控制溶解度、粘度和膨胀性等特性,来实现药物的缓释和控释。
其具体原理如下:1.控释机制:乙基纤维素本身具有一定的溶解度和水合性,当乙基纤维素包制的微丸或小丸进入人体消化道时,会受到体液的渗透作用,从而导致微丸或小丸逐渐膨胀、溶解和释放药物。
同时,乙基纤维素分子中的羟丙基等取代基具有较好的亲水性,可以增加微丸或小丸与水的接触面积,从而加速体内药物的释放。
2.缓释机制:乙基纤维素的分子结构中含有大量的羟基,这些羟基可以与药物分子发生氢键作用,形成稳定的包合物。
这种包合物可以降低药物分子的溶解度和扩散速率,从而实现药物的缓释作用。
此外,乙基纤维素本身在水中的溶解度较低,可以有效延缓药物的释放速度。
3. pH敏感性:乙基纤维素包制的微丸或小丸在不同的pH环境下具有不同的水合性和溶解特性。
例如,当微丸或小丸进入胃酸环境时,乙基纤维素会发生膨胀,形成稳定的胃酸保护膜,延缓药物的释放速度;而在肠道环境下,乙基纤维素会逐渐溶解和释放药物,实现肠溶效果。
总之,乙基纤维素包制的微丸或小丸通过控制水合性、溶解度和包合作用等原理,可以实现药物在体内的缓释和控释,从而增强药物的疗效和降低副作用。
二、乙基纤维素包制的微丸或小丸缓控释制剂的制备工艺制备乙基纤维素包制的微丸或小丸缓控释制剂的工艺流程主要包括原料选择、溶液制备、微丸或小丸制备、干燥和包装等环节。

民营科技2018年第5期科技创新药用辅料乙基纤维素在药物制剂中的应用探讨陈静(南阳医学高等专科学校,河南南阳473000)药用辅料是生产药品和调配处方时使用的赋形剂和附加剂;是除活性成分以外,在安全性方面已经进行了合理的评估,且包含在药物制剂中的物质。
在药物被加工成型的过程中,药用辅料在药物制剂中扮演着重要的角色,除了赋形、充当载体、提高稳定性,还具有增溶、助溶等重要作用,并且对药品的质量、安全性和有效性起着重要影响[1]。
乙基纤维素作为药物制剂制备的过程中应用广泛的一种重要药用辅料,具有无毒、无过敏性、无刺激性的特点,广泛用于口服和外用制剂中,可用作黏合剂、缓释制剂骨架材料、包衣材料、微囊囊材、药物载体和背衬材料等,在药物新剂型的研究方面发挥着重要的作用。
1乙基纤维素的基本性质乙基纤维素(EC),是纤维素的乙基醚,是乙氧基置换羟基的纤维素衍生物,具有不同的分子量和黏度。
乙基纤维素为白色颗粒或粉末,无臭、无味;在甲苯或乙醚中易溶,在二氯甲烷中溶解,在乙酸乙酯、甲醇中微溶,在水、甘油、丙二醇中不溶;松密度为0.4g/cm3,玻璃化温度为129~133℃,密度为1.12~1.15 g/cm3。
乙基纤维素的溶解性质与其取代度有关,取代度为2.17~2.35时,可溶解在甲苯-乙醇(60/40,w/w);而取代度为2.35~2.62时,则在甲苯-乙醇(80/20,w/w)。
乙基纤维素性质稳定,耐碱耐盐,对酸比纤维素酯敏感。
另外,乙基纤维素溶液的黏度与浓度和溶剂类型有关,随浓度增加,溶液黏度增大[2]。
2乙基纤维素在药物制剂中的应用2.1缓释骨架材料乙基纤维素单独或与亲水性辅料合用可作为药物的缓释骨架材料,通过调节处方中乙基纤维素的比例可以控制药物的释放速度,随其用量的增加,药物的释放速度下降。
在奥沙西罗包衣控释片的制备中[3],以乙基纤维素为骨架材料,考察了处方因素等对制剂质量和体外释放能力的影响。
结果显示,骨架材料的用量对制剂的释药行为有影响,随骨架材料用量的增大,形成的水不溶性骨架孔隙越小,从而使释药速率减慢。

・8・安徽医药AnhuiMedicalandPharnmeeutiealJournal2008January;12(1)乙基纤维素在缓控释药物制剂中的应用关键词:乙基纤维素;缓控释陈磊,周亚球(安徽中医学院药学院,安徽合肥230038)缓控释包衣材料中,乙基纤维素(Ethylcellulose,EC)具有良好的成膜性和疏水性而成为最常用的辅料之一。
EC为白色或浅灰色的流动性粉末,无臭,EC不溶于水,可溶于各种有机溶剂,热稳定性好,燃烧时灰分极低,很少有粘着感或发涩,能生成坚韧薄膜,在低温时仍能保持挠曲性,无毒,有极强的抗生物性能,代谢惰性,但在阳光下或紫外光下易发生氧化降解。
EC是纤维素的乙基醚,含乙氧基团(一OC:H)在44.0%至51.0%之间(USNFXI)。
将氯乙烷与碱性纤维素(将粗纤维素用碱液处理)反应即得乙基纤维素。
每一个无水葡萄糖单位有三个活的羟基可被乙氧基化。
・结构中所有三个羟基都被乙氧基化,则称取代度(DS)为3.0。
实际应用中,DS可随聚合物最终的应用而变。
纤维素在一定条件下发生乙基化反应得之。
常用乙基化试剂是一氯乙烷,也可有乙醇、硫酸二乙酯等…。
反应如下:[c6H702(OH)3]。
—NaO_H[C6H702(ONa)]。
—CH_3CH2CI[C6H702(OCH2CH3)3]。
EC最初用于涂料、粘台剂、胶粘剂、纸张藏胶剂、织物整理剂、颜料膏等,随着医药工艺的发展,由于其良好的生物相容性、无毒性、胃肠道不溶性等特点,在缓控释制剂中的使用越来越广泛,本文结合缓控释制剂释药机制,综述了EC在其领域的应用。
1EC在骨架型缓控释制剂的应用EC是既不溶解也不溶蚀的材料,其在骨架型中的释药机理是液体穿透骨架,将药物溶解,然后从骨架的沟槽中扩散出来,骨架在胃肠中不崩解,药物释放后整体从粪便排出。
不同粘度的EC制得的骨架片释放速度不同。
ShlieoutL21等对3种型号的EC(7、22、50cps)制成骨架片进行聚合物压缩测试和药物释放速度测试。
乙基纤维素在缓控释制剂中的应用研究郭波红1程怡2(广州中医药大学,510405,广东广州;2.广州中医药大学中药学院,510405,广东广州//第一作者女,1977年生,2000级硕士研究生)摘要:近年来,乙基纤维素在药物制剂中的应用越来越广泛,在骨架型缓释片、微丸、微囊、固体分散体及包衣制剂方面都可用乙基纤维素来制备缓释剂型。
本文按乙基纤维素在缓释制剂中的制剂工艺不同,对乙基纤维素在缓释制剂中近十几年来的应用情况进行了综述。
关键词:乙基纤维素;缓控释制剂;应用中图分类号:R944.4文献标识码:A文章编号:1009-5276(2002)05-0601-03乙基纤维素(EC)是纤维素链中的部分羟基被乙氧基取代的纤维素衍生物,是应用最广泛的水不溶性纤维素衍生物之一,在药剂中有多种用途,如:可用作片剂粘合剂、薄膜包衣材料,亦可用作骨架材料膜制备多种类型的骨架缓释片,用作混合材料制备包衣缓释制剂,缓释微丸,用作包囊辅料制备缓释微囊,还可作为载体材料广泛地用于制备固体分散体。
本文就缓释制剂的制备工艺不同,对乙基纤维素在缓释制剂中的应用情况进行了综述。
1制成骨架型缓释片制成不溶性骨架缓释片以不溶于水或水溶性极小的高分子聚合物或无毒塑料为材料制成的片剂,其药物释放主要分为三步:消化液渗入骨架孔内,药物溶解和药物自骨架孔道释出。
EC是常用的不溶性骨架材料之一。
由于脂溶性药物自骨架内释出的速度过缓,因而只有水溶性药物适于制备此种骨架片,其制法可将药物与EC混匀后压片,亦可将药物与EC一起湿法制粒后压片。
S.Indiran Pather等112以EC为主要骨架材料,调节EC和茶碱的不同配比,用直接压片的方法制备了难溶性药物茶碱缓释片,体外溶出度试验表明,用此方法制成的骨架型片剂体外释药符合Higuchi方程,治疗浓度的茶碱缓释片能持续释药12h。
制成微囊骨架型缓释片先将药物制成微囊,然后与EC的醇溶液和微晶纤维素混匀,制成软材,制粒,干燥后压片,所制备的氯化钾等微囊骨架片释药缓慢,可减少药物对胃肠道粘膜的刺激性,延长药物疗效。
关于药物缓释控释制剂的研究进展概述-药物制剂工程论文关于药物缓释控释制剂的研究进展概述摘要随着医药制剂技术的持续发展,医药界高度重视新产品、新剂型的开发研究。
与新化合物实体开发相比,新的制剂具有成本小、周期短而见效快的优势。
近年来,药物缓控释制剂的研究取得了较大的进展,而且具有广阔的研究与发展前景。
关键词:药物;缓释控释制剂;辅料;研究进展随着社会经济的日益增长,我国制药水平也不断发展。
近几年来,为了提高药物的使用率、缩短患者的治疗时间及减轻用药时给患者带来的巨大痛苦,国内的许多制药厂都成立了主要以研究药物制剂为主的部门。
此类制剂药物因具有给药次数少、对患者的肠胃刺激性小、治疗时间短、使用比较安全等作用,深受患者、医生的信赖。
由于缓释、控释药物制剂的应用率不断的上升,现今对缓释、控释药物制剂的要求也越来越严格。
药物的一般剂型是片剂和注射剂,但多数药物不适合应用这两种剂型。
对治疗糖尿病和心血管疾病的患者,若选择片剂、注射剂治疗时,当药物与血液循环融合后,会产生相对明显的血药浓度波动,出现了峰谷情况,容易产生毒副作用,使之有效治疗浓度较低不能很好的起到治疗的效果。
但缓释、控释药物制剂却克服了这一现象。
1、控释缓释制剂的优点近20 多年来,国外极为重视研究新剂型和新制剂的,其中的控释和缓释口服制剂是热点。
相比于普通制剂,缓控释制剂的优点在于:1.1 对于半衰期短,或者给药频繁的药物,可以减少服药的次数,使病人服药的顺应性得到提高,方便使用。
尤其对于需要长期服药的心血管疾病、心绞痛、高血压、哮喘等慢性疾病患者特别适用。
1.2 有利于平稳血药浓度,“减缓峰谷”现象,从而使发生不良药物反应的频率和严重程度得以降低,临床用药更为安全。
1.3 缓慢释放,增强药物的有效性。
药物在口服后释放出有效成分的速度缓慢,吸收速度也较恒定,药物作用时间维持较长。
1.4 使药物化学稳定性得到增强。
在贮存期间,某些药物的常规制剂往往容易失效变质,或者被胃酸破坏,而将其制成缓控释制后,可以定时、定位地加以释放,稳定性可以有效提高。
乙基纤维素在缓控释药物制剂中的应用陈 磊,周亚球(安徽中医学院药学院,安徽合肥 230038)关键词:乙基纤维素;缓控释缓控释包衣材料中,乙基纤维素(Ethylcellul ose,EC)具有良好的成膜性和疏水性而成为最常用的辅料之一。
EC为白色或浅灰色的流动性粉末,无臭,EC不溶于水,可溶于各种有机溶剂,热稳定性好,燃烧时灰分极低,很少有粘着感或发涩,能生成坚韧薄膜,在低温时仍能保持挠曲性,无毒,有极强的抗生物性能,代谢惰性,但在阳光下或紫外光下易发生氧化降解。
EC是纤维素的乙基醚,含乙氧基团(-OC2H)在44.0%至51.0%之间(US NFX I)。
将氯乙烷与碱性纤维素(将粗纤维素用碱液处理)反应即得乙基纤维素。
每一个无水葡萄糖单位有三个活的羟基可被乙氧基化。
结构中所有三个羟基都被乙氧基化,则称取代度(DS)为3.0。
实际应用中,DS可随聚合物最终的应用而变。
纤维素在一定条件下发生乙基化反应得之。
常用乙基化试剂是一氯乙烷,也可有乙醇、硫酸二乙酯等[1]。
反应如下:[C6H7O2(OH)3]n NaOHϖ[C6H7O2(ONa)]nCH3CH2Clϖ[C6H7O2(OCH2CH3)3]n EC最初用于涂料、粘台剂、胶粘剂、纸张藏胶剂、织物整理剂、颜料膏等,随着医药工艺的发展,由于其良好的生物相容性、无毒性、胃肠道不溶性等特点,在缓控释制剂中的使用越来越广泛,本文结合缓控释制剂释药机制,综述了EC在其领域的应用。
1 EC在骨架型缓控释制剂的应用EC是既不溶解也不溶蚀的材料,其在骨架型中的释药机理是液体穿透骨架,将药物溶解,然后从骨架的沟槽中扩散出来,骨架在胃肠中不崩解,药物释放后整体从粪便排出。
不同粘度的EC制得的骨架片释放速度不同。
Shlieout[2]等对3种型号的EC(7、22、50cp s)制成骨架片进行聚合物压缩测试和药物释放速度测试。
测定结果表明低粘度EC比高粘度EC 易压缩,当压成一定硬度的片剂时,低粘度EC中的药物释放速度较高粘度EC快。