初中化学知识结构图
- 格式:doc
- 大小:36.38 KB
- 文档页数:1

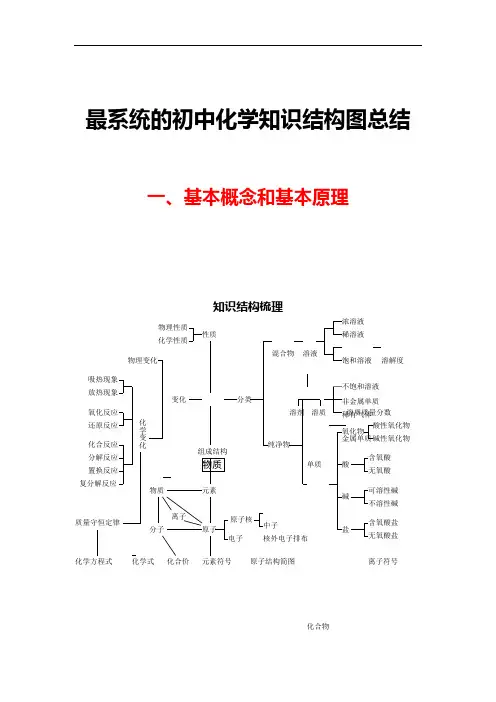
最系统的初中化学知识结构图总结一、基本概念和基本原理知识结构梳理溶液混合物浓溶液稀溶液溶解度饱和溶液不饱和溶液溶质质量分数质量守恒定律可溶性碱不溶性碱酸性氧化物碱性氧化物含氧酸盐无氧酸盐无氧酸含氧酸氧化物酸碱盐吸热现象放热现象氧化反应还原反应化合反应分解反应置换反应复分解反应原子结构简图元素符号离子符号化学方程式化学式化合价物质分类变化元素原子分子离子物质化合物纯净物单质金属单质非金属单质稀有气体物理变化化学变化组成结构性质物理性质化学性质溶剂溶质1、物质的组成结构(1)物质的微观构成构成物质的三种基本微粒:分子,原子,离子。
(2)分子、原子、离子的区别与联系离子结构简图质子(3)原子的结构①每个质子相对原子质量约等于1,约等于一个质子原子的质量。
质子②每个质子带一个单位的正电荷。
③决定元素种类。
原子核①每个中子相对原子质量约等于1,约等于一个氢原子的质量。
原中子②不带电荷。
③决定同类元素中的不同种原子。
子①每个电子带一个单位的负电荷。
②核外电子分层排布, 最外层电子数决定 元素化学性质 的性质。
原子中:核电荷数 = 质子 数 = 核外电子 数=原子序数 相对原子质量≈质子数+阳离子:核电荷数= 阴离子:核电荷数=(4)物质的宏观组成(物质是由自然界中的一百多种元素组成的) ①、元素:具有相同核电荷数(质子数)一类原子的总称。
②、③常见元素及元素符号④元素符号表示的意义 品种(宏观):表示 一种元素微粒(微观):①表示该元素的 一个原子 ②表示该元素的相对原子质量 ⑤元素分类及在自然界存在状态根据元素的原子结构和化学性质,元素可分为金属元素、非金属元素和稀有气体 。
元素在地壳中含量(按质量分数的由大到小)依次为:氧、硅、铝、铁、钙2、化学用语(1)常见元素化合价一价氯钠钾氢银,二价氧钙钡镁锌,三铝,四硅,五氮磷,二、三铁,二、四碳,二、四、六,硫都齐全,铜汞二价最常见,单质零价记心间。
(2)化学式的写法(在化合物中,正负化合价的代数和为零。

【同步教育信息】一. 本周教学内容:1. 了解原子的核外电子是分层排布及原子结构示意图的涵义。
2. 了解离子的概念。
3. 了解化合价的实质及正负价的含义并记住常见元素和原子团的化合价。
4. 了解元素化合价和化学式的关系,能根据化学式判断元素的化合价,并能根据元素的化合价写出物质的化学式。
5. 通过元素的性质跟它的原子结构关系的学习,掌握结构、性质之间的辩证关系。
6. 理解化学式的概念及化学式所表示的意义(①表示一种物质②表示组成该物质的元素③表示组成该物质的各元素的原子个数比)。
7. 能正确书写常见单质和两种元素组成并已知各元素原子个数比的化合物的化学式。
8. 理解化学式前和化学式中有关数字的不同的意义。
二. 重点分析和讲解1. 核外电子排布的初步知识(1)电子层及与电子能量关系从原子的结构得知原子核很小,电子也很小,电子在很大的一个区域内高速运动,但电子的运动并不是杂复无章的。
多电子原子中电子是分层运动的,核外电子根据能量的差异和通常运动的区域离核的远近不同,分属于不同的电子层。
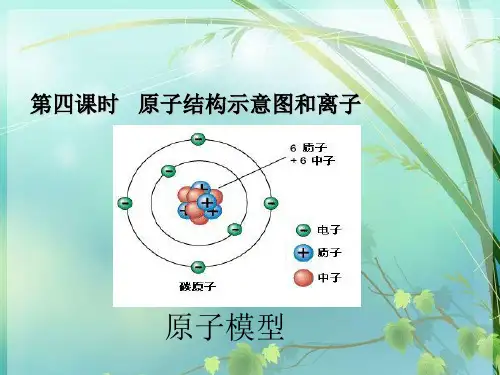
电子层及与电子能量关系如下:电子层数(n):1、2、3、4、5、6、7 表示符号:K、L、M、N、O、P、Q离核距离:由近→远能量高低:由低→高(2)原子结构示意图的含义原子结构示意图是用来表示核外电子排布状况的图示,可有助于理解核外电子的分层排布。
例如:用原子结构示意图表示钠原子的核外电子排布。
对于1~18号元素符号,名称要记住并且会画原子结构示意图。
1~18号元素原子核外电子排布有以下规律,掌握住便于记忆。
(3)元素的原子最外层电子的特点从1~18号元素的原子结构示意图可以看出,稀有气体元素、金属元素和非金属元素的原子最外层的电子数目及性质有如下特点。
元素分类原子最外层电子数结构特征化学性质金属元素1~3个电子不稳定结构在化学变化中,易失去最外层电子非金属元素4~7个电子在化学变化中,易得到电子稀有气体元素8个电子(氦2个电子)稳定结构稳定,一般不参加化学反应金属元素、非金属元素与稳定结构关系如下:由上面的分析和以前学过的知识,我们得到以下结论:a. 原子最外层电子数−−→−决定元素化学性质 b. 质子数(核电荷数)−−→−决定元素种类 c. 质子数与电子数−−→−决定微粒电性 (4)离子离子:带电的原子或原子团叫离子。

分子和原子、原子结构[考点一]、构成物质的微粒:分子、原子等微粒1、由分子构成的物质:例如水、二氧化碳、氢气、氧气等物质2、由原子构成的物质:金属、稀有气体、金刚石、石墨等物质3、物质构成的描述:物质由××分子(或原子)构成。
例如:铁由铁原子构成;氧气由氧分子构成。
[考点二]、分子1、基本性质:⑴质量、体积都;⑵在不停地运动且与温度有关。
温度越高,运动速率例:水的挥发、品红的扩散;⑶分子间存在间隔。
同一物质气态时分子间隔,固体时分子间隔;物体的热胀冷缩现象就是分子间的间隔受热时增大,遇冷时变小的缘故。
⑷同种物质间分子的性质相同,不同物质间分子的性质不同。
2、分子的构成:分子由原子构成。
分子构成的描述:①某某分子由某某原子和原子某某构成。
例如:水分子由氢原子和氧原子构成②一个分子某某由几个原子某某和几个原某某子构成。
例如:一个水分子由一个氧原子和二个氢原子构成3、含义:分子是保持物质化学性质的最小微粒。
例:氢分子是保持氢气化学性质的最小粒子4、从分子和原子角度来区别下列几组概念⑴物理变化与化学变化由分子构成的物质,发生物理变化时,分子种类。
发生化学变化时,分子种类发生。
⑵纯净物与混合物由分子构成的物质,纯净物由同种分子构成;混合物由不同种分子构成。
⑶单质与化合物单质的分子由同种原子构成;化合物的分子由不同种原子构成。
[考点三]、原子1、含义:原子是化学变化中最小的微粒。
例:氢原子、氧原子是电解水中的最小粒子:在化学反应中分子分裂为原子,原子重新组合成新的分子。
原子的结构[考点一]、原子的构成(1(2(数值上等于核外电子数)相等,电性相反,所以原子不显电性因此:核电荷数= 质子数= 核外电子数(3)原子的质量主要集中在原子核上 注意:①原子中质子数不一定等于中子数②并不是所有原子的原子核中都有中子。
例如:氢原子核中无中子 二、核外电子的排布[考点一]1、原子结构图: ② 圆圈内的数字:表示原子的质子数②+:表示原子核的电性③弧线:表示电子层④弧线上的数字:表示该电子层上的电子数 1、 核外电子排布的规律:①第一层最多容纳 个电子; ②第二层最多容纳 个电子;③ 最外层最多容纳 个电子(若第一层为最外层时,最多容纳2个电子) 2、元素周期表与原子结构的关系:①同一周期的元素,原子的电子层数相同,电子层数=周期数②同一族的元素,原子的最外层电子数相同,最外层电子数=主族数 2、 元素最外层电子数与元素性质的关系金属元素:最外层电子数<4 易失电子 非金属元素:最外层电子数≥4 易得电子稀有气体元素:最外层电子数为8(He 为2) 不易得失电子最外层电子数为8(若第一层为最外层时,电子数为2)的结构叫相对稳定结构 因此元素的化学性质由原子的最外层电子数决定。



初中学科知识图谱一览初中阶段是学生接受基础教育的重要阶段,涵盖了各个学科的基础知识和技能。
在学习初中学科知识时,了解学科的体系和关联是很有帮助的。
下面将为大家呈现初中学科知识图谱一览,让我们逐一了解各学科的核心知识点和学科之间的联系。
语文学科知识图谱:语文学科是培养学生优秀的语言文字能力和审美情操的重要学科。
其核心知识点包括文字基本功、阅读理解、写作表达和文学欣赏。
文字基本功主要包括字词的认读和书写;阅读理解涉及对文章中信息的理解和推理;写作表达主要培养学生的写作能力;文学欣赏培养学生对各类文学作品的欣赏和理解。
数学学科知识图谱:数学学科是培养学生逻辑思维和运算能力的学科。
其核心知识点包括数与式、图形与变换、数据与情境以及应用问题解决。
数与式主要包括整数、有理数、分数、代数式等;图形与变换涉及点线面的空间关系和图形的变换;数据与情境是指数据处理和实际问题处理的能力训练;应用问题解决则是培养学生通过数学方法解决实际问题的能力。
英语学科知识图谱:英语学科是培养学生英语口语、听力、阅读和写作能力的学科。
其核心知识点包括语言知识、语言技能以及跨文化交际。
语言知识主要包括词汇、语法、语音等;语言技能包括听、说、读和写;跨文化交际则是指学生了解不同文化背景下的沟通和交流方式。
物理学科知识图谱:物理学科是研究物质的性质、结构、变化和能量转化的学科。
其核心知识点包括力学、热学、电磁学、光学和声学。
力学主要研究物体的力和运动;热学研究物体的热和温度;电磁学研究电、磁以及其相互转化;光学研究光的传播和反射;声学研究声音的产生、传播和接收。
化学学科知识图谱:化学学科是研究物质的组成、结构、性质、变化和相互关系的学科。
其核心知识点包括常见物质的特性、构造与变化、物质间相互作用、物质量的衡量和化学实验操作。
常见物质的特性主要包括酸碱性、氧化还原性等;构造与变化研究物质的结构和化学反应;物质间相互作用主要指物质的力与能;物质量的衡量则是指质量的计算和化学计量;化学实验操作包括实验仪器和化学实验方法。
初中化学知识结构图
初中化学
一、物质构成的奥秘
1.元素-----元素的概念和分类
2.离子-----核外电子排布的初步知识
3.有关化学式
的计算
4.化合价
5.原子
6.分子的概念和性质
7.物质的分类
8.化学式的书写、读法、意义
①相对分子量
②计算化合物中某种元素的质量分数
③计算化合物中各元素的质量比
①常见元素化合价
②化合价与化学式互推
二、身边的化学物质
1.溶液
2.氧气
3.水
4.二氧化碳
5.酸碱盐
6.空气
7.金属
8.氢气
9.碳
10.一氧化碳
①溶液、溶质、溶剂
②饱和溶液和不饱和溶液
③溶解度
④溶液中溶质的质量分数、溶液的配制
①氧气的性质和用途
②氧气的制取
①水的组成、硬水和软水
②保护水资源、节约用水
①二氧化碳的制取
②二氧化碳的性质、用途
① PH----溶液酸碱度的表
②几种常见的碱
③几种常见的酸
④几种常见的盐
⑤中和反应及其应
⑥化学肥料(特性、种类)
①空气的主要成分
②防治空气污染
①金属活动顺序
②生铁和钢
③常见金属、金属材料、合金
④金属的物理性质、化学性质
三、物质的化学变
1.物质的变化
2.四种基本反应类型;氧化反应、还原反应
3.催化剂与催化剂作用
4.质量守恒定律
5.化学方程式提供的信息、书写及其配平
6.利用化学方程式的计算
7.综合计算题
①物理变化、化学变化
②物理性质、化学性质。