九年级化学下册生活中常见的盐新人教版
- 格式:doc
- 大小:38.00 KB
- 文档页数:6





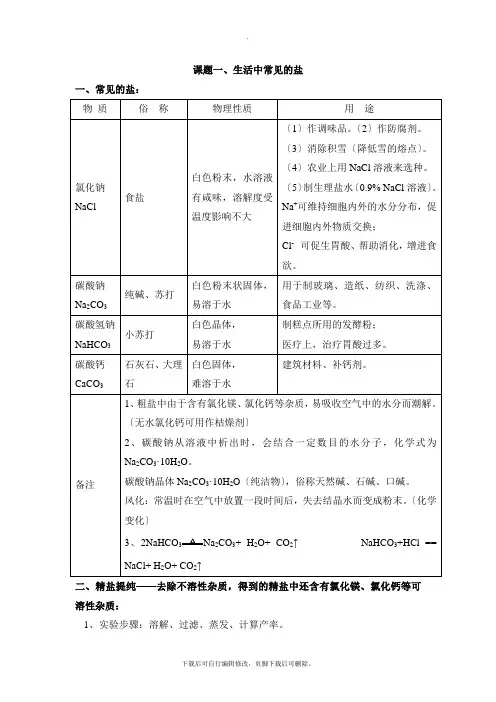
课题一、生活中常见的盐一、常见的盐:二、精盐提纯——去除不溶性杂质,得到的精盐中还含有氯化镁、氯化钙等可溶性杂质:1、实验步骤:溶解、过滤、蒸发、计算产率。
2、实验仪器:三、碳酸钠、碳酸氢钠、碳酸钙的化学性质: 1、碳酸钙的化学性质:〔1〕与酸的反响:CaCO 3+2HCl == CaCl 2 + CO 2↑+H 2O 〔2〕高温分解:CaCO 3高温CaO + CO 2 ↑2、碳酸钠的化学性质:〔1〕与酸的反响: Na 2CO 3 + 2HCl == 2NaCl + CO 2↑+ H 2O 〔2〕与碱溶液的反响;Ca(OH)2 + Na 2CO 3 == CaCO 3↓+ 2NaOH 3、碳酸氢钠的化学性质:与酸的反响; NaHCO 3 + HCl == NaCl +CO 2↑+H 2O 碳酸根离子的检验:CO 32- 无色气体 石灰水变浑浊检验CO 32-的方法:〔1〕参加稀HCl ,假设有无色气泡产生,那么存在CO 32-〔2〕参加石灰水或Ba(OH)2溶液,假设液体变浑浊,那么存在CO 32- 〔3〕参加CaCl 2或C a(N O 3)2溶液,假设液体变浑浊,那么存在CO 32- 三、盐的性质:1、酸、碱、盐的溶解性: 〔1〕酸:大多数都可溶。
〔2〕碱:只有氨水、氢氧化钠、氢氧化钾、氢氧化钡和氢氧化钙可溶于水,其余均为沉淀。
稀HCl 澄清石灰水这两个反响可用检验NaOH 是否变质〔3〕盐:钾盐、钠盐、硝酸盐、铵盐都可溶;硫酸盐除BaSO4难溶,Ag2SO4、CaSO4微溶外,其余都可溶;氯化物除AgCl难溶外,其余都可溶;碳酸盐除碳酸钾、碳酸钠、碳酸铵可溶,其余都难溶。
注:BaSO4、、AgCl 不溶于水,也不溶于酸。
2、盐的化学性质:〔1〕盐〔可溶〕+ 金属1 == 金属2 + 新盐〔条件:金属1比金属2活泼,K、Ca、Na除外〕反响类型:置换反响Fe + CuSO4 == Cu + FeSO4 (“湿法冶铜〞原理)2Al+ 3CuSO4 == Al2(SO4)3 + 3Cu Cu + 2AgNO3 == Cu(NO3)2 + 2Ag 〔2〕盐+ 酸== 新盐+ 新酸〔满足复分解反响的条件〕反响类型:复分解反响H2SO4 + BaCl2 == BaSO4↓+ 2HCl2HCl + Na2CO3 == 2NaCl + CO2↑+ H2O2HCl + CaCO3 == CO2↑+ CaCl2 + H2OHCl + NaHCO3 == H2O + NaCl +CO2↑HCl + AgNO3 == HNO3 + AgCl↓〔3〕盐+ 碱== 新盐+ 新碱〔反响物需都可溶,且满足复分解反响的条件〕反响类型:复分解反响2NaOH + CuSO4 == Cu(OH)2↓ + Na2SO4现象:出现蓝色沉淀〔注:Cu(OH)2沉淀:蓝色〕3NaOH + FeCl3 == Fe(OH)3↓ + 3NaCl现象:出现红褐色沉淀〔注:Fe(OH)3沉淀:红褐色〕Ca(OH)2 + Na2CO3 == CaCO3↓ + 2NaOH现象:澄清石灰水变浑浊〔4〕盐+ 盐== 两种新盐〔反响物需都可溶,且满足复分解反响的条件〕反响类型:复分解反响NaCl + AgNO3 == AgCl ↓+ NaNO3现象:出现白色沉淀Na2SO4 + BaCl2 == BaSO4↓+ 2NaCl现象:出现白色沉淀四、复分解反响:1、概念:由两种化合物互相交换成分,生成另外两种化合物的反响。


生活中常见的盐教学目标1.了解几种常见的盐(NaCl、Na2CO3、CuSO4)。
2.了解食盐和盐的不同含义。
3.常识性介绍结晶水、结晶水合物、风化等。
4.掌握结晶水合物式量的计算。
5.初步学会CO32-的鉴别方法。
教学重点NaCl、Na2CO3和CuSO4的用途,结晶水合物式量的计算;CO32-的鉴别方法。
教学思路为使教学过程条理分明,笔者将教材上编排的每种盐的知识点调整为制法、物理性质、化学性质和用途这一顺序,对没有编排化学性质的NaCl,则根据它可做化工原料这一用途,以及赞助全国初中化学竞赛(天原杯)的上海天原化工厂的生产情况,适当补充电解食盐水的反应。
为使学生看到清晰的实验现象,对演示碳酸钠与盐酸反应[实验]进行投影;演示碳酸钠晶体风化实验,因需要较长时间,当堂不能完成,教师事先将碳酸钠晶体放在教室里同学们都能看到的地方,让他们每天记录观察的结果,本节课时再提问学生汇报记录结果。
结晶水合物风化等概念的讲解,安排在“碱湖捞碱”之后进行,这样过渡自然;另外,为保证板书全部是每种盐的知识点,涉及到这几个概念的板书可用投影来代替。
制法和用途的介绍,力争用生动的语言,有趣的事实,使学生喜闻乐见。
教法的选择主要是讲授法,实验、板书、投影等直观教学法。
教学过程A.组织教学教师面带微笑进入教室,师生互致问候。
B.复习提问什么叫潮解?含有泥砂的粗盐在提纯时的主要操作是哪些?什么是盐?C.新课[引言]日常生活中我们经常接触到的物质,有许多是盐,如我们每天吃的食盐、净化水用的明矾、做豆腐用的石膏等。
今天,我来给同学们介绍三种常见的盐。
[板书]常见的盐[讲述]首先给同学们介绍NaCl。
[板书]一、NaCl[讲述]在盐这类物质中,有的有腐蚀性、有的有毒,而NaCl却是可以吃的盐,故它俗称食盐。
我国食盐产地分布很广,人们根据NaCl在自然界存在的不同形式而采用不同的方法来获得它。
下面我们就来学习NaCl的制法。
[板书]1.制法[讲述]如果NaCl像煤炭那样呈固态存在于地下,就采用直接开采的方法,得到的盐叫矿盐或岩盐。
[板书](1)直接开采法[讲述]我们安徽定远的盐矿,就是用这种方法来获得NaCl的。
如果NaCl存在海水中,就采用海水晒盐的方法,得到的盐叫海盐。
[板书](2)海水晒盐法[讲述]我国最大的盐场天津南堡盐场就是用这种方法来获得NaCl的。
(记录片《中国之最》安徽电视台)如果NaCl是在井水中,就采用盐井水煮盐的方法,得到的盐叫井盐。
[板书](3)盐井水煮盐法[投影]“蜀省井盐图”[讲述]这幅图形选自明代科学家宋应星编写的《天工开物》一书,它记述了我国劳动人民早在一千多年前就掌握了熬制井盐的方法。
直到今天,四川自贡的自流井生产出来的井盐还是最著名的。
如果NaCl是在湖水中,就采用盐湖水煮盐的方法,得到的盐叫池盐。
[板书](4)盐湖水煮盐法[讲述]我国青海省柴达木盆地的察尔汗盐池是我国最大的盐池。
上述各种方法首先得到粗盐,粗盐中因含有CaCl2、MgCl2等杂质而具有潮解性。
粗盐经提纯可制得精盐。
【讨论】为什么在晒盐的时候日晒、风吹都有利于食盐晶体的析出?为什么在晒盐时食盐晶体析出,而氯化镁、氯化钙却大部分留在卤水中?为什么制取食盐的时候,不宜采用降低溶液温度的方法?[板书]2.物理性质[展示]NaCl样品[讲述]NaCl是易溶于水的白色固体。
熔、沸点分别是801℃、1413℃。
[板书]3.化学性质—NaCl与H2O的反应[讲解]NaCl与H2O在通直流电的条件下能反应,生成NaOH、H2和Cl2。
[板书]2NaCl+2H2O2NaOH+H2↑+Cl2↑[讲述]被称为“天原杯”的全国初中化学竞赛是由上海天原化工厂赞助的,该厂就是利用上述化学反应来进行生产的。
[板书]4.用途[讲述]从刚才讲解的NaCl化学性质可知,NaCl是重要的化工原料。
[板书](1)化工原料[讲述]化学上不少的盐都有咸味,但只有NaCl咸味最纯正,故它可做调味品。
[板书](2)调味品[讲解]有些盐在外观和味道上虽然与NaCl相似,但它却是有毒的,像印染工业上使用的NaNO2,就属于这类盐,所以千万不要认为是盐就可以食用!最近十几年来,新闻媒介披露过多起吃牛肉发生中毒的事件,原因是有些不法商贩在煮牛肉时加入了一种强氧化性的盐NaNO3,它虽然使牛肉煮得很烂,但残留在牛肉中的NaNO3进入人体后,在肠道里会被还原为剧毒的NaNO2,从而使食用者发生中毒。
由于NaCl对人的生理活动起着很重要的作用,故制药厂可用高纯度的NaCl去配制生理盐水(含NaCl 0.9%)。
[板书](3)制生理盐水[板书]二、Na2CO3[讲解]因化工厂生产的Na2CO3,比从自然界获得的Na2CO3要纯净得多,又因Na2CO3溶液呈碱性,故Na2CO3俗称纯碱。
不过,它不属于碱。
[板书]1.制法[讲述]在我国内蒙一带的碱湖中含有大量的Na2CO3,夏天湖中的水大量蒸发,冬天湖水的温度降低,于是Na2CO3形成晶体析出,漂浮在湖面上,人们很容易把它打捞上来,这就是碱湖捞碱。
[板书](1)碱湖捞碱法[讲述]碱湖捞出的碱称之为天然碱。
内蒙古的伊克昭化工集团是我国最大的天然碱生产基地。
碱湖里捞出来的碳酸钠带有结晶水[投影]结晶水、结晶水合物和风化的定义。
[展示]几天前放在教室里的碳酸钠晶体。
[提问]几天来这块碳酸钠晶体发生了怎样的变化?[投影]碳酸钠晶体、硫酸铜晶体的化学式;计算这两种结晶水合物式量的方法。
[讲述]随着工业的发展对纯碱需求量的日益增大,仅靠碱湖捞出的碱远远满足不了需求。
那时,我国还不会用化学方法生产纯碱,只能从英国进口,而英国只向我们出售产品,并不提供生产技术。
到了第一次世界大战期间,因欧亚交通梗塞,进口的Na2CO3运不进来,一些以Na2CO3为原料的民族工业难以生存。
[展示]侯德榜肖像图[讲述]1921年在美国留学的侯德榜毅然回国,他通过几年的潜心研究,终于摸索出了英国生产纯碱所用的索尔维法的全套技术,使我国也能用化学方法生产纯碱了,以后他又不断探索制碱的新方法,于1940年研究成功联合制碱法,后来定名“侯氏联合制碱法”。
[板书](2)侯氏联合制碱法[板书]2.物理性质[展示]Na2CO3样品[讲述]Na2CO3是易溶于水的白色粉末[板书](3)化学性质—Na2CO3与HCl的反应[投影]碳酸钠与盐酸反应实验,引导学生观察现象。
[板书]2HCl+Na2CO3=2NaCl+H2O+CO2↑[讲解]许多的实验证明:凡是组成里含有CO32-的盐与盐酸反应都能生成CO2。
这一结论可以帮助我们鉴别盐类中是否含有CO32-[板书]4.用途[讲解]由于Na2CO3能与酸反应放出CO2,故可用Na2CO3与某些固体酸性物质混合,并加入适量的NaHCO3,制成发酵粉,用于发面。
[板书](1)配制发酵粉[讲解]当发酵粉与水一起和入面粉时,便开始产生CO2,生成的CO2气体在面团内形成许多微小的气室,随着温度升高,气室膨胀,等到面团蒸、烤时,就形成了疏松多孔、柔软可口的馒头或面包了。
当然上述反应里的固体酸性物质及反应产物都必须是对人体无害的。
Na2CO3还被广泛应用于纺织、造纸、肥皂、玻璃、洗涤剂和皮革等生产上,故它是重要的化工原料。
[板书](2)化工原料[板书]三、CuSO4[设问]在化学实验室里没有硫酸铜,但有硫酸铜晶体,那么,用什么方法能得到CuSO4。
[演示]CuSO4·5H2O受热分解的反应,引导学生观察现象。
[板书]CuSO4·5H2OCuSO4+5H2O↑[板书]2.物理性质[展示]刚制得的CuSO4样品[讲述]CuSO4是能溶于水的白色粉末[板书]3.化学性质—CuSO4与H2O的反应[演示]CuSO4与H2O的反应,引导学生观察现象。
[板书]CuSO4+5H2O=CuSO4·5H2O[提问]CuSO4吸水是不是潮解?[讲述]因CuSO4·5H2O像胆那样蓝、那样苦,故它欲称胆矾、蓝矾。
[板书]4.用途[讲述]因为CuSO4能够吸收大量的水。
故它可做干燥剂。
[板书](1)干燥剂[讲解]用CuSO4吸水时由白变蓝,现象明显,故可用它来检验水的存在。
[板书](2)检验水的存在[讲解]因CuSO4有毒,故它可做杀菌剂。
[板书](3)杀菌剂[讲述]把CuSO4与Ca(OH)2混合制成的农药,其杀菌效率比单用CuSO4高,而对作物的药害较小。
因该农药首先在法国的波尔多使用,故取名“波尔多液”。
在工业上精炼铜、镀铜及制造铜的化合物时,都要用到CuSO4。
[板书](4)镀铜、制铜及铜的化合物。
D 巩固练习(根据时间,灵活掌握)[投影]题目:1.KAl(SO4)2·12H2O的式量是多少?(学生板演)2.完成下列化学方程式(学生板演)。
K 2CO3+HCl,MgCO3+HCl,BaCO3+HCl。
3.化工厂用作原料的NaCl能做调味品吗?(学生回答)[讲述]用作工业原料的NaCl中,因含有对人体有害的杂质,故不能做调味品。
但市场上出售的食盐都必须加入一种杂质碘酸钾,吃这种含碘元素的盐能防止甲状腺肿大,特别有利于青少年智力的发展。
E小结本节课主要内容。
F布置作业。